米诺环素对白念珠菌的抑制作用分析*
2021-10-19邹莉,梅昭,关涛,邓群Δ
邹 莉,梅 昭,关 涛,邓 群Δ
三峡大学人民医院/宜昌市第一人民医院:1.检验科;2药学部,湖北宜昌 443300
白念珠菌广泛分布于环境中,被认为是人类最常见的机会性真菌病原体。它容易引起黏膜表面的侵袭性感染,尤其在免疫缺陷和菌群失调患者中可危及其生命。随着广泛长期使用抗真菌药物,白念珠菌耐药性迅速增加,增加了现有抗真菌药物对于临床药理治疗的难度[1]。近年来,科学研究对四环素类抗菌药物如米诺环素、四环素、多西环素等进行了重新评价,认为它们具有潜在的抗真菌活性[2-3]。本研究通过评估米诺环素对白念珠菌的体外抗真菌活性,为进一步研究米诺环素治疗白念珠菌感染的机制提供试验基础。
1 材料与方法
1.1菌株来源 收集2020年1-12月分离自本院的酵母菌临床标本46株,其中白念珠菌17株、热带念珠菌7株、葡萄牙假丝酵母菌4株、近平滑念珠菌4株、光滑念珠菌10株、拟平滑假丝酵母菌4株。所有菌株均经全自动微生物质谱检测仪鉴定到种,质控菌株白念珠菌(ATCC 90028)购自美国菌种保藏中心。
1.2仪器与试剂 VITEK MS全自动快速微生物质谱检测仪(法国生物梅里埃公司),米诺环素敏感性测试纸(美国Merck公司),米诺环素(美国Sigma公司),葡萄糖美蓝M-H药敏试验琼脂平板(美国Thermo公司),沙氏葡萄糖琼脂培养基(上海博赛生物技术有限公司),磷酸盐缓冲盐溶液(pH 7.0±2.0,实验室配制),96孔板(美国康宁公司),超微量分光光度计、微孔板酶标仪(美国Thermo公司),XTT试剂盒(上海生工公司),YPD液体培养基、YPD固体培养基、RPMI 1640液体培养基(美国Invitrogen公司),半胱氨酸蛋白酶(Caspase)3活性测定试剂盒(北京索莱宝科技有限公司)。
1.3菌株的活化及菌液配制 从4 ℃保存的SDA培养基上挑取白念珠菌质控菌株ATCC 90028及酵母菌临床菌株单菌落接种于YPD液体培养基中,37 ℃摇床振荡(200 r/min)过夜培养,使菌株处于对数生长期,12 000 r/min离心后收集菌体,磷酸盐缓冲盐溶液洗涤菌体2~3次,用RPMI 1640稀释至1×106CFU/mL保存备用[4]。
1.4抑菌圈测定 使用纸片扩散法对临床菌株进行药物敏感试验将菌株调整为0.5麦氏点的菌悬液,均匀扩散到葡萄糖美蓝M-H药敏平板,待平板表面干燥后贴上含米诺环素抗菌药物的药敏试纸,于28 ℃孵育24 h,测量抑菌环的直径。目前,细菌药敏纸片对酵母菌的药敏试验方法尚无参考标准,但根据本小组的前期数据及研究[5],笔者大致判断14 mm是其敏感的抑菌圈折点,抑菌圈直径≥14 mm判定为阳性。
1.5培养基形态学观察 配制含不同浓度米诺环素的YPD固体培养基,培养基中包含米诺环素的浓度分别为0、256、512和1 024 μg/mL,按1×105CFU/mL制备白念珠菌ATCC 90028,均匀涂布到YPD平板上,28 ℃孵育48 h,观察菌落形态。将未加入米诺环素的培养基作为对照组,加入米诺环素的培养基作为米诺环素干预组,米诺环素干预组进一步分为256 μg/mL组、512 μg/mL组、1 024 μg/mL组。
1.6菌丝的形成评估 将对数期白念珠菌细胞(1×106CFU/mL)在多种营养菌丝转化培养基(RPMI 1640培养基中添加20%胎牛血清)中培养,在含不同浓度米诺环素的24孔组织培养板中,37 ℃摇床孵育,分别在不同时间点(0、6、12 h)采集真菌细胞,采用Image View Systems数字细胞成像系统进行观察。并计数100个细胞中菌丝所占的比例。
1.7浮游细胞和白念珠菌生物膜的代谢活性 添加100 μL细菌(1×106CFU/mL)液体到96孔培养板,于37 ℃黏附90 min后,吸样枪轻轻移除未黏附的浮游细胞,再添加100 μL新鲜RPMI 1640培养液,37 ℃培养24 h,直到成熟的生物膜成立。抽吸生物膜上清液,加入含不同浓度米诺环素的RPMI 1640培养液孵育24 h,显微镜下观察生物膜的生长情况,使用XTT试剂盒测量成熟生物膜细胞的代谢活性,用酶标仪于570 nm处以空白孔调零测各孔吸光度(A)值。同样,为了检测米诺环素对浮游细胞的影响,在100 μL细菌液体中加入米诺环素,37 ℃摇床培养24 h,在570 nm处测量A值,观察米诺环素对浮游细胞的作用。
1.8米诺环素对白念珠菌生物膜细胞Caspase 3活性的影响 指数生长期的白念珠菌悬液调整细胞浓度为1×106CFU/mL,用不同剂量的米诺环素处理,37 ℃孵育24 h,离心收集白念珠菌细胞,使用Caspase 3活性测试盒测定生物膜细胞Caspase 3活性。磷酸缓冲盐溶液轻柔洗涤3次,弃上清液,加裂解液冰浴裂解;4 ℃离心10~15 min,加入反应液、裂解液及AcDEVD-PNA,振荡重悬沉淀,37 ℃孵育4 h,发现颜色有明显变化时,离心取上清液,用酶标仪在405 nm测定其A值,计算米诺环素干预组白念珠菌细胞内Caspase 3活性程度的相对值(即A米诺环素干预组/A对照组)。

2 结 果
2.1米诺环素对6种酵母菌作用的比较 米诺环素对酵母菌作用后产生抑菌圈直径≥14 mm的菌种有3种,抑菌圈最大的是白念珠菌,且抑菌圈阳性率最高,其次为葡萄牙假丝酵母菌和部分热带念珠菌;抑菌圈直径<14 mm的菌种为部分热带念珠菌、拟平滑假丝酵母菌、近平滑念珠菌和光滑念珠菌;其中光滑念珠菌的抑菌圈直径均<6 mm,表明米诺环素对光滑念珠菌没有抑制作用。各酵母菌的抑菌圈直径与14 mm比较,差异均有统计学意义(P<0.05)。见表1。
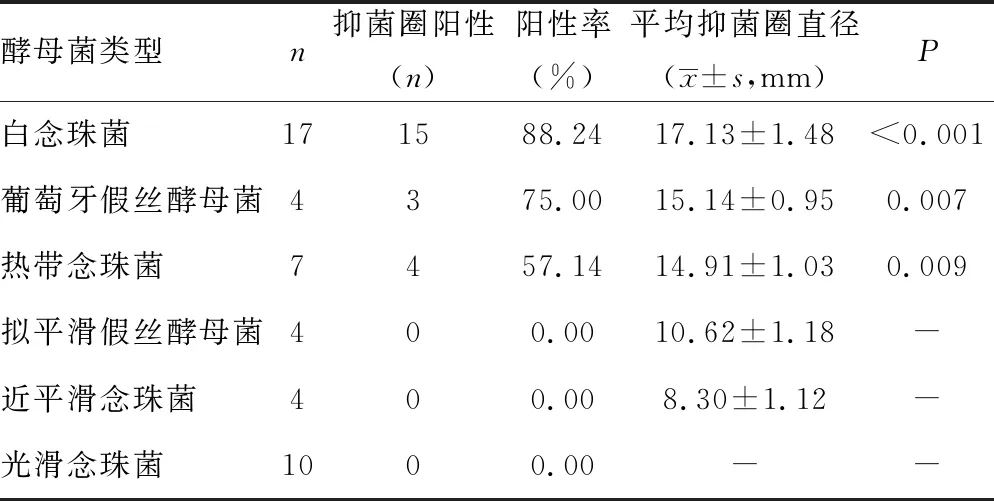
表1 米诺环素对酵母菌作用后产生抑菌圈情况的比较
2.2米诺环素对白念珠菌菌落形态的影响 在YPD固体培养基,对照组白念珠菌菌落表面出现宽型褶皱及白斑,显示出明显的丝状结构;米诺环素干预组白念珠菌菌落表面相对光滑,褶皱及白斑明显减少,丝状结构和菌落大小随米诺环素浓度增加而减少,见图1。

注:白念珠菌ATCC 90028在不同浓度米诺环素的YPD固体培养基上,28 ℃培养48 h。
2.3米诺环素对白念珠菌菌丝生长的影响 显微镜观察结果表明,米诺环素抑制了白念珠菌由酵母形式向菌丝形式的转化。6 h后,对照组有大量菌丝生长,而米诺环素干预组菌丝生长均受到明显抑制,256 μg/mL组此时菌丝所占比例最小,为13.33%±2.05%;在12 h后,对照组菌丝大量萌芽,菌丝数量及长度明显增加,米诺环素干预组菌丝增长缓慢,其生长明显受抑制,256 μg/mL组此时菌丝所占比例最小,为15.00%±2.94%,米诺环素在256 μg/mL组展示出最佳抑制效果。见图2。
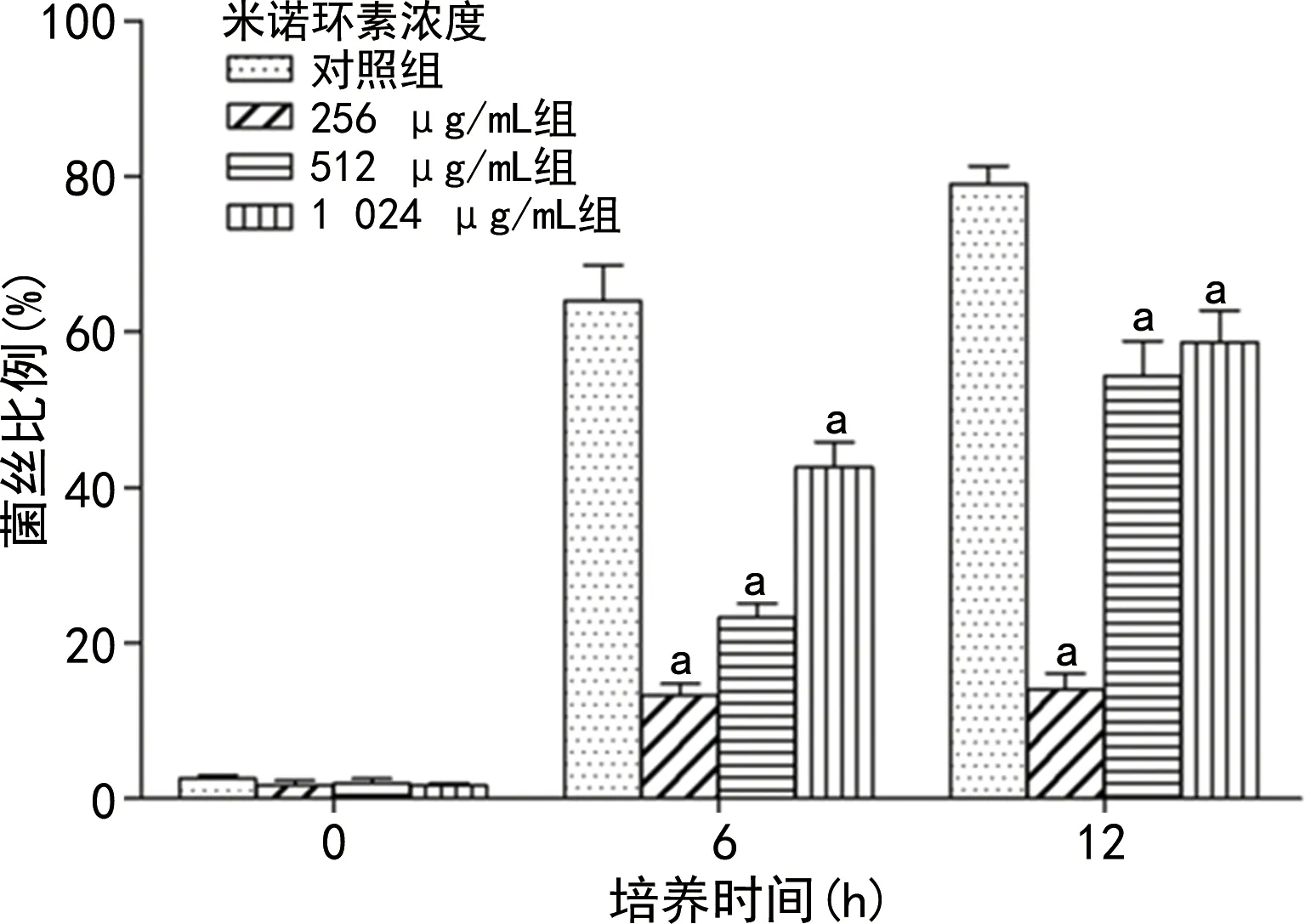
注:与同时期对照组比较,aP<0.05。
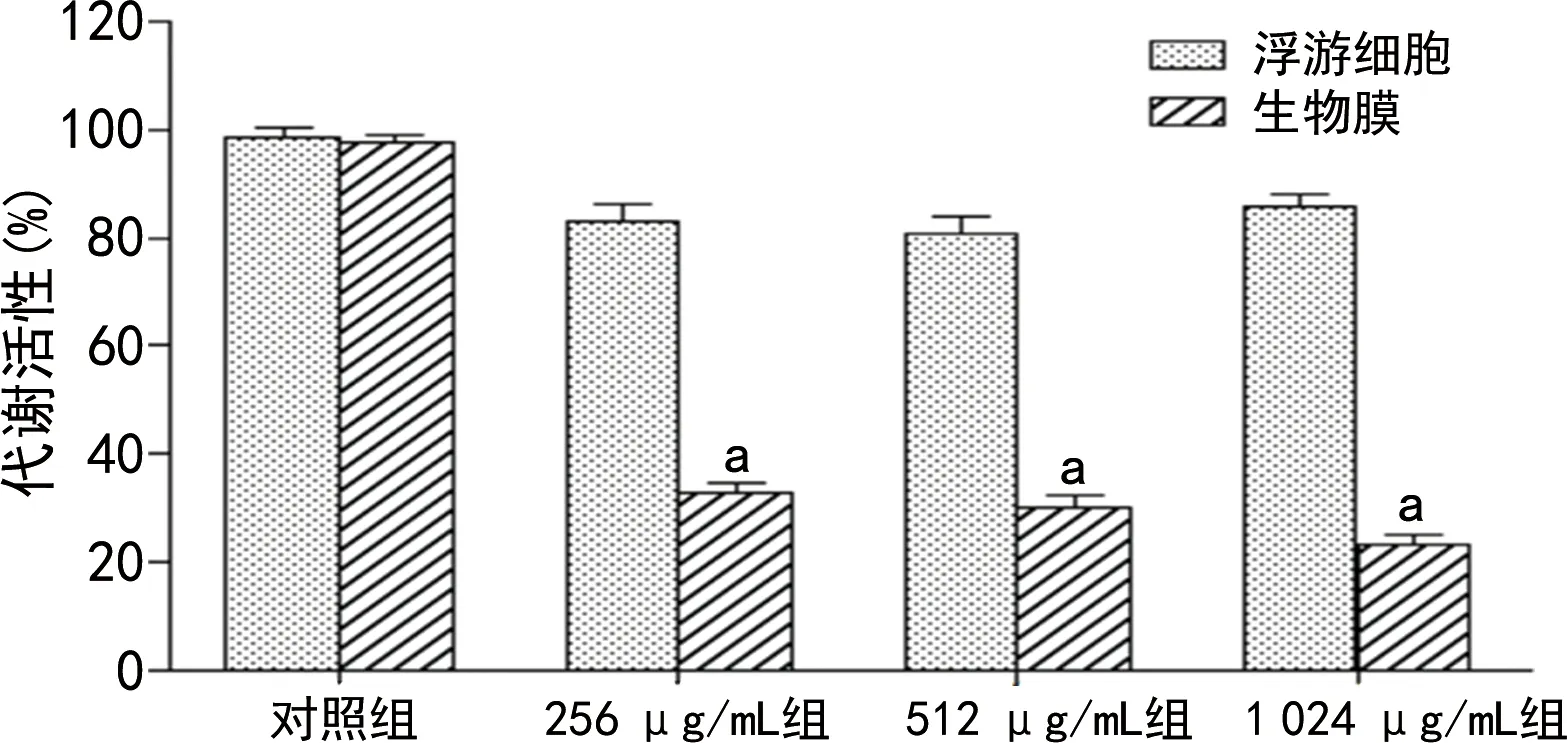
2.4米诺环素对白念珠菌生物膜和浮游细胞代谢活性的影响 XTT还原试验结果显示,加入米诺环素后,白念珠菌生物膜代谢活性明显下降。256 μg/mL组中,白念珠菌生物膜代谢活性为33%,随着米诺环素浓度的增加,白念珠菌生物膜代谢活性下降趋于稳定,米诺环素干预组各组与对照组比较,差异均有统计学意义(P<0.05)。但米诺环素对白念珠菌浮游细胞代谢活性没有明显抑制作用,在不同米诺环素干预组中,其代谢活性仅略有降低,米诺环素干预组各组与对照组比较,差异无统计学意义(P>0.05),见图3。
2.5米诺环素对白念珠菌生物膜细胞Caspase 3活性的影响 与对照组比较,256 μg/mL组、512 μg/mL组、1 024 μg/mL组Caspase 3活性程度均升高(P<0.05),但米诺环素干预组各组间的Caspase 3活性程度比较差异无统计学意义(P>0.05),见表2。
注:与同对照组比较,aP<0.05。

表2 4组白念珠菌生物膜细胞Caspase 3活性比较
3 讨 论
近年来,由于环境和机体的不断刺激导致真菌变化和突变,以及广泛和长期使用有限的抗真菌药物,使白念珠菌耐药性迅速增加,给白念珠菌感染患者的治疗带来了很大的困难。为了解决现有抗真菌药物对于患者的临床药理治疗的缺陷,研究者正在不断寻找新的抗真菌药物或现有抗真菌药物的增敏剂,有研究者发现,米诺环素联合其他抗菌药物对金黄色葡萄球菌、鲍曼不动杆菌和白念珠菌均有加强抑制作用[2,7]。
米诺环素为一种传统的抗细菌药物,本研究发现,米诺环素对酵母菌显示出不同的抑菌效果,但是目前米诺环素对假丝酵母菌属的药敏试验方法尚无操作标准及规范化,笔者通过纸片扩散法结果发现,米诺环素对白念珠菌、葡萄牙假丝酵母菌和部分热带念珠菌抑菌圈直径均≥14 mm,表明米诺环素具有较强的抗酵母菌活性,其中对白念珠菌具有明显的抑制作用。米诺环素对部分热带念珠菌、拟平滑假丝酵母菌、近平滑念珠菌和光滑念珠菌作用后产生抑菌圈直径均<14 mm,说明其对这几种酵母菌无抑制作用,这可能与酵母菌的种类、形态转化和毒力有关[8],需要进一步的研究来证实。
形态转变在真菌生物膜的生物学及其与宿主的相互作用中起着重要作用。ZHONG等[9]研究证实,丝状真菌在生长形成生物膜过程中,其长度和厚度直接影响菌丝的致病性,且二者呈正相关。白念珠菌的菌丝由于形态丰富多样,其菌丝形式比酵母形式更难被宿主的防御系统所消除,故菌丝形式下致病性比酵母形式强[10]。本研究结果显示,在YPD固体培养基,对照组白念珠菌菌落表面出现宽型褶皱,显示出明显的丝状结构;加入米诺环素后白念珠菌菌落表面褶皱减少,相对光滑,且丝状结构随米诺环素浓度增加而减少或是消失。本研究选取了3个时间点进行研究,分别为0、6、12 h。在不同时间点,白念珠菌的菌丝形式和酵母形式所占比例不同。一般情况下,随着白念珠菌生长,菌丝会随之生长,菌丝所占比例增大。本研究结果显示,在6 h后,对照组有大量菌丝生长,而在米诺环素干预组中,菌丝生长均受到明显抑制,12 h后对照组菌丝大量萌芽,菌丝数量及长度明显增加,而米诺环素干预组中,白念珠菌菌丝生长仍明显受到抑制,在米诺环素干预组各组之间,256 μg/mL组菌丝所占比例最小。提示米诺环素对白念珠菌菌丝生长具有抑制作用,明显抑制了白念珠菌从酵母形式向菌丝形式的转化,且256 μg/mL浓度的米诺环素对白念珠菌具有最佳抑制作用。SANAE[11]认为这可能与芽孢相关基因HWP1、ECE1及ALS3下调密切相关,米诺环素作用于白念珠菌菌丝生长这一过程,与传统的抗真菌药物氟康唑、两性霉素B作用于白念珠菌的过程大致相同[12-13]。
白念珠菌生物膜是一个复杂的三维结构,可以增强其对常见的抗真菌药物的耐药性,也给白念珠菌感染的临床治疗增加了难度[14]。本研究XTT还原试验结果表明,米诺环素能明显抑制白念珠菌生物膜代谢活性,256 μg/mL组生物膜代谢活性下降最明显,此浓度下代谢活性仅为33%,随着米诺环素浓度的增加,其对生物膜代谢活性的抑制作用趋于稳定。说明米诺环素浓度为256 μg/mL时对生物膜代谢活性的抑制作用已达到或接近最佳效果,这可能与生物膜代谢及此浓度下菌丝所占比例最小有关。值得注意的是,对照组和米诺环素干预组浮游细胞的代谢活性差异无统计学意义(P>0.05),即米诺环素对白念珠菌浮游细胞的代谢活性无明显抑制作用。
Caspase家族可以改变自身分子构象而自我激活,激发Caspase 3发生级联反应,选择性地切割多种细胞质、细胞核蛋白质,促进广泛的蛋白质分解改变,最终启初受损组织的细胞凋亡[15]。Caspase 3是Caspase一系列级联反应的关键酶,是诱导细胞凋亡、死亡的最终执行者[16-19]。本研究结果显示,加入米诺环素可明显提高生物膜细胞内Caspase 3活性,推测米诺环素对白念珠菌的凋亡作用是通过Caspase 3的作用导致其生物膜的凋亡。
近年来,有研究者发现,米诺环素在与抗真菌药物如氟康唑合用时,可增强氟康唑穿透生物膜的能力,诱导细胞内钙释放,可在减小氟康唑使用剂量的同时达到相同的抑菌效果,二者对白念珠菌的体外生长产生协同抑制作用,其作用机制可能与环磷酸腺苷的水平及相关的转录因子有关[2]。此外,米诺环素与氟康唑联合应用对新型隐球菌同样表现出持续抑制细胞膜和抗真菌活性的作用[20],且在动物模型中也发现,米诺环素与氟康唑联用能保护幼虫免受耐药性新型隐球菌的感染[3]。本研究发现,米诺环素对白念珠菌体外活性的抑制作用主要表现在抑制其菌丝生长、激活Caspase 3活性,从而导致生物膜代谢活性下降和细胞凋亡,目前国内外鲜见报道。鉴于此,笔者推测米诺环素作用于真菌生物膜发挥其抗真菌活性的过程可能涉及多个通路及转录因子,其相关机制有待进一步研究。
综上所述,本研究证实了米诺环素对白念珠菌具有较强的抗生物膜活性及凋亡作用,提示米诺环素可能是一种有效的抗白念珠菌感染的药物。这为米诺环素临床治疗白念珠菌感染提供了重要的试验依据,具有潜在的应用价值。但需要更多的敏感株、耐药株及动物模型来进一步深入验证米诺环素的临床适用性,对其深入研究对进一步阐明白念珠菌耐药的发生机制及寻找新型抗真菌药物均有重要意义。
