下调GIT1对乳腺癌MCF-7细胞增殖、凋亡能力及周期分布的影响
2021-10-19缪文青张阳严海冬
缪文青 张阳 严海冬
临床医学将发生于机体乳腺上皮组织的恶性肿瘤称为乳腺癌,是一种临床较为常用的恶性肿瘤[1]。乳腺癌患者主要临床表现为乳腺肿块、乳头溢液等,严重威胁患者身体健康[2,3]。乳腺癌症状发病具有较为明显的性别差异,据世界卫生组织调查数据显示,99%左右的乳腺癌患者为女性[4,5]。在欧美地区,乳腺癌发病率高达15%左右,相比之下,我国乳腺癌发病率较低,但是近年来一直呈现上升趋势,作为一项公共卫生问题引起广大专家的关注,许多学者致力于乳腺癌临床治疗的研究[6,7]。本文研究中设计实验,对乳腺癌MCF-7细胞中GIT1蛋白表达进行靶向调控,旨在探究下调GIT1对乳腺癌MCF-7细胞增殖、凋亡能力及周期分布的影响。
1 材料与方法
1.1 材料 研究细胞:乳腺癌MCF-7细胞(中国医学科学院)。兔抗小鼠Bcl-2、Bax抗体(Sigma公司);大鼠抗小鼠caspase3抗体(Gibco 公司);小鼠抗大鼠MMP-9抗体(Hyclone公司);兔抗大鼠ICAM-1抗体(BD公司)。本实验获我院伦理委员会批准。
1.2 方法
1.2.1 细胞培养:在40℃的环境中对冻存的乳腺癌MCF-7细胞进行火浴处理(40℃),之后进行充分摇晃,将摇晃均匀的乳腺癌MCF-7细胞置于2 ml的培养基(10%PBS、1%双抗(青链霉素)RPMI-1640培养基500 ml)之内,之后使用2 000 r/min的离心机进行离心处理,进行重悬处理后将细胞传代,使用CO2培养箱对培养基培养24 h、换液,细胞融合率达90%后传代。
1.2.2 慢病毒载体构建及分组:GIT1基因序列根据质粒特点进行引物设计,引入SacⅠ酶切位点(由上海生工生物工程技术服务有限公司完成),GIT1下游序列:5’-GGTTGACTGGCAGGAAGG-3’。GIT1上游序列:5’-ATGGATGTGTATGACGAAGTG-3’。正反链混合后加入退火缓冲液,96℃反应4 min,室温冷却,生成双链。使用Eco31Ⅰ酶切线性化质粒pGenesil-1,100倍稀释退火产物之后与其连接,20℃下水浴孵育过夜,使用大肠杆菌DH5α转化,第2天选择单克隆菌落,在30 μg/ml Kana的LB培养液中接种,2 000 r/min离心处理,37℃下震混,孵育过夜。少量抽提质粒后使用SacⅠ酶切进行鉴定(由宝生物工程(大连)有限公司完成),分为空白组、上调GIT1组和下调GIT1组,重悬处理后分别加入4 μg 0.9%氯化钠溶液、pcDNA3.1-GIT1、GIT1siRNA,电击处理后室温环境下存放120 min,将3组细胞加入6孔、96孔培养板中,置于培养箱内进行培养取出后加入含800 μg/ml G418的培养基再次培养。
1.2.3 细胞增殖检测:MTT法检测3组细胞增殖能力。将3组细胞加入96孔板中,分别于12、24、48、72 h 后在每孔中加入30 μl的MTT液,37℃孵育4 h,弃培养液,加入150 μl的DMSO,酶标仪在498波长处检测每孔OD值。
1.2.4 TUNEL法检测细胞凋亡情况:常温环境中使用20 μg/ml蛋白酶K培养0.5 h后去除蛋白,使用PBS缓冲液进行彻底清洗,之后将平衡缓冲液100 μl加入其中,室温环境中平衡10 min,之后滴入TdT酶反应液100 μl,避光、室温环境中孵育1 h,之后加入100 μl SSC溶液,常温环境中静置20 min后进行清洗3次,之后使用DAPI进行复染,避光培养10 min后再次进行浸洗,封片观察。DAPI复染细胞核呈蓝色,凋亡细胞细胞核呈绿色,取每切片3视野进行观察、计算细胞凋亡率,计算平均值。
1.2.5 流式细胞仪检测细胞周期分布:将3组细胞传代至5孔板,并将其置于5% CO2、37℃环境中培养,之后添加0.25%胰蛋白酶进行消化,离心处理10 min,使用PBS缓冲液进行清洗,再次离心处理,之后添加1 ml PI染液,置于常温、避光环境60 min,进行特异荧光标记后按照流式细胞仪操作方法检测细胞周期分布。
1.2.6 细胞侵袭情况:使用Transwell小室实验检测。2 h前湿化小室。上室加入细胞悬液200 μl,在下室加入含10%胎牛血清的细胞培养液,在培养箱中培养24 h。用PBS冲洗2次后置于4%多聚甲醛中30 min。染色后放在显微镜下观察计数。
1.2.7 细胞迁移情况:使用细胞划痕实验检测。将细胞使用胰酶消化制成细胞悬液,接种于6孔板。使用10枪尖垂直于孔板底部画直线,PBS缓冲液清洗3次。常温培养24 h拍照计算划痕。
1.2.8 Western blot法检测Bcl-2、Bax、caspase-3、MMP-9、ICAM-1表达:使用PBS缓冲液对标本冲洗之后裂解30 min,测定蛋白浓度。取20 μg/孔蛋白质,添加蛋白缓冲液后进行电泳,10 min后将电转膜置于10%的牛奶中浸泡,常温环境下封闭90 min。之后结合一抗、稀释,孵育1 d,取出后使用TBST液冲洗,结合二抗,60 min后清洗、显色,对Bcl-2、Bax、caspase-3、MMP-9、ICAM-1相对表达量进行检测。
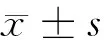
2 结果
2.1 3组细胞增殖率、凋亡率比较 在第24、48、72小时,上调GIT1组细胞增殖率高于空白组,凋亡率低于空白组,差异有统计学意义(P<0.05);下调GIT1组细胞增殖率低于空白组、上调GIT1组,凋亡率高于空白组、上调GIT1组,差异有统计学意义(P<0.05)。见表1。
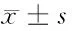
表1 3组细胞增殖率、凋亡率比较
2.2 3组细胞周期分布情况比较 上调GIT1组处于G1期的细胞比例低于空白组,处于S、G2期的细胞比例高于空白组,且下调GIT1组处于G1期的细胞比例均高于空白组、上调GIT1组,处于S、G2期的细胞比例低于空白组、上调GIT1组,差异有统计学意义(P<0.05)。见表2。
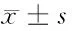
表2 3组细胞周期分布情况比较
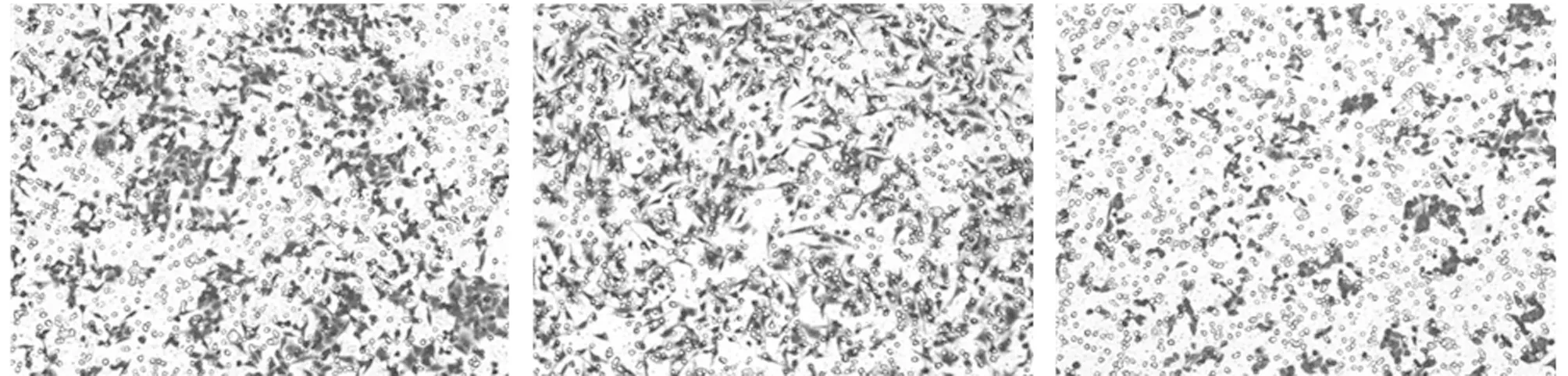
2.3 3组细胞侵袭、迁移能力比较 上调GIT1组细胞侵袭细胞数、迁移细胞数均高于空白组,差异有统计学意义(P<0.05);下调GIT1组细胞侵袭细胞数、迁移细胞数均低于空白组、上调GIT1组,差异有统计学意义(P<0.05)。见表3,图1、2。
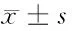
表3 3组细胞侵袭、迁移能力比较 个,

2.4 3组细胞Bcl-2、Bax、caspase-3相对表达量比较 上调GIT1组细胞Bcl-2相对表达量低于空白组,Bax、caspase-3相对表达量高于空白组,且下调GIT1组细胞Bcl-2相对表达量高于空白组、上调GIT1组,Bax、caspase-3相对表达量均低于空白组、上调GIT1组,差异有统计学意义(P<0.05)。见表4,图3。
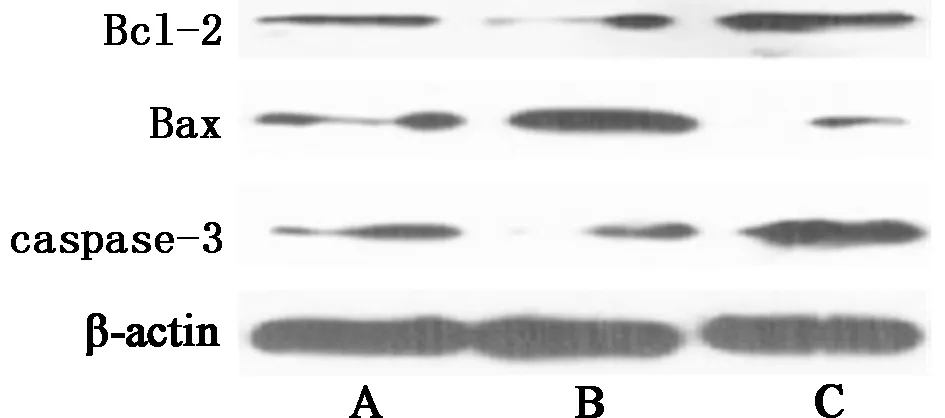
图3 Bcl-2、Bax、caspase-3表达WB图;A 空白组;B 上调GIT1组;C 下调GIT1组
表4 3组细胞Bcl-2、Bax、caspase-3相对表达量比较
2.5 3组细胞MMP-9、ICAM-1相对表达量比较 上调GIT1组细胞MMP-9、ICAM-1相对表达量均高于空白组,且下调GIT1组细胞MMP-9、ICAM-1相对表达量均低于空白组、上调GIT1组,差异有统计学意义(P<0.05)。见表5,图4。
表5 3组细胞MMP-9、ICAM-1相对表达量比较
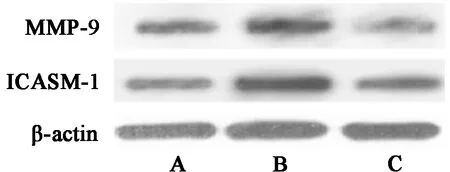
图4 MMP-9、ICAM-1表达WB图;A 空白组;B 上调GIT1组;C 下调GIT1组
3 讨论
有学者认为乳腺癌症状的发生具有一定的规律性,并总结了许多乳腺癌发病高危因素,但目前临床医学尚未将乳腺癌症状的发病机制研究透彻[8,9]。有专家学者致力于乳腺癌症状发病机制、治疗方法的研究,旨在寻找一个有效的治疗靶点对乳腺癌症状进行治疗[10,11]。作为一种多区域骨架蛋白,GIT1表达的变化与细胞增殖、凋亡能力具有密切联系。有学者在研究中表示,GIT1在HeLa细胞中呈现高表达,下调GIT1表达对细胞增殖、迁移具有一定的抑制作用。但是目前关于调控GIT1表达对乳腺癌MCF-7细胞增殖、凋亡能力、周期分布等生物学行为影响的研究鲜有报道。
癌组织的发生发展与细胞增殖、凋亡能力的变化密切相关[12]。有研究表明,乳腺癌组织细胞增殖率较高、凋亡率较低,调控乳腺癌癌细胞增殖、凋亡能力对乳腺癌组织发生发展具有重要的抑制作用,是临床治疗乳腺癌的关键[13]。本文研究结果显示,下调GIT1蛋白表达的乳腺癌MCF-7细胞增殖率相对较低、凋亡率相对较高,说明下调GIT1蛋白表达能够有效抑制乳腺癌MCF-7细胞增殖、促进乳腺癌MCF-7细胞凋亡,从而抑制乳腺癌MCF-7细胞的不断增殖、发展。
细胞活动的基础生物学行为是周期分布,细胞周期分布的变化与细胞增殖、凋亡状况的变化密切相关[14,15]。细胞周期分为DNA合成前期、合成期、合成后期,将癌细胞阻滞在DNA合成前期,能够有效抑制癌细胞增殖、扩散。本文研究结果显示,下调GIT1蛋白表达的乳腺癌MCF-7细胞处于G1期的细胞比例较高,处于S、G2期的细胞比例较低,说明下调GIT1蛋白表达能够阻滞乳腺癌细胞周期分布,抑制乳腺癌细胞增殖,促进乳腺癌细胞凋亡,从而影响乳腺癌细胞的不断发展。
有研究表明,癌细胞的不断发展扩散与其不断侵袭、迁移具有密切联系,抑制癌细胞的侵袭、迁移是抑制癌组织不断生长、扩散的关键[16,17]。本文研究结果显示,下调GIT1蛋白表达的乳腺癌MCF-7细胞侵袭、迁移细胞数相对较少,说明下调GIT1蛋白表达能够抑制乳腺癌细胞的侵袭、迁移。
癌细胞增殖、凋亡能力的变化与细胞凋亡蛋白相对表达量的变化密切相关。Bcl-2、Bax是线粒体细胞凋亡通路中的重要基因,二者表达的变化与细胞凋亡密切相关[18,19]。caspase-3作为caspase家族重要成员,与细胞凋亡密切相关[20]。本文研究结果显示,下调GIT1蛋白表达的乳腺癌MCF-7细胞Bcl-2相对表达量较高,Bax、caspase-3相对表达量较低,说明下调GIT1蛋白表达能够调控细胞凋亡相关蛋白Bcl-2、Bax、caspase-3的表达,从而起到促进乳腺癌细胞凋亡、抑制乳腺癌细胞增殖、发展的作用。ICAM-1、MMP-9表达的变化与癌细胞侵袭、迁移能力具有密切联系[21,22]。本文研究结果显示,下调GIT1蛋白表达的乳腺癌MCF-7细胞ICAM-1、MMP-9相对表达量相对较低,说明下调GIT1蛋白表达能够下调ICAM-1、MMP-9相对表达量,从而起到抑制乳腺癌细胞侵袭、迁移的作用。
综上所述,下调GIT1蛋白的表达能够抑制乳腺癌MCF-7细胞增殖、侵袭、迁移,调控细胞周期分布,促进乳腺癌MCF-7细胞凋亡,调控Bcl-2、Bax、caspase-3、MMP-9、ICAM-1蛋白相对表达量,为乳腺癌的临床治疗提供一定的参考依据。
