磷硫代siRNA的YAP基因沉默活性研究
2021-10-18唐硕,黄震
唐 硕, 黄 震
(四川大学生命科学学院生物资源与生态环境教育部重点实验室, 成都 610065)
1 引 言
Yes相关蛋白(YAP)位于基因座11q22,是Hippo途径的主要效应子,通过与靶基因相互作用来调节细胞增殖和凋亡[1-2].作为转录共激活因子,YAP在信号传导中起着复杂的作用. 通常,YAP被认为是一种原癌基因,YAP的上调会导致未转化的乳腺上皮细胞从上皮向间充质过渡,异常增殖并抑制细胞凋亡[3]. 此外,在大多数肿瘤细胞中,尤其是在卵巢癌,胃癌和肝细胞癌中,都观察到了YAP过表达[4-7].但是,YAP还可以在散发性乳腺癌中起抑癌作用,其中已证明YAP可以正向调节p53家族成员[8]. 这些使YAP在肿瘤治疗领域具有一定的研究价值.
RNA干扰(RNAi)技术在临床治疗中具有巨大的潜力,其中小干扰RNA(siRNA)是进行基因功能研究的有效工具[9-11].但是,未修饰的siRNA仍有一些缺陷,例如低效率、在循环系统中的快速清除等[12].为了改善siRNA的药代动力学特性,人们采用了各种化学修饰方法,如2′-OMe,2′-F和通过硫代磷酸酯(PS)取代的磷酸二酯键修饰等[13-17].PS修饰是较成熟的方法,作为一种硫原子的单原子取代,其对siRNA结构的影响较小.然而,PS-siRNA的应用还面临一些问题,在一些报道中,化学合成的PS-siRNA表现出严重的细胞毒性以及较差的沉默活性[11,18-20].这可能是由于PS中心具有手性(Rp或Sp)[21],导致使用常规方法合成的PS-siRNA产物是一种非对映异构体混合物,其对RNA诱导沉默复合物(RISC)的加载效率较低[22]. 不幸的是,固相化学合成尚无法获得纯非对映体PS-siRNA(pPS-siRNA),相比之下,人们已开发出了T7 RNA聚合酶转录策略来合成pPS-siRNA,此种方法得到的产物具备单一的R构型[17,23-25].因此,尽管产量相对较低,酶促合成法制备的 pPS-siRNA仍存在一定的研究价值[26].

图1 化学结构(A)未修饰的RNA和硫代磷酸RNA的化学结构; (B)P-手性链接Fig.1 Chemical structures(A) unmodified RNA and phosphorothioate RNA; (B) P-chiral Linkages
为了探索YAP基因对癌细胞生长的影响及磷硫代siRNA的应用潜力,本文比较了pPS-siRNA和未修饰的siRNA(PO-siRNA)的基因沉默活性,研究了YAP在HeLa细胞系细胞周期和增殖中发挥的作用. 研究中使用的所有siRNA均来自T7 RNA聚合酶体外酶促合成. 结果表明pPS-siRNA在抑制YAP基因表达时比PO-siRNA更有效,并且没有明显的细胞毒性. 此外,YAP基因的下调一定程度上抑制了HeLa细胞的增殖,这提示了一种潜在的癌症治疗策略.
2 材料与方法
2.1 材 料
2.1.1 细胞株 宫颈癌细胞株HeLa购自于ATCC细胞库.
2.1.2 主要试剂 胎牛血清(FBS)购自于Gibco生物公司;高糖培养基DMEM 和胰蛋白酶购自于Hyclone 生物公司;cDNA 合成试剂盒和显影液(EasySee Western Blot Kit)购自全式金公司;RNA 提取试剂盒Eastep®Super Total RNA Extraction Kit购自于promaga 公司;Exfect®2000转染试剂购自于诺唯赞生物科技股份有限公司;qPCR 试剂购自于Takara 生物公司;苯甲磺酰氟化物(PMSF)和RIPA裂解液均购自于索莱宝生物公司;脱脂奶粉,BSA,溴化噻唑蓝四氮唑(MTT)等均购自上海生工生物;兔单克隆YAP抗体和鼠单克隆GAPDH抗体分别购自于Cell Signaling Technology及Proteintech公司;二抗HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)及HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)购自于Proteintech 公司;细胞周期与细胞凋亡检测试剂盒,Bradford蛋白浓度测定试剂盒购自碧云天.
2.2 方 法
2.2.1 细胞培养与转染 HeLa细胞培养于含10%胎牛血清的DMEM培养基中.该细胞培养在含5% CO2,37 ℃的细胞孵箱中,每2~3 d传一次代,传代比例为1∶6.使用Exfect®2000转染试剂进行siRNA的转染,操作步骤依照相应说明书进行.
2.2.2 寡核苷酸的制备 靶向YAP的siRNA的序列已经在之前的文献中有过报道[27],为5′-GGTGATACTATCAACCAAA-TT-3′.乱序siRNA的序列由本实验室自行设计,为5′-TACAAATATCACGGTAAGCTT-3′.本研究中的所有siRNA均由T7 RNA聚合酶体外转录得到.对于PO-siRNA的合成,于EP管中加入2 μmol/L DNA模板,15 U/μL T7 RNA聚合酶,0.1 U/μL RNA酶抑制剂,10 mmol/L NTPs以及转录缓冲液[1x浓度:Hepes-KOH( 12 mmol/L,pH 8.5,MgCl2(4.6 mmol/L),亚精胺(0.2 mmol/L),BSA(0.01 mg/mL)],于37 ℃水浴中孵育6 h.对于pPS-siRNA的合成,使用的NTPs为ATPαS、UTPαS、CTPαS及未修饰的GTP,其余与PO-siRNA相同.最后,酶促合成产物经凝胶纯化并由酶标仪定量.
2.2.3 血清稳定性实验 进行血清稳定性测定以确定酶促合成的PO-和pPS-siRNA的稳定性. siRNA溶液(双链siRNA)均在10%FBS存在下于37 ℃孵育,随后在不同时间间隔(0、2、4、6和8 h)取样. 样品在液氮中急冻,并储存在-80 ℃下.最后,通过12.5%的非变性丙烯酰胺凝胶分析实验结果.
2.2.4 qPCR实验 转染48 h之后收取HeLa细胞,并通过Eastep®Super Total RNA Extraction Kit提取总RNA.通过TransScript®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR kit得到cDNA.qPCR引物如下:YAP正向引物5′-CCTGATGGATGGGAACAAGC-3′,反向引物5′-GCACTCTGACTGATTCTCTGG-3′[28];GAPDH正向引物5′-CAGGAGGCATTGCTGATGAT-3′,反向引物5′-GAAGGCTGGGGCTCATTT-3′.
2.2.5 Western blot实验 转染48 h后收取细胞,并使用RIPA裂解缓冲液于冰上裂解.蛋白定量后,进行10%的SDS-丙烯酰胺凝胶电泳,每孔上样量20 μg.之后,在恒流260 mA的条件下转膜90 min,将蛋白转至PVDF膜上.将PVDF膜在5%脱脂奶粉中室温封闭2 h.洗膜后,将含YAP的PVDF膜与兔单克隆YAP抗体(Cell Signaling Technology,#14074),含NADPH的PVDF膜与鼠单克隆GAPDH抗体(Proteintech,#60004)分别在4 ℃过夜孵育.第二天再次洗膜,并与相应的二抗HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)及HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)室温孵育2 h.最后,洗膜并使用EasySee Western Blot Kit化学发光检测目的蛋白.分析及定量统计由ImageJ软件完成.
2.2.6 MTT实验 将HeLa细胞以每孔3×103个的数量铺至96孔板中,每孔设置5个重复孔,共铺4块板.4 块板同时进行一次给药,给药前将96孔板中的培养基换成新的含10%血清的DMEM 培养基.给药之后,分别于第0 h、24 h、48 h、72 h 用MTT染料处理细胞,每孔加入10 μL 5 mg/mL 的MTT 溶液,混匀后于细胞孵箱中培养4 h.4 h后吸去培养液,每孔加入100 μL DMSO,使用酶标仪在560 nm 处测量显色反应.最后,使用GraphPad Prism 7 软件进行数据处理.
2.2.7 流式细胞术分析 转染48 h后收取细胞,使用冰浴的PBS缓冲液清洗3次.之后,使用70%冰浴的乙醇于4 ℃过夜固定.随后,再次清洗细胞并使用Cell Cycle and Apoptosis Analysis Kit根据其说明书为细胞染色.最终,样品经BD FACScalibur流式细胞仪检测,并通过ModFit软件进行分析.
2.2.8 统计分析 使用GraphPad Prism 7软件进行数据分析.两组之间的差异通过t检验分析,P<0.05时认为具有统计学意义.
3 结果和讨论
3.1 血清稳定性实验
为了研究酶促合成的pPS-siRNA的血清稳定性,本文使用胎牛血清(FBS)进行了血清稳定性测定.将酶促合成的pPS-和PO-siRNA(均为双链)与10%FBS溶液在37 ℃下孵育,在0、2、4、6和8 h取样,并通过12.5%的非变性丙烯酰胺凝胶分析siRNA的稳定性. 研究发现PO-siRNA在孵育2 h后几乎全部降解,而pPS-siRNA在同一时间还剩余约50%(图2). 这表明pPS-siRNA比PO-siRNA具有更好的稳定性.
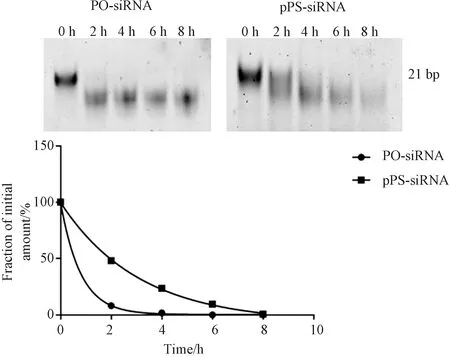
图2 pPS-siRNA与未修饰的对应物PO-siRNA的核酸酶抗性对比Fig.2 Nuclease-resistance of pPS-siRNAs over PO-siRNAs, the canonical counterparts
3.2 沉默活性研究
本文通过qPCR和Western blot测定了HeLa细胞中PO-和pPS-siRNA的YAP基因沉默活性(图3). 转染并孵育48 h后,收取HeLa细胞,通过qPCR和Western blot分析样品. 研究发现空白对照和乱序的PO-、pPS-siRNA组(PO-siScr和pPS-siScr)均未显示出对YAP基因的抑制作用,而靶向YAP的PO-和pPS-siRNA(PO-siYAP和pPS-siYAP) 显著抑制YAP的内源性表达. 此外, pPS-siYAP的YAP敲除效率比PO-siYAP更高(约高30%),推测可能归因于pPS-siRNA较高的细胞内稳定性,硫代磷酸酯修饰延长了siRNA的半衰期[19].相反,在J Winkleretal.的研究中,与未修饰的PO-siRNA相比,非对映体混合物PS-siRNA的基因沉默效果降低了[11,18],这可能是由于非对映体混合物在RISC复合物中的负载较低所致[22].
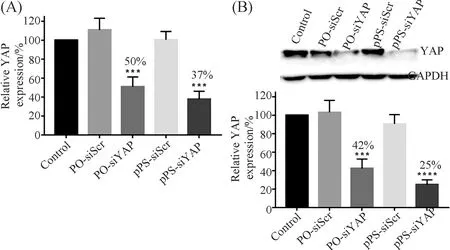
图3 转染和孵育48 h后YAP基因的表达(A)qPCR检测YAP mRNA水平,并将GAPDH用作内参; (B)Western blot进行分析,使用GAPDH作为内参. 对照组用PBS缓冲液转染Fig.3 YAP gene expression after transfection and incubation for 48 h(A) Detected by qPCR, and GAPDH was used as an endogenous control; (B) analyzed by Western blot using antibodies against YAP, and GAPDH was used as an endogenous control. The control group was transfected with PBS buffer
3.3 细胞增殖试验
为了研究pPS-siRNA的细胞毒性及其下调YAP表达后对HeLa细胞增殖的影响(图4和5),进行了MTT分析. 在下调YAP表达后,进行MTT细胞增殖实验以研究酶促合成的pPS-siRNA的细胞毒性及其对HeLa细胞增殖的影响. 用MTT处理后,以0、24、48和72 h的时间间隔分析细胞,并绘制HeLa细胞的生长曲线. 对照组用PBS缓冲液转染(图4). 数据显示PO-siScr和pPS-siScr组的增殖曲线与空白对照组相同,表明pPS-siRNA无明显细胞毒性. 另外,PO-siYAP、pPS-siYAP组HeLa细胞的生长显示出受到抑制的趋势,相比PO-siYAP组,pPS-siYAP组的抑制效果更好. 结果表明,YAP的下调可以在一定程度上抑制HeLa细胞的生长,这与文献报道是一致的[29-31],其中pPS-siRNA抑制效果较好,并且没有明显的细胞毒性. 相反,在Z Y Lietal.的报道中,非对映体混合物PS-siRNA表现出更高的细胞毒性[32].

图4 YAP基因表达的下调抑制HeLa细胞的增殖Fig.4 Down-regulation of YAP gene expression can decrease cell proliferation in HeLa cells

图5 转染和孵育48 h后酶促合成的siRNA对HeLa细胞形态的影响(A)用PBS缓冲液转染的HeLa对照细胞; (B)HeLa-PO-siScr细胞; (C)HeLa-PO-siYAP细胞; (D)HeLa-pPS-siScr细胞; (E)HeLa-pPS-siYAP细胞. 实验组细胞状态良好,未观察到对细胞形态的影响Fig.5 Effect of the transcribed siRNAs on the morphology of HeLa cells after transfection and incubation for 48 h(A) HeLa-control cells transfected with PBS buffer; (B) HeLa-PO-siScr cells; (C) HeLa-PO-siYAP cells; (D) HeLa-pPS-siScr cells; (E) HeLa-pPS-siYAP cells. The cells transfected with pPS-siRNA were in good condition and no effect on cell morphology was observed
3.4 细胞周期分析
为了研究YAP基因沉默对HeLa细胞周期的影响,进行了PI染色的流式细胞术检测(图6).转染并孵育48 h后,收获HeLa细胞并用PI染色,随后用流式细胞仪进行分析. 对照组用PBS缓冲液转染.研究发现,在YAP表达下调后,G0 / G1期的细胞蓄积增加,从57.6%(使用PBS对照)到62.7%(PO-siYAP)和65.4%(pPS-siYAP),而 G2 / M期的细胞蓄积减少,从13.0%(对照)降至11.4%(PO-siYAP)和9.90%(pPS-siYAP). 这些结果表明,YAP的下调可能导致HeLa细胞的增殖在G0 / G1期停滞,这与MTT实验结果以及YAP在促进细胞增殖和存活中的作用一致,并与多种肿瘤细胞的凋亡有关[28,33-34].然而,尽管呈现出一定趋势,这种抑制在HeLa细胞中并不显著,可能YAP对不同细胞生长的影响存在差异[33].

图6 YAP基因下调表达后HeLa细胞的生长状况Fig.6 Cell cycle of HeLa cells after down-regulation of YAP gene expression
4 结 论
研究表明,pPS-siRNA具有较高的核酸酶稳定性,无明显的细胞毒性,并且在YAP基因沉默中比其PO-siRNA对应物更具活性. 酶法合成的pPS-siRNA克服了化学合成mPS-siRNA(非对映异构体混合物)的缺陷,该方法在基因功能研究和siRNA治疗领域将具有重要价值. 此外,本文已经证实,YAP表达的下调可以抑制细胞增殖,表明其在肿瘤发生和发展中的重要作用,具有一定的研究价值.
