不同海拔区域内牦牛肠道菌群结构组成多样性研究
2021-10-18王保宁陈昱作罗润波周赛赛李天娇索朗斯珠
王保宁, 陈昱作, 贡 嘎, 罗润波, 周赛赛, 李天娇, 索朗斯珠
(1.四川大学华西基础医学与法医学院, 成都 610041;2.西藏农牧学院, 林芝 860000)
1 引 言
牦牛(Yak,Bosgrunniens)是高寒地区的特有牛种,草食性反刍动物,也是我国的主要牛种之一,其大多数集中于青藏高原中心地带及东部边缘的青海、甘肃和四川西北部[1]. 不同地区的牦牛分布的海拔存在较大的差异[2]. 牦牛是高寒牧区畜牧业中最重要的畜种之一[3]. 由于高海拔地区低温高寒、草木结构单一、季节不平衡,寒冷季节饲草饲料储备缺乏等原因,牦牛常常表现出营养不良,体重出现负增长[4]. 近年来,高海拔牦牛向低海拔迁徙,在低海拔地区建设圈舍,采用舍饲培育牦牛,正成为发展牦牛产业的一个创新措施[5]. 本文采用宏基因组测定分析技术对不同海拔地区的牦牛肠道菌群组成结构进行比较研究,初步探索了高低不同海拔区域内的牦牛肠道菌群结构组成,为高低不同海拔区域内的牦牛迁徙和饲喂提供了肠道微生态研究基础.
2 材料与方法
2.1 样本采集
随机采集西部不同海拔区域的12头成年牦牛的新鲜粪便,其中海拔3 000 m以下地区归为低海拔组(LA),平均海拔2942.5,样本4例,海拔4 000 m以上地区归为高海拔组(HA),平均海拔4 372.5,样本8例. 取样后立即存于液氮中. 样本信息见表1.
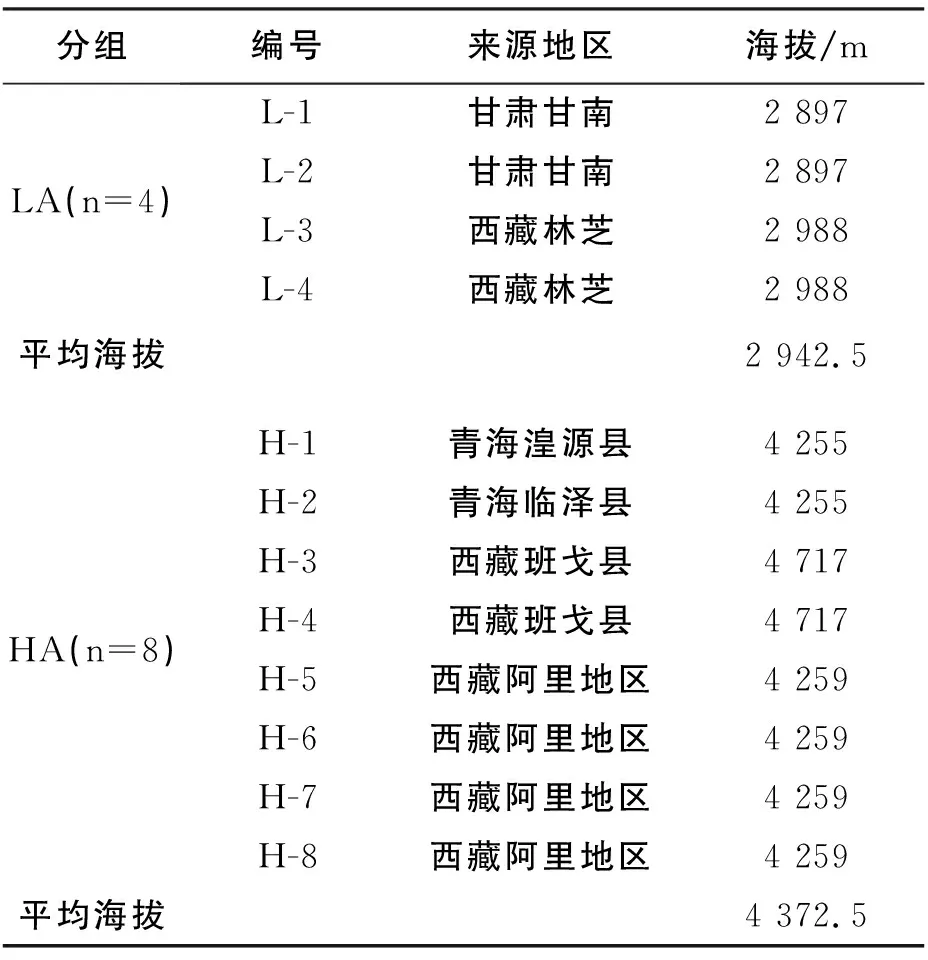
表1 样本来源
2.2 方 法
2.2.1 样品处理与DNA提取 将待测样本中加入1 mL 65 ℃预热的CTAB提取液,震荡混匀,常规乙醇法提取DNA,加入50~100 μL含10 mg/mL RNase的无菌ddH2O,溶解DNA沉淀,37 ℃水浴锅消化1 h后保存在-20 ℃冰箱.
2.2.2 16s rDNA扩增与扩增产物回收纯化 采用细菌16s rDNA V3+V4区域通用引物[6]:上游338F: 5′-ACTCCTACGGGAGGCAGCAG-3′,下游806R:5′-GGACTACHVGGGTWTCTAAT-3′,25 μL体系:模板50 ng,上下游引物各2.5 μL,Pusion Hot start flex 2×Master Mix 12.5 μL. 扩增条件:98 ℃预变性30 s;98 ℃ 10 s,54 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 延伸10 min,于4 ℃保存. PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收,回收采用AxyPrep PCR Cleanup Kit回收.
2.2.3 扩增产物定量混样上机测序及物种分析 对纯化后的PCR产物采用Quant-iTPicoGreen dsDNA Assay Kit在Promega QuantiFluor荧光定量系统上对文库进行定量,合格的文库浓度应在2 nmol/L以上. 将合格的各上机测序文库(Index序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经NaOH变性为单链进行上机测序;使用MiSeq测序仪进行2×300 bp的双端测序,相应试剂为MiSeq Reagent Kit V3 (600 cycles). 将获得的序列在NCBI BLAST 数据库中比对后获得物种信息.
2.2.4 数据分析 基于操作分类单元(Operational Taxonomic Units, OTU)的统计结果,计算样品的alpha多样性,用来分析物种变化趋势. 根据物种特异基因丰度表和物种注释表,从门、纲、目、科、属、种水平,对相对OTU丰度进行聚类分析,用t检验对高低海拔组间相对丰度的进行差异分析.
3 结 果
3.1 高低不同海拔牦牛肠道菌群结构总体差异
分析测序12个样本的OTU,高低海拔OTU共有5 322个,其中高海拔4 237个,低海拔4 824个,高低海拔共有的为3 739个,高海拔牦牛特有的肠道菌群为498个,低海拔牦牛特有的微生物为1 085个,低海拔牦牛肠道菌群比高海拔牦牛肠道菌群种类高出587个.
3.2 不同分类水平对高低不同海拔牦牛肠道菌群结构成分分析
3.2.1 门水平肠道菌群结构成分分析 牦牛粪便样本中共有19个门的细菌. 从门水平对肠道菌群种12个样本的OTU丰度进行物种聚类统计分析显示,低海拔牦牛前三的菌群以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria),为主,其平均丰度分别为69.38%、15.37%和7.74%;高海拔牦牛以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),其平均丰度分别为73.21%、14.56%和4.06%.
3.2.2 纲水平肠道菌群结构成分分析 牦牛粪便样本中共有21个纲的细菌,如图1. 从纲水平对12个样本的OUT丰度进行物种聚类统计分析显示,低海拔牦牛粪便样本中前三菌群为梭菌纲(Clostridia)拟杆菌纲(Bacteroidia)和以及变形菌纲(Gammaproteobacteria),其平均丰度分别为64.17%、14.36%和6.12%;高海拔样本中前三菌群为梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)和杆菌纲(Bacilli),其平均丰度分别为13.46%、62.04%和8.12%.
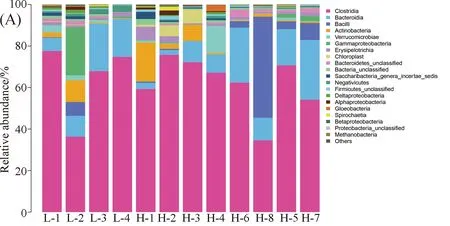
图1 牦牛肠道菌群在纲水平的分布图(A)及分布热度图(B)Fig.1 The community structure map (A) and the community structure heatmap(B) of samples at the class level in intestinal tract of yaks
3.2.3 目水平肠道菌群结构成分分析 牦牛粪便样本中共有21个目的细菌,如图2. 从目水平对不同海拔牦牛肠道菌群种12个样本的OTU进行物种分类统计分析显示,低海拔牦牛粪便样本中前三菌群分别为梭菌目(Clostridiales)、拟杆菌目(Bacteroidales)和假单胞菌目(Pseudomonadales),其平均丰度分别为14.36%,平均丰度64.16%和5.72%;高海拔前三菌群分别为梭菌目(Clostridiales)拟杆菌目(Bacteroidales)和芽孢杆菌目(Bacillales),其平均丰度分别为62.02%、13.46%和8.02%.
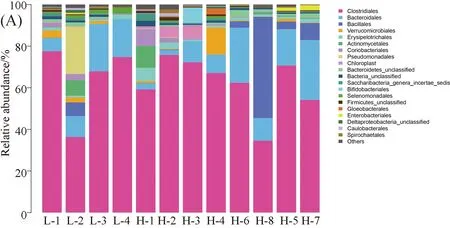
图2 牦牛肠道菌群在目水平的分布(A)及分布热度图(B)Fig.2 The community structure map (A)and the community structure heatmap (B) of samples at the order level in intestinal tract of yaks
3.2.4 科水平肠道菌群结构成分分析 牦牛粪便样本中共有21个科的细菌,如图3. 从科水平对不同海拔牦牛肠道菌群种12个样本的OTU进行物种聚类统计分析显示,低海拔样本中前三的菌群分别为瘤胃菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)和梭菌科(Clostridiaceae),其平均丰度分别为36.35%, 12.59%和 6.43%;高海拔牦牛粪便样本中前三的菌群分别为瘤胃菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)和活动性球菌科(Planococcaceae),其平均丰度分别为29.04%、15.14%和6.64%.
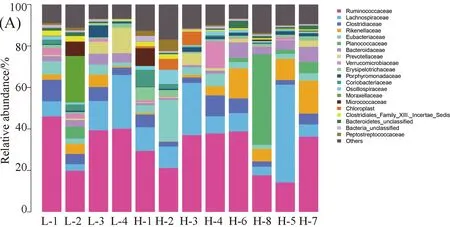
图3 牦牛肠道菌群在科水平的分布(A)及分布的热度图(B)Fig.3 The community structure map (A) and the community structure heatmap(B) of samples at the family level in intestinal tract of yaks
3.2.5 属水平肠道菌群结构成分分析 牦牛粪便样本中共有21个属的细菌,如图4. 从属水平进行物种聚类统计分析显示,低海拔牦牛样本中前三的菌群分别为瘤胃菌属(Ruminococcaceae_unclassified)、梭菌属(Clostridium)和不动杆菌属(Acinetobacter),其平均丰度分别为24.45%、6.30%和5.60%;高海拔样本中前三的菌群分别为瘤胃菌属(Ruminococcaceae_unclassified)、活动性球菌属(Planococcaceae_unclassified)和理研菌属(Rikenella),其平均丰度分别为20.27%、6.25%和5.53%.
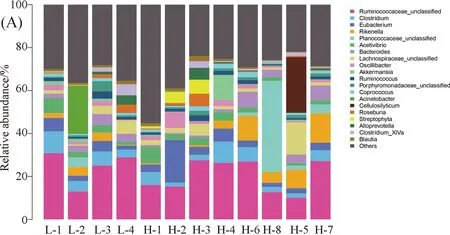
图4 牦牛肠道菌群在属水平的分布(A)及分布的热度图(B)Fig.4 The community structure map (A)and the community structure heatmap (B) of samples at the genus level in intestinal tract of yaks
从属水平对高低海拔牦牛样本的OTU丰度分析显示,低海拔牦牛肠道菌群前30菌群丰度总量为83.41%,而高海拔同类菌群丰度总量为58.29%. 低海拔牦牛样本中前3的菌群分别为瘤胃球菌属(Ruminococcaceae_ UCG-005)、瘤胃球菌属(Ruminococcaceae_ UCG-013)和克里斯滕森氏菌群(Christensenellaceae_ R-7_ group). 高海拔样本中前3的菌群分别为瘤胃球菌属(Ruminococcaceae_ UCG-005),瘤胃解纤维素菌属(Cellulosilyticum)和 理研菌科胃肠菌群(Rikenellaceae_ RC9_ gut_ group),数据显示除瘤胃球菌属(Ruminococcaceae_ UCG-005)外,高低海拔牦牛肠道菌群属OTU丰度各不相同,具体见表2.

表2 高、低海拔牦牛肠道菌群Top 30菌群丰度
从属水平对前30种菌OTU的丰度分析显示,高低海拔牦牛的肠道菌群有8个菌属的差异比较显著(P<0.05),具体为:瘤胃球菌属(Ruminococcaceae_ UCG-013,OTU丰度低海拔8.48%,高海拔2.97%)、克里斯滕森氏菌群(Christensenellaceae_ R-7_ group,低海拔6.71%,高海拔3.68%)、氧化还原菌属([Eubacterium]_oxidoreducens_ group,低海拔5.33%,高海拔1.58%)、瘤胃球菌属(Ruminococcaceae_ UCG-014,低海拔4.63%,高海拔2.50%)、阿克曼菌属(Akkermansia,低海拔2.27%,高海拔0.59%)、考拉杆菌属(Phascolarctobacterium,低海拔1.96%,高海拔0.49%)、难培养菌属(uncultured_bacterium_o_Gastranaerophilales,低海拔1.62%,高海拔0.51%)、瘤胃球菌属(Ruminococcaceae_ UCG-002,低海拔1.30%,高海拔0.42%). 低海拔区域牦牛肠道菌群OTU整体丰度较高海拔高,其中瘤胃球菌和氧化还原菌属的OTU丰度比高海拔高2倍多.
4 讨 论
肠道菌群种类的丰富性和多样性对维持肠道微生态平衡起着重要作用[7]. 而生活在高、低海拔的牦牛肠道菌群的差异目前尚无报道. 牦牛正常的肠道菌群在进化过程中与宿主和环境相互适应且成动态平衡,容易受到食物、环境等因素的影响,加之肠道菌群数量较大,结构复杂,因此其研究存在一定难度. 随着高通量测序技术的发展,使得16s rDNA测序成为研究肠道菌群的重要工具. 本研究采用16 s RNA高通量测序首次对高、低海拔两种环境下的牦牛肠道菌群结构组成进行分析,发现低海拔和高海拔地区牦牛肠道菌群OTU数量分别为4 824个和4 237个,说明低海拔地区牦牛肠道菌群多样性较高海拔地区牦牛肠道菌群多样性更高,可能是因为低海拔地区植被更丰富,环境中细菌多样性更高造成的.
在门水平上,高低海拔牦牛肠道菌群中最多的均为厚壁菌门(Firmicutes,OTU丰度低海拔69.38%,高海拔73.21%)和拟杆菌门(Bacteroidetes,OTU丰度低海拔15.37%,高海拔14.56%),这一研究与Guo等人(2015)对牛瘤胃微生物的菌群结构研究结果相似[8].
本研究显示高低海拔牦牛肠道菌群存在较大差异,其中瘤胃球菌属(Ruminococcaceae_ UCG-013)、瘤胃球菌属(Ruminococcaceae_ UCG-014)、瘤胃球菌属(Ruminococcaceae_ UCG-002)、克里斯滕森菌科(Christensenellaceae_ R-7_ group)、氧化还原菌属([Eubacterium]_oxidoreducens_ group)、阿克曼菌属(Akkermansia)、考拉杆菌属(Phascolarctobacterium)、难培养菌属(uncultured_bacterium_o_Gastranaerophilales)等差异显著,低海拔地区牦牛肠道菌群中瘤胃球菌属和氧化还原菌属的OTU丰度比高海拔高2倍多. 瘤胃球菌是反刍动物胃中严格厌氧不运动的革兰氏阳性菌,主要含白色瘤胃球菌和生黄瘤胃球菌两类,广泛分布于牦牛的瘤胃中[9],是牦牛肠道中的优势菌群,与牦牛消化功能有着密切的关系. 研究证实,瘤胃球菌产生的纤维素酶能够吸附并降解植物细胞壁,有效提高牦牛消化高纤维植物的能力[10]. 本研究发现高海拔地区牦牛的肠道菌群中,瘤胃球菌丰度显著低于低海拔地区牦牛. 若高海拔地区的牦牛向低海拔地区迁徙时,由于高海拔地区牦牛肠道内瘤胃球菌等优势菌的丰度较低,高海拔地区牦牛肠道微生态短时间内无法适应低海拔的环境条件,可能导致牦牛对纤维素的消化不良,进而引起牦牛腹泻. 这与Han等人发现的腹泻的牦牛肠道菌群中瘤胃球菌明显下降一致[11]. 事实证明,当高海拔地区的牦牛向低海拔地区引进时,牦牛常常会出现腹泻的现象,可能与不同海拔地区牦牛肠道菌群结构组成差异有关,其具体原因及机制还需进一步研究.
我国2008年批准了16种微生物添加剂,乳酸菌、芽孢杆菌、酵母、双歧杆菌、肠球菌、链球菌等均是名录上微生物添加剂中的菌种,这些益生菌对维护动物肠道健康、缓解不良应激反应、改善畜舍环境、调节机体脂肪代谢、替代抗生素和改善畜产品品质有着重要的作用[12]. 在高海拔地区的牦牛向低海拔地区引进时,在牦牛的日粮中补充益生菌,是否有助于牦牛尽快适应低海拔地区环境需进一步研究. 另外,不同海拔地区牦牛的交流,可能有助于提升某一区域牦牛肠道菌群多样性,本研究表明了高、低海拔牦牛肠道菌群结构存在较大的差异,为高海拔地区的牦牛向低海拔迁徙提供了微生态结构的参照,有利于牦牛饲养业、畜牧业探索不同海拔区域间牦牛的物种交流.
