ω-3鱼油脂肪乳对腹腔镜辅助胃癌根治术后影响的研究
2021-10-18程康文马冬花孙陟王亚娟王洁左贵泽王贵和
程康文 马冬花 孙陟 王亚娟 王洁 左贵泽 王贵和
胃癌病人多存在营养风险或营养不良,根治性手术是其重要治疗手段,但手术创伤应激,会导致术后机体处于分解代谢旺盛、炎症应激及免疫抑制状态,使得术后并发症仍处于较高水平[1-2]。肠外营养可以补充机体术后能量蛋白质需求,改善机体营养状态,降低胃癌术后并发症发生率[3];其中脂肪乳是肠外营养的重要组成部分。ω-3鱼油脂肪乳主要成分是ω-3多不饱和脂肪乳(ω-3 PUFAs),含有二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),ω-3 PUFAs被认为是一种免疫营养素,可作为受体激动剂,调节分子信号通路、降低炎症反应,保护免疫功能,改善营养状况,降低术后感染性并发症,从而改善术后临床结局[4-7]。我们选择存在营养风险的胃癌病人,术后使用含有鱼油脂肪乳的肠外营养,观察术后临床恢复情况、肠内营养耐受情况及并发症发生情况,探讨ω-3鱼油脂肪乳的临床应用效果。
对象与方法
一、对象
采用前瞻性研究方法,收集2018年2月~2019年10月我院胃肠外科拟行腹腔镜胃癌根治术病人,通过电脑随机平均分为研究组和对照组,研究组胃癌根治术后肠外营养中添加ω-3鱼油脂肪乳,对照组术后肠外营养中未添加ω-3鱼油脂肪乳。纳入标准:(1)术前胃镜病理明确诊断为胃癌;(2)年龄18~82岁;(3)入院后使用欧洲肠外肠内营养学会营养风险筛查2002(nutritional risk screening 2002,NRS 2002)营养风险筛查评分≥3分;(4)影像学评估可行根治性手术;(5)术前无肝、肾等重要器官功能障碍;(6)术前未使用免疫调节剂或激素治疗。排除标准:术前存在严重高血压、心脏病或高脂血症;术后存在血流动力学不稳或生命体征不稳无法使用肠外营养。共纳入符合研究的病人89例,排除9例,研究组和对照组各40例。其中男56例,女24例;年龄37~81岁,平均年龄(64.4±9.5)岁,体质量指数(body mass index,BMI)平均为(22.10 ±1.57)kg/m2;NRS 2002评分平均(4.05±1.28)分;肿瘤直径平均(3.4±1.9)cm。两组病人性别、年龄、BMI、NRS 2002营养风险筛查评分、手术时间、手术方式、吻合方式、术后病理分期、肿瘤直径一般资料比较,差异均无统计学意义(P>0.05)。见表1。 本研究经我院伦理委员会批准,所有病人均知情同意。

表1 两组病人一般资料
二、方法
1.手术方法:手术均由同一组医师完成,手术切除范围及D2淋巴结清扫范围参照日本第3版《胃癌处理规约》及我国《腹腔镜胃癌手术操作指南(2016 版)》[8-9],术中常规放置鼻空肠营养管。
2.营养支持策略:所有病人术后早期自愿试行经口饮食,同时启动肠内营养鼻饲并辅以肠外营养支持,具体方案如下:(1)口服营养方案:两组病人术后第1~2天开始予以试饮水,第3天可开始予以清流质饮食(米汤等)或以肠内营养粉能全素(纽迪希亚,1 500 kcal/320 g/瓶)为主,之后根据病人耐受情况逐渐增加经口饮食量,并过渡至半流质饮食。(2)管饲营养方案:两组病人术后均经鼻肠管给予肠内营养液鼻饲,术后第1~2天给予肠内营养500 ml/d,术后第3~7天给予肠内营养500~1 000 ml/d。在鼻饲过程中出现腹胀、腹泻等并发症时,予以减少滴速,必要时暂停肠内营养。(3)肠外营养方案:考虑病人术后早期经口饮食量少且多为低热卡食物,因此,经口饮食部分不纳入总热卡统计范畴。保证对照组病人每日肠内及肠外营养总热卡达到30 kcal/kg以上,术后第1天开始予以卡文1 440 ml,不足部分由葡萄糖注射液和20%中长链脂肪乳力能按1:1比例补充;氨基酸按照热氮比150∶1补充,不足部分由复方氨基酸注射液补充。研究组在上述方案中加入ω-3鱼油脂肪乳100 ml。当能耐受800 ml肠内营养鼻饲时可停用卡文,两组病人术后卡文均支持5天以上。两组病人术后其他处理一致。
3.观察指标:(1) 术后恢复情况:观察术后首次通气时间、术后首次排便时间、术后住院时间,记录住院总费用;(2)术后肠内营养实际鼻饲量及相关并发症:分别记录术后1~6天肠内营养实际鼻饲的量;记录肠内营养相关的恶心、呕吐、腹胀、腹泻发生率;(3)术后并发症:记录各并发症发生率及并发症治疗情况。
三、统计学分析
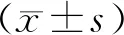
结果
1.两组病人术后恢复情况见表2。两组病人术后首次通气时间、术后首次排便时间、术住院时间及住院总费用比较差异均无统计学意义(均P>0.05)。
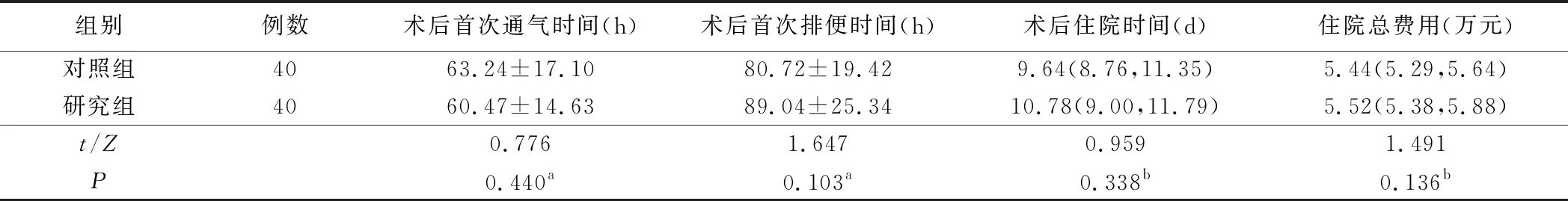
表2 两组病人术后恢复指标比较
2.肠内营养实际鼻饲量及相关并发症见表3和表4。术后4天、术后5天及术后6天,研究组肠内营养鼻饲量均大于对照组,差异有统计学意义(均P<0.05)。对照组恶心发生率为27.5%(11/40),研究者组为17.5%(7/40),两组比较差异有统计学意义(P<0.05);对照组腹胀发生率为70.0%(28/40),研究者组为37.5%(15/40),两组比较差异有统计学意义(P<0.05)。
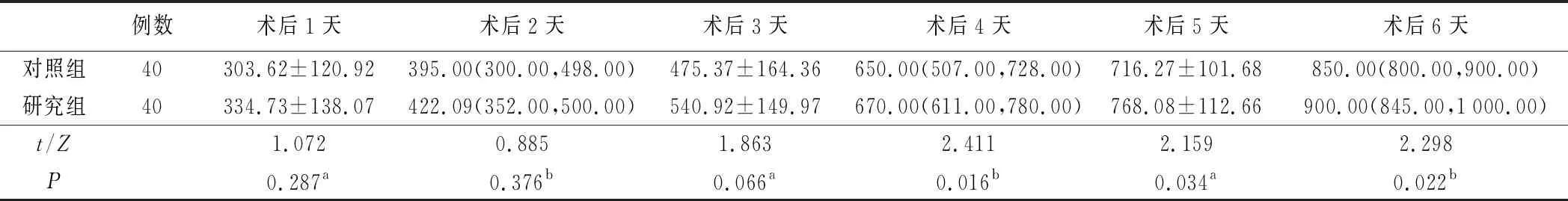
表3 两组病人肠内营养实际鼻饲量比较(ml)
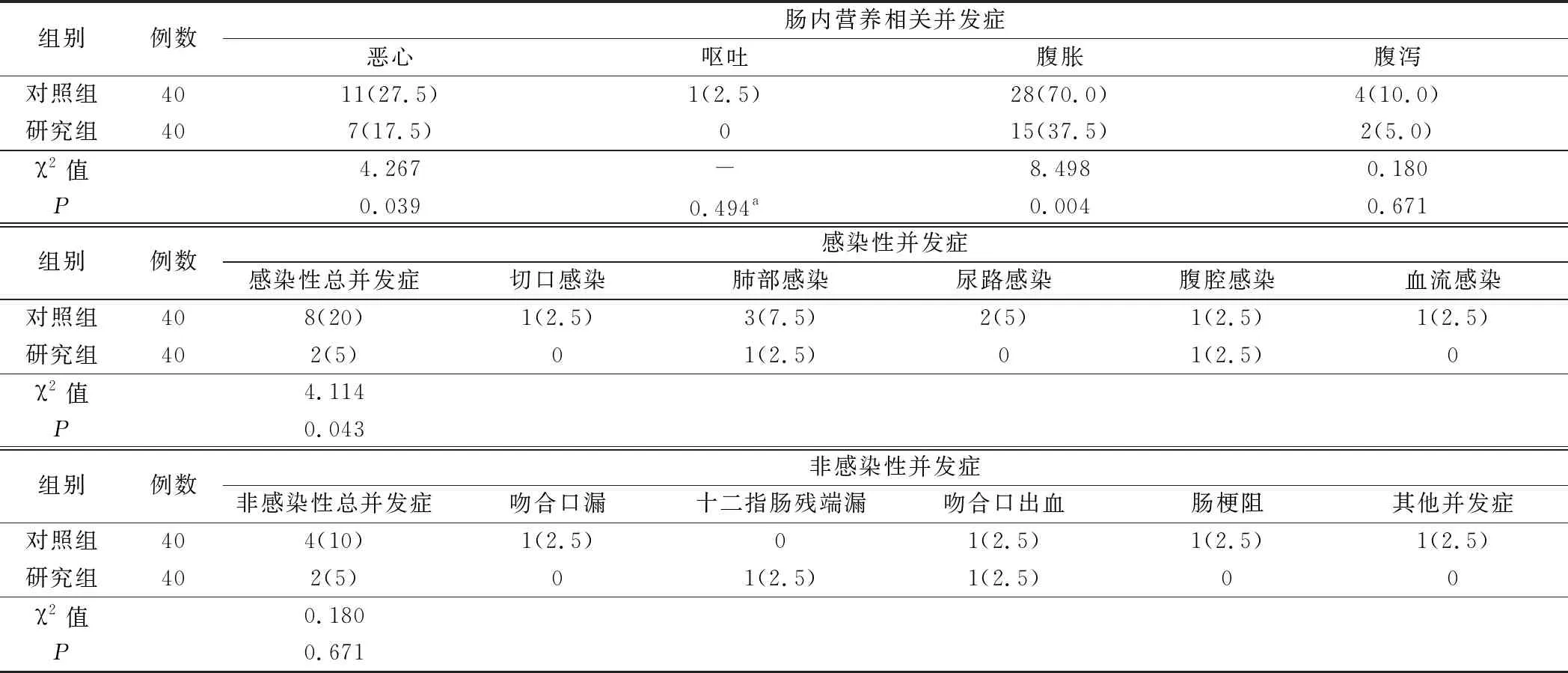
表4 两组病人肠内营养并发症及术后并发症比较(例,%)
3.两组术后并发症情况比较见表4。对照组和研究组术后感染性并发症发生率分别为20%(8/40)和5%(2/40),差异有统计学意义(P<0.05);对照组和研究组术后非感染性并发症发生率分别为10%(4/40)和5%(2/40),差异无统计学意义(P>0.05)。所有感染病人经抗感染及对症治疗后痊愈;吻合口漏、十二指肠残端漏经“黎氏双套管”持续冲洗引流,及联合营养支持后痊愈;上消化道出血均经止血保守治疗后停止;肠梗阻经禁食、胃肠减压及抑酶治疗后缓解;其他并发症中淋巴漏病人经营养支持治疗后痊愈。
讨论
美国肠外肠内营养学会(ASPEN)指南建议,对于接受大型手术的肿瘤病人,营养配方中添加多种免疫营养素有助于改善病人预后[10]。目前,多项临床研究已证实鱼油脂肪乳可以减轻炎症应激、保护免疫功能[5-7]。鱼油脂肪乳富含ω-3 PUFAs能调节体内ω-3和ω-6脂肪酸的比例,进而调节炎性反应、减轻氧化应激、保护免疫功能,其调节炎症反应的可能机制是:ω-3鱼油脂肪乳剂中的EPA和DHA被进一步代谢成前列腺素E3、前列腺素I3、血栓素A2和人白三烯B5,能竞争性抑制花生四烯酸的释放和代谢,从而降低机体炎症反应,保护机体免受免疫介导的损伤[5]。
我们发现在术后4天、5天及6天,研究组肠内营养实际鼻饲量均大于对照组,差异有统计学意义;相比对照组,研究组肠内营养鼻饲后恶心、腹胀发生率低,差异有统计学意义。分析原因可能是:胃肠道功能障碍与全身或局部炎症反应水平有关[11],而ω-3鱼油脂肪乳可以减轻胃癌病人术后的炎症应激水平,同时可增强机体的免疫功能。因此,添加ω-3鱼油脂肪乳的肠外营养可以促进病人术后肠内营养的耐受性,表现为肠内营养鼻饲的量增加、不良反应降低。
一项共纳入8个随机对照研究、合计588例病人的Meta分析结果显示,鱼油脂肪乳可以缩短胃肠道恶性肿瘤术后住院时间[12]。我们研究结果发现,两组病人术后首次通气时间、术后首次排便时间、术后住院时间及住院总费用指标差异均无统计学意义,表明鱼油脂肪乳对病人术后临床恢复指标的影响尚不明显。不排除我们样本量偏少、鱼油脂肪乳使用时间短、入组病例病情严重程度较轻导致术后相关临床恢复指标无差异。我们研究表明,添加鱼油后感染性并发症发生率降低,最近一项Meta分析证实,胃肠道恶性肿瘤病人术后添加鱼油后,感染性并发症发生率少于对照组[7]。关于鱼油降低术后感染性并发症发生率,可能与其减轻术后炎症应激反应、保护免疫能有关。
综上所述,对于存在营养不良风险的腹腔镜胃癌手术病人,术后添加ω-3鱼油脂肪乳的肠外营养可提高肠内营养鼻饲的耐受性,降低术后感染性总并发症发生率。但是,未来仍需开展多中心前瞻性随机对照研究进一步证实。
