血清ICAM⁃1和LDH活性水平在冠心病不同严重程度血管病变中的变化
2021-10-16耿嘉逸李浩宇陈永锋康品方王洪巨
谭 鑫,耿嘉逸,李浩宇,鲜 维,陈永锋,康品方,王洪巨
(蚌埠医学院1.第一附属医院心血管科,2.心脑血管病研究中心,3.公共卫生学院2020级预防医学4班,安徽 蚌埠 233030;4.安徽医科大学临床医学院公共临床医学院公共事业管理,安徽合肥 230032)
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)主要是由于不同程度冠状动脉狭窄硬化进程的急性加剧或动脉梗塞的急性改变,或者因为不同冠状动脉硬化进程导致心肌血管痉挛改变从而引发的心肌供氧和血供应不足、心肌血管耗氧急剧增加引起心肌坏死[1-3]。现阶段,CHD已逐渐成为威胁中国乃至世界各国人民身体健康的主要病种之一,近几十年来,中国CHD患病率和死亡率明显增加[4]。
细胞黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)是人体免疫细胞球蛋白超家族因子中的重要一员,也是一种非常重要的炎症介质以及可靠的炎症标记物,是激起局部炎症和血栓形成的至关重要的成分,在不同冠脉缺血程度的病理生理机制中起关键作用[5]。截至目前多个实验数据证明,ICAM-1基因的多态性、血清水平增高与CHD发病风险密切相关[6-9]。乳酸脱氢酶(lactate dehydrogenase,LDH)是一种广泛存在于人体细胞中的酶,它的主要作用为催化丙酮酸产生乳酸。LDH被认为是健康不良结果的一个指标,多种疾病均会导致LDH变化,如心肌缺血、肌肉损伤、溶血和恶性肿瘤等[10]。近期研究[11]发现,降低ICAM-1可能通过抑制炎性细胞浸润减轻心肌缺血再灌注损伤并降低血清LDH水平,这为相关研究提供了新思路,即:在CHD疾病过程中通过降低ICAM-1是否能抑制炎性细胞浸润从而降低血清LDH水平。
现阶段,临床中ICAM-1与LDH治疗CHD的具体机制尚需进一步明确,血浆ICAM-1与LDH水平的相关性需进一步研究。为此,本研究拟检测不同冠状动脉狭窄进程CHD患者血浆中ICAM-1与LDH活性,深入研究ICAM-1、LDH与不同冠状动脉狭窄进程CHD的关系,为临床上不同冠状动脉狭窄进程的CHD患者诊断治疗提供新方法和依据。
1 资料与方法
1.1 研究对象
选择2019年2月~2020年12月在蚌埠医学院第一附属医院明确诊断为冠心病患者180例。其中男 性89例,女 性91例,年 龄39~85岁,平 均 年 龄(63.48 ±10.66 )岁,其诊断分型依照1999年WHO/WPR标准,所有入院患者定期接受常规心电图和冠状动脉造影等检查明确病情,并在入院时进行血常规及生化检查,记录患者血压、身高、体重等各项指数。CHD患者按照冠状动脉血管造影中记录的冠状动脉左血管主干(LM)、左冠脉前降支(LAD)、左旋支(LCX)、右冠脉下支(RCA)病变情况,依据不同类型冠状血管动脉狭窄最严重的局部病变以及血管情况分为:轻度狭窄组(a-CHD,狭窄程度发展进程≤49%)、中度狭窄组(b-CHD,狭窄程度发展进程50%~74%)和严重狭窄组(c-CHD,狭窄程度发展进程≥75%)[12]。其中,35例患者仅有明显胸痛发作症状但行冠状造影未见明显异常者作为对照组。排除标准:既往有心脏瓣膜性病、严重肝肾及心血管功能不全、恶性肿瘤类疾病、风湿病及免疫系统慢性疾病、心房颤动及感染性疾病等[13]。Gensini评分法[14]见表1。

表1 冠状动脉Gensini评分Tab1 Gensini score of coronary artery
1.2 一般资料收集
收集和比较所有研究对象的临床数据资料,其中包括年龄、收缩压(SBP)、体重指数(BMI)、红细胞计数(RBC)、白细胞计数(WBC)、胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、血小板(PLT)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、血红蛋白(Hb)、中 性 粒 细 胞(NE)以 及 肝(谷 丙 转 氨 酶ALT)、肾(肌酐Cre)功能等指标。
1.3 标本采集
患者入院后抽取外周静脉血5mL于肝素抗凝试管中,3000r/min离心10min后吸取上清,并于−80℃冰箱中保存备用。
1.4 血清LDH和ICAM-1活性检测
将标本融化后使用Human LDH、ICAM-1(上海羽朵)检测血清LDH、ICAM-1水平,采用ELISA法,按照试剂盒说明书进行操作后得到LDH、ICAM-1的OD值,代入标准品与OD值之间的回归曲线方程,计算浓度值。
1.5 统计学处理
数据分析采用SPSS26.0 软件,进行方差分析、Tamhane′s T2分析和Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料和生化指标分析
b-CHD、c-CHD组年龄高于对照组,差异有统计学意义(P<0.05 ,P<0.01 ),c-CHD组HDL低于对照组,但NE高于对照组(P均<0.05 )。而各组间BMI、SBP、WBC、RBC、ALT、Cre、TC、TG、TP、PLT、LDL和Hb差 异 无 统 计 学 意 义(P>0.05 ),见表2。
表2 不同严重程度CHD患者一般资料和生化指标比较(±s)Tab2 Comparison of clinical variables among patients with different severity of CHD(±s)
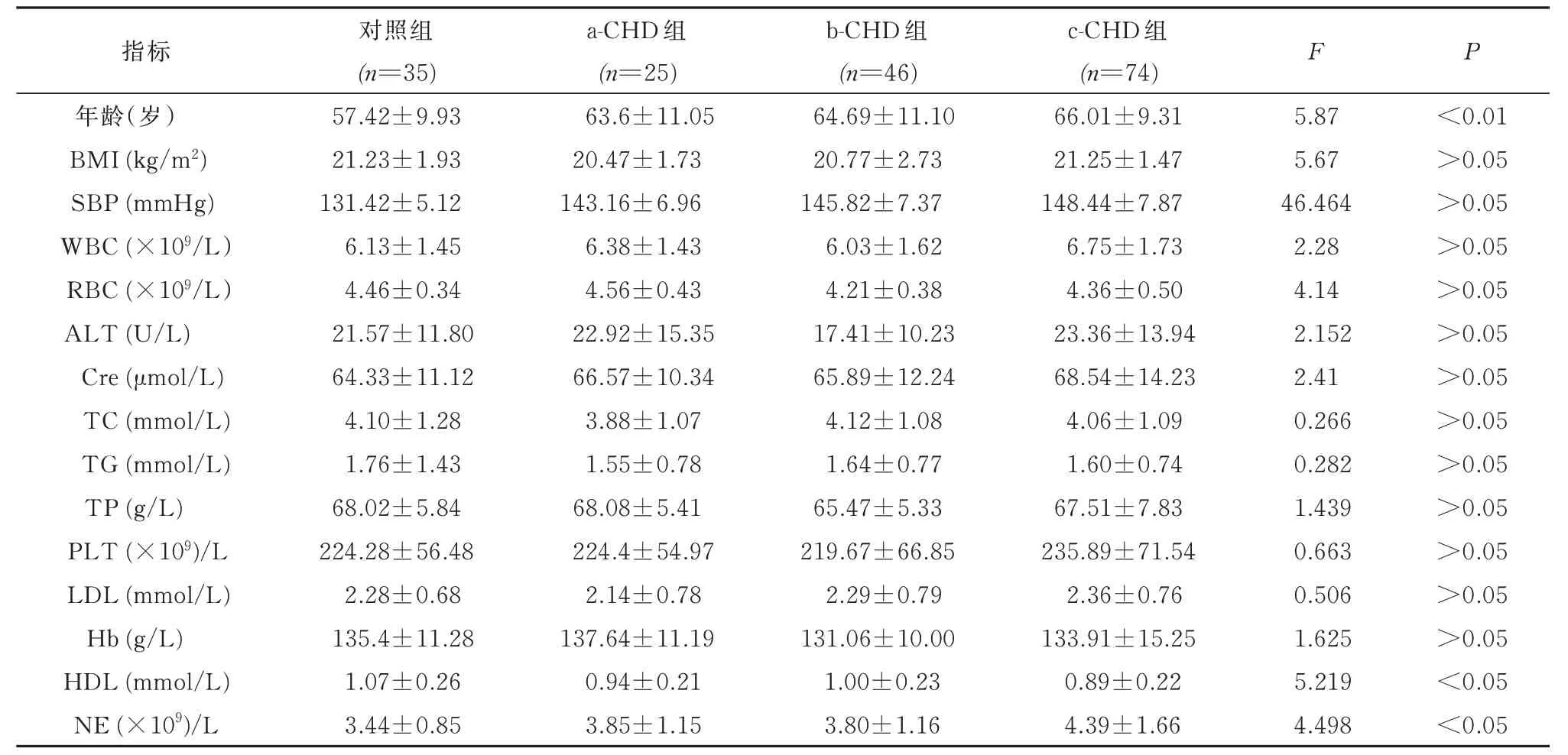
表2 不同严重程度CHD患者一般资料和生化指标比较(±s)Tab2 Comparison of clinical variables among patients with different severity of CHD(±s)
指标F P对照组(n=35)a-CHD组(n=25)b-CHD组(n=46)c-CHD组(n=74)年龄(岁)BMI(kg/m2)SBP(mmHg)WBC(×109/L)RBC(×109/L)ALT(U/L)Cre(μmol/L)TC(mmol/L)TG(mmol/L)TP(g/L)PLT(×109)/L LDL(mmol/L)Hb(g/L)HDL(mmol/L)NE(×109)/L 57.42 ±9.93 21.23 ±1.93 131.42 ±5.12 6.13 ±1.45 4.46 ±0.34 21.57 ±11.80 64.33 ±11.12 4.10 ±1.28 1.76 ±1.43 68.02 ±5.84 224.28 ±56.48 2.28 ±0.68 135.4 ±11.28 1.07 ±0.26 3.44 ±0.8 5 63.6 ±11.05 20.47 ±1.73 143.16 ±6.96 6.38 ±1.43 4.56 ±0.43 22.92 ±15.35 66.57 ±10.34 3.88 ±1.07 1.55 ±0.78 68.08 ±5.41 224.4 ±54.97 2.14 ±0.78 137.64 ±11.19 0.94 ±0.21 3.85 ±1.1 5 64.69 ±11.10 20.77 ±2.73 145.82 ±7.37 6.03 ±1.62 4.21 ±0.38 17.41 ±10.23 65.89 ±12.24 4.12 ±1.08 1.64 ±0.77 65.47 ±5.33 219.67 ±66.85 2.29 ±0.79 131.06 ±10.00 1.00 ±0.23 3.80 ±1.1 6 66.01 ±9.31 21.25 ±1.47 148.44 ±7.87 6.75 ±1.73 4.36 ±0.50 23.36 ±13.94 68.54 ±14.23 4.06 ±1.09 1.60 ±0.74 67.51 ±7.83 235.89 ±71.54 2.36 ±0.76 133.91 ±15.25 0.89 ±0.22 4.39 ±1.6 6 5.87 5.67 46.464 2.28 4.14 2.152 2.41 0.266 0.282 1.439 0.663 0.506 1.625 5.219 4.49 8<0.01>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05<0.05<0.0 5
2.2 血清LDH、ICAM-1活性水平和Gensini评分在CHD中的变化
b-CHD组和c-CHD组血清LDH水平均较对照组、a-CHD组显著增加,差异有统计学意义(P均<0.01),见表3。血清LDH水平随冠状动脉狭窄进程加重而逐步升高,差异有统计学意义(P<0.01);其中c-CHD组血清ICAM-1水平较对照组、a-CHD、b-CHD组显著升高,血清ICAM-1水平随冠状动脉狭窄进程加剧而逐步升高,差异有统计学意义(P均<0.01),见表3。a-CHD组、b-CHD组和c-CHD组Gensini评分随着冠状动脉狭窄进程的加剧后明显升高,且各组之间评分比较差异均有统计学意义(P<0.05)。
表3 不同严重程度CHD患者血清LDH、ICAM⁃1活性水平和Gensini评分比较(±s)Tab3 Comparison of LDH,ICAM⁃1activity and Gensini scores among patients with different severity of CHD(±s)

表3 不同严重程度CHD患者血清LDH、ICAM⁃1活性水平和Gensini评分比较(±s)Tab3 Comparison of LDH,ICAM⁃1activity and Gensini scores among patients with different severity of CHD(±s)
注:-:无评分。与对照组比较,*P<0.05 ,**P<0.01 ;与a⁃CHD组比较,#P<0.05 ,##P<0.01 ;与b⁃CHD组比较,△P<0.05 ,△△P<0.01 。
指标Gensini评分LDH(U/L)ICAM⁃1(ng/mL)对照组(n=35)F P<0.01<0.01<0.01-464.13 ±40.08 414.70 ±51.5 4 a-CHD组(n=25)10.32 ±9.32 **481.41 ±32.42 485.52 ±55.66 **b-CHD组(n=46)22.40 ±17.61 **##561.10 ±51.77 **##486.81 ±55.71 **c-CHD组(n=74)58.18 ±34.41 **##△△592.79 ±62.92 **##△532.45 ±40.91 **##△△58.615 61.210 45.72 0
2.3 血清LDH及ICAM-1活性水平与病变支数的关系
各组患者冠状动脉病变支数不同,根据冠状动脉造影结果将CHD病人分为单支、双支及多支病变(三支及以上),结果显示,与对照组相比,单支组、双支组和多支组血清LDH和ICAM-1显著增加(P<0.05),其中以LDH增加最明显,见表4。
表4 血清LDH及ICAM⁃1活性水平与病变支数的关系(±s)Tab4 The relationship between serum LDH and ICAM-1 activity and the number of affected vessels(±s)
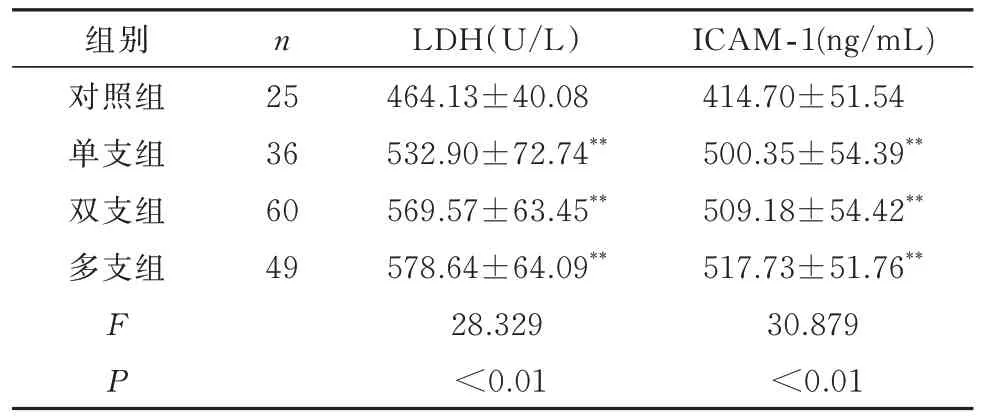
表4 血清LDH及ICAM⁃1活性水平与病变支数的关系(±s)Tab4 The relationship between serum LDH and ICAM-1 activity and the number of affected vessels(±s)
注:与对照组比较,*P<0.05 ,**P<0.01 。
组别对照组单支组双支组多支组ICAM⁃1(ng/mL)414.70 ±51.54 500.35 ±54.39 **509.18 ±54.42 **517.73 ±51.76 **30.879<0.01 n 25 36 60 49 FP LDH(U/L)464.13 ±40.08 532.90 ±72.74 **569.57 ±63.45 **578.64 ±64.09 **28.329<0.0 1
2.4 Gensini评分、LDH、ICAM-1与血液指标的相关性
血清LDH、ICAM-1水平与Gensini评分正相关(LDH:r=0.409 ,P<0.01 ;ICAM-1:r=0.463 ,P<0.01),HDL、TP水 平 与LDH水 平 呈 负 相 关(HDL:r=−0.184 ,P<0.05 ;TP:r=−0.218 ,P<0.01),HDL、NE与血清ICAM-1水平分别呈负相关、正相关(HDL:r=−0.175 ,P<0.05 ;NE:r=0.208 ,P<0.01 ),血清ICAM-1与LDH水平正相关(r=0.441 ,P<0.01 ),见表5。
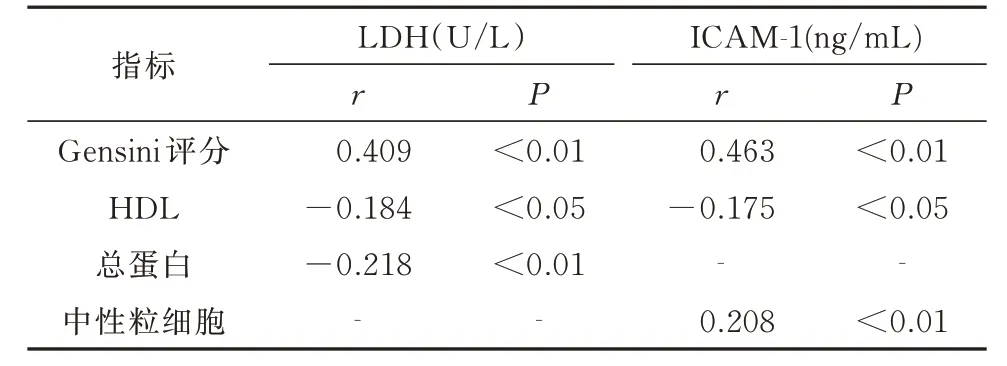
表5 血清LDH及ICAM⁃1活性水平与Gensini评分、HDL、总蛋白、中性粒细胞的相关性分析Tab5 Correlation between serum LDH/ICAM⁃1activity and Gensini score,HDL,total protein or neutrophils
3 讨论
CHD是由多种病因引起的疾病,多种基因突变及其他危险性因素均可导致此类疾病的早期发生和进展[9,15,16]。截至目前,被广泛地研究和报道的和高血压、心功能不全、冠心病相关的传统风险因素累计有200多种,主要包括高脂血症、肥胖、遗传、高血压等[17-19]。CHD加重后会造成心律失常、心力衰竭等一系列心血管疾病,进一步可能会造成患者死亡,给社会带来卫生安全隐患,也给患者家庭增加经济负担。所以,进一步深入地研究CHD的发生机理、早期诊断与治疗及早期预防意义重大。
ICAM-1主要表达于血管内皮细胞、淋巴细胞,多项研究结果表明,ICAM-1、血管细胞黏附分子和e-选择素等各种可溶性黏附分子的测定都能够准确地反映血管内皮细胞的炎症发生过程,这些黏附分子共同在血管中形成一个完整的重叠系统,将白细胞输送到血管壁,并在动脉粥样硬化斑块的形成过程中发挥了积极的作用[20-22]。收集国内外ICAM-1与CHD的相关文献,荟萃分析表明ICAM-1基因rs5498多态 性可降 低CHD的风 险[8]。Metzler等[23]发现,构建ICAM-1基因敲除大鼠后进行的心脏心肌缺血再灌注(I/R)模型,能有效减轻I/R心脏周围区域心肌梗塞并有效降低大鼠血清中心肌损伤标志物水平。因此ICAM-1在大鼠I/R后心脏心肌损伤中发挥着重要的抑制作用。基础实验证实miR-141作为ICAM-1的新型抑制剂,通过抑制ICAM-1分泌以及炎症细胞因子浸润,进一步减轻了I/R的损伤[11]。李守贵[24]通过临床实验发现,急性冠状动脉综合征(ACS)患者可溶性黏附分子(ICAM-1、血管内皮细胞黏附分子等)直接促进了ACS的发生、发展。苏蕊雅[25]通过Meta分析和生物信息学功能分析发现ICAM-1可能通过调节白细胞的相关生物过程导致炎症反应,从而调节CHD的发生发展,其中Yin等[26]也得到相同结论。本研究结果显示,ICAM-1与CHD的病变程度、病变支数均具有相关性。与对照组相比,随着冠状动脉血管病变程度加重、病变支数增加,血ICAM-1水平逐渐增加,该结果提示冠状动脉粥样硬化斑块形成中促进了血管内皮细胞炎症因子的释放,导致ICAM-1升高。
LDH的同 工酶主要 有5种,LDH-1和LDH-2是人体内的心肌及红细胞的主要同工酶,LDH-4和LDH-5是骨骼肌及肝脏的主要同工酶。通常,LDH-2是血清中的主要形式,其次是LDH-1、-3、-4和-5。大多数血清LDH来源于红细胞和血小板的分解,以及其他器官中反映其组织来源的附加同工酶。随着组织细胞的破坏或损伤,血清LDH水平显著升高[27],Kopel等[10]研究发现,在正常范围内LDH的升高可能与冠状动脉疾病呈负相关。但本研究结果提示,中、重度CHD患者血清LDH水平明显高于对照组,郭显学[28]也报道了类似结果。除此之外,本研究结果还显示,LDH水平随着冠状动脉病变程度加重而升高。在CHD冠状动脉血管病变发生发展过程中炎症起着重要的作用[5],多项实验发现在心肌缺血再灌注模型中给予相应药物处理后导致ICAM-1水平降低能明显减轻心肌缺血再灌注损伤,与此同时还可减低血清LDH浓度[11,19,29]。本研究发现,血清LDH、ICAM-1水平随着CHD患者冠状动脉血管阻塞进程加剧而明显升高,同时,Pearson相关性检验表明,ICAM-1与中性粒细胞、LDH与ICAM-1水平之间呈正相关,通过炎性细胞浸润相互联系可能是其内在机制[11]。
综上所述,随着冠状动脉狭窄程度加重,血清LDH与ICAM-1水平也升高,且两者正相关,因此血清LDH与ICAM-1水平可能对判断冠状动脉病变程度及研究CHD发病机制有一定价值。不过,本研究虽然证实了LDH、ICAM-1与CHD中冠状动脉病变程度之间的关系,但具体的病理生理机制及作用途径仍需进一步证实。且本研究样本量少、数据资料收集过程不可避免存在误差,因此本文结果还需大样本的基础研究进一步验证。
作者贡献度说明:
谭鑫:操作实验、整理数据、撰写论文。通讯作者王洪巨、康品方:实验设计、论文修改。其他作者耿嘉逸、李浩宇、鲜维、陈永锋:参与实验和数据收集。
