分子梭协助离子跨膜运输的机理研究
2021-10-15妙孟姚郭一畅邵学广蔡文生
妙孟姚,郭一畅,邵学广,2,蔡文生
(1.南开大学化学学院分析科学研究中心,天津市生物传感与分子识别重点实验室,2.药物化学生物学国家重点实验室,天津300071)
离子跨膜转运是细胞维持机体正常生命活动的必要条件,其能够调节膜电位并控制细胞对外界刺激产生的生物电反应[1,2].通常,离子需要膜转运蛋白协助进而顺电化学梯度跨膜转运.细胞膜中由特殊亲水性通道蛋白构成的离子通道,能够选择性控制离子快速通过细胞膜[3~5].近年来,以这些通道蛋白为靶标,设计出了一系列针对癫痫[6]、囊性纤维化[7]和癌症[8]等疾病的治疗剂.另一方面,也合成了多种类型的人工离子通道,如冠醚类[9]、柱芳烃类[10]、环糊精类[11]、葫芦脲类[12]和多肽类[13]等,这类人工离子通道嵌插在细胞膜内形成静态的亲水性通道,具有膜内外传输离子的功能.除此以外,合成非通道型人工离子转运体以模仿离子通道蛋白的功能是另一个研究热点,其中轮烷[14]作为离子转运体不同于这些静态离子通道,其具有分子机器[15~18]的可控性和机械运动性,独特的优势使其在离子跨膜运输领域的应用成为一个有价值的课题.
基于轮烷设计的人工离子传输体系受到国内外学者的广泛关注.2018年,Chen等[14]首次合成了一个能实现离子跨磷脂双分子层传输的分子梭([2]轮烷),该轮烷由大小两个冠醚环连接而成的双环系统和线性轴组成,其中大环套在一含有3个带正电荷的结合位点的线性轴上,小环用于捕获膜表面的K+.插入脂质双层膜后大环可在两侧结合位点之间来回运动,使得该分子梭就像缆车一样,可以实现K+在生物膜两侧的不断传送.Credit[19]认为该分子梭的成功合成预示着离子跨膜从被动运输到主动运输的重大突破,为医学治疗和能量转换提供了新的思路.Zeng等[20,21]基于该纳米器件的摆动原理,设计了一系列具备更高选择性和活性的跨膜离子载体.我们[22]采用大规模分子动力学(MD)模拟,首次在原子水平上探索了[2]轮烷在离子跨膜转运过程中历经捕获-转运-释放的完整机制,发现其链结构中间带正电的结合位点在离子跨膜转运过程中起着重要作用,但该关键结合位点对轮烷穿梭性质及协助离子跨膜转运行为的影响还缺乏一些细节的探究.
本文利用MD模拟结合高效的自由能计算方法研究了3种溶剂环境,即弱极性溶剂氯仿(CHCl3)、极性溶剂乙腈(CH3CN)、强极性溶剂水(H2O)及氯仿-乙腈(体积比1∶1)混合溶剂中轮烷(不携带K+)的穿梭路径和能垒.对比研究了轴上中间结合位点去质子化和质子化两种状态下的轮烷的穿梭路径和能垒.并进一步设计了一种由水-氯仿-水构成的“夹心”溶剂来模拟细胞膜环境,探索了中间位点不同质子化状态下小环载体携带K+在大环的带动下在细胞膜两侧穿梭的能垒变化和作用机制.
1 理论和方法
1.1 模型建立
[2]轮烷的两种结构如Scheme 1所示.轮烷的环状部分包括一个苯并-24-冠-8的大环和一个苯并-18-冠-6的小环,大环可以套在两亲性的轴上进行穿梭,小环被公认为是具有高选择性的K+载体.其中,轮烷1两亲性轴上的结合位点1和位点3各带有一个正电荷,位点2由一个三氮唑环构成,呈中性状态;该位点被质子化得到轮烷2,因此轮烷2共有3个带正电的结合位点.同时,两亲性基团的距离与磷脂双分子层的厚度一致,将该轮烷插入到膜内可以形成稳定的跨膜结构.Chen等[14]在氯仿和乙腈(体积比1∶1)的混合溶剂中测定了所研究轮烷的穿梭速率,尽管与真实细胞膜环境不完全相同,但他们认为测得的结果能够为大环滑动以协助载体小环跨膜转运K+提供重要的参考.为了与实验条件一致,同样选取氯仿-乙腈(体积比1∶1)混合溶剂来探索轮烷的基本性质.首先,为了探究不同溶剂对轮烷(不携带K+)运动过程的影响,将轮烷2插入到带有周期性边界条件的4种立方溶剂盒子中(表1中体系1~4).为了探究轴上中间结合位点对轮烷(不携带K+)穿梭行为的影响,将轮烷1插入到相应周期性溶剂盒子(表1中体系5).考虑到轮烷嵌入脂质双层中穿梭或转运离子需要克服显著的自由能垒,模拟时间长,所以希望构建一种细胞膜简化模型来高效模拟膜的性质.Smithrud等[23]选择水和氯仿溶液分别代表细胞外的极性环境和细胞膜的脂质部分,研究了轮烷类化合物参与跨膜转运药物分子的机制.Wang等[24]认为氯仿的疏水环境更接近磷脂双分子层,并以此作为溶剂研究了轮烷异构化对其穿梭速率的影响.基于此,为了研究中间位点不同质子化状态下轮烷携带K+跨膜的运动过程和机理,利用水-氯仿-水构成的“夹心”溶剂来仿真模拟细胞膜,其中“夹心”氯仿的厚度与1-棕榈酰-2-油酰-卵磷脂(POPC)双层膜保持一致(约3.8 nm),保证位点1和位点3之间(约3.2 nm)处于疏水环境,两亲性基团处于亲水环境.此时,分别构建体系6和7作为溶剂盒子(表1),K+始终约束在小环内.已有实验[14]和理论模拟[22]均表明轮烷在细胞膜内可形成稳定的垂直于细胞膜表面的跨膜结构,因此,将轮烷垂直插入模拟细胞膜,质心与膜的质心重合,并将轴上的重原子约束在其伸展构象以避免横向扩散和链的折叠.对上述所有体系,将经过5000步的能量最小化以及60 ns的MD平衡模拟之后的结构作为自由能计算的初始结构.此外,为了避免抗衡离子Cl−与轮烷的结合位点发生相互作用,它们始终被约束在溶剂盒子的边缘位置.
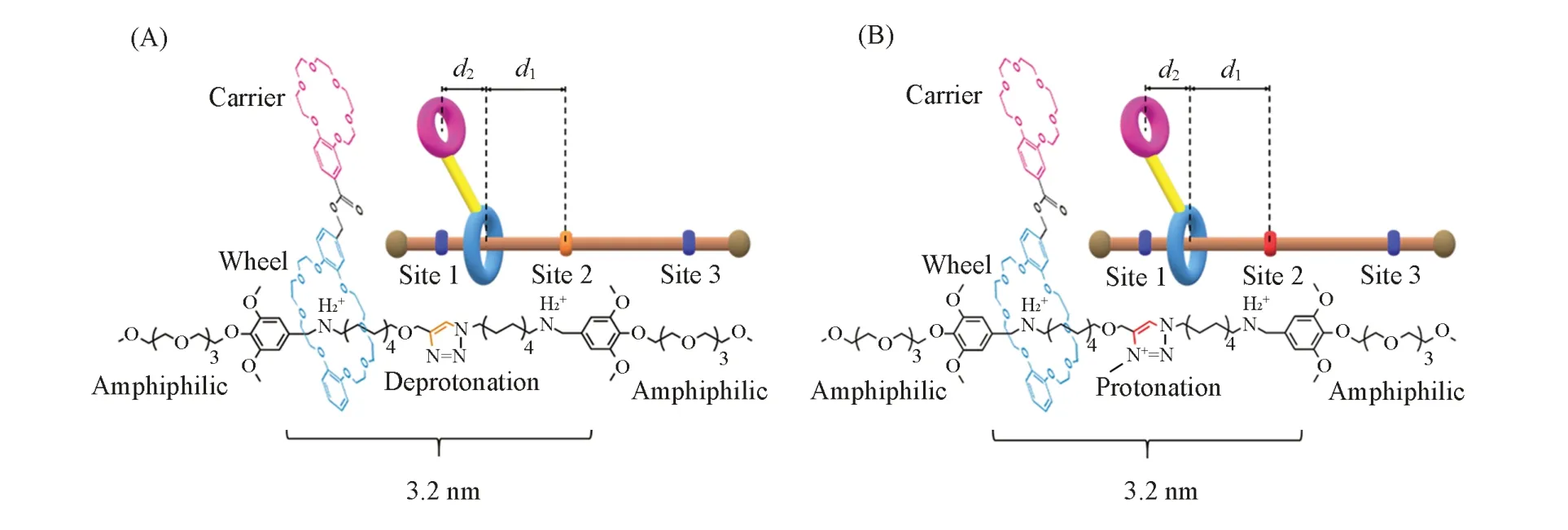
Scheme 1 Artificial molecular shuttle of rotaxanes 1(A)and 2(B)
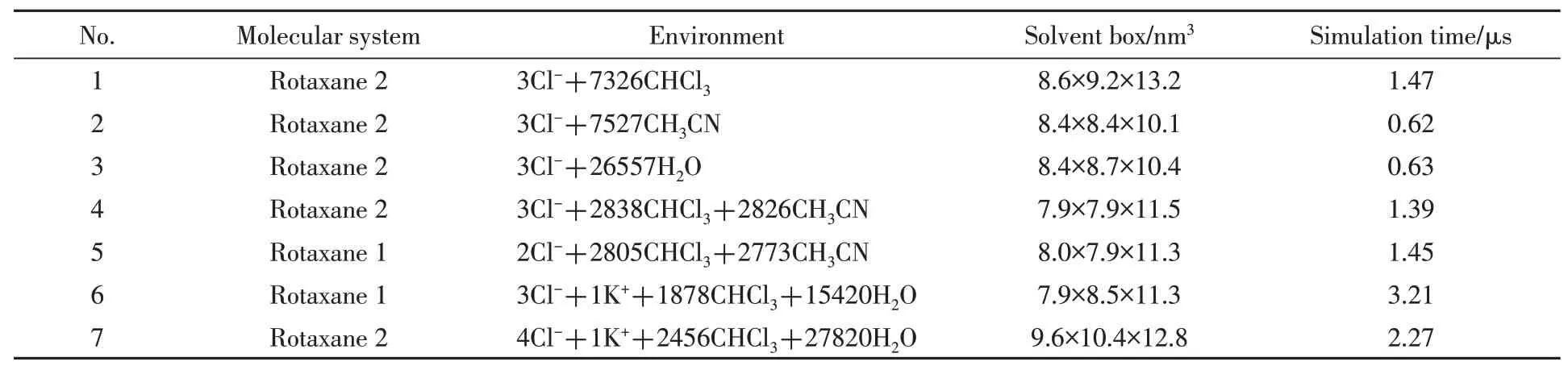
Table 1 Basic information of molecular assemblies investigated in this work
1.2 分子动力学模拟
所有MD模拟均采用NAMD2.14软件[25],使用AMBER通用小分子力场(GAFF2)[26]和Lipid14力场[27]参数分别描述轮烷和抗衡离子;使用AMBER软件提供的参数描述CHCl3,使用Cieplak等[28]提供的参数描述CH3CN;使用TIP3P模型[29]中的参数描述水分子.通过恒温恒压的Langevin动力学方法将温度保持在300 K,采用Langevin活塞方法将压力控制在1.01×105Pa[30].采用SETTLE算法保持水分子的刚性,采用SKAKE/RATTLE算法将所有涉及氢原子的共价键限制在其平衡值[31,32].长程静电作用采用粒子网格埃瓦尔德(PME)方法[33]计算,范德华截断半径为0.9 nm.采用r-RESPA多时间步长算法[34],对运动方程积分的时间步长为2和4 fs.采用VMD软件[35]进行轨迹分析.
1.3 自由能计算
自适应偏置力(ABF)[36,37]方法是一种基于热力学积分的重要采样方法,通过在由集合变量构成的反应坐标方向上施加偏置力来增强在该方向上的采样,具有严谨的收敛性,但在使用中存在很多局限,如ABF方法需要实现雅可比行列式的导数、集合变量间的相互独立并与体系中存在的约束正交,大大限制了其在复杂体系中的应用.为此,我们[38]实现了扩展自适应偏置力(eABF)计算方法,基本解决了经典ABF方法的缺点.本文所有自由能计算均采用我们[39,40]在此基础上最新发展的WTM-eABF方法,该方法结合了Well-tempered metadynamics[41,42]和eABF[38,43]“填谷”和“削峰”的优点,极大提高了采样效率,并已得到广泛应用[39,44].计算所用反应坐标的定义如Scheme 1所示,d1为大环质心与轴质心之间的距离在z轴的投影,用来描述大环沿轴的穿梭运动,取值范围为−1.8 nm≤d1≤1.8 nm;d2为小环质心和大环质心的距离在z轴的投影,用来描述载体相对车轮的摆动情况,取值范围为−1.5 nm≤d2≤1.5 nm.为了提高计算效率,反应路径沿d1被均分为6个窗口(−1.8 nm≤d1≤−1.2 nm,−1.2 nm≤d1≤−0.6 nm,−0.6 nm≤d1≤0 nm,0 nm≤d1≤0.6 nm,0.6 nm≤d1≤1.2 nm和1.2 nm≤d1≤1.8 nm),各窗口模拟时间基本相同.6个体系所用的模拟时间总计10.41 μs.首先计算沿(d1,d2)变化的二维自由能面,由于轮烷的结构基本上是对称的,所有显示的二维自由能图均为对称化后的结果,然后采用多维最低能量算法(MULE)[39]在自由能面上确定轮烷在位点1和位点3之间穿梭的最低自由能路径(LEFP).定义S为描述路径的有序参数,S=0和S=1分别代表LEFP中的初始状态(位点1)和最终状态(位点3),即可得到一维沿该路径S的自由能变化图.
2 结果与讨论
2.1 溶剂对轮烷穿梭运动的影响
图1 (A)~(C)和(D)分别给出了轮烷2(不携带K+)在氯仿、乙腈和水溶剂中穿梭运动的二维自由能图及在最低自由能路径上的一维投影.自由能图上的最低自由能路径(黑线)代表了轮烷穿梭过程的最合理路径.我们[45,46]的研究表明,这种静电控制的分子梭的穿梭速度受环境极性的影响,极性升高,穿梭能垒降低,穿梭速度加快,特别是在水中,即水对轮烷穿梭起润滑作用[46].对比发现,在弱极性溶剂氯仿(极性4.4)、极性溶剂乙腈(极性6.2)和强极性溶剂水(极性10.2)中,轮烷的穿梭路径和自由能变化趋势相似,大环处于中间结合位点2时,小环发生摆动(a2到a3,b2到b3,k2到k3),说明在不同溶剂中轮烷的运动模式一致.在弱极性溶剂中,轮烷穿梭过程所需克服的能垒(ΔG)约为123.5 kJ/mol,说明轮烷在氯仿溶剂中不会发生穿梭运动.而在极性和强极性溶剂中,穿梭所需克服的能垒分别降至65.3和55.1 kJ/mol,此时大环在轴上可快速穿梭,说明溶剂极性是影响轮烷穿梭过程中能垒高度和穿梭速率的一个重要因素.
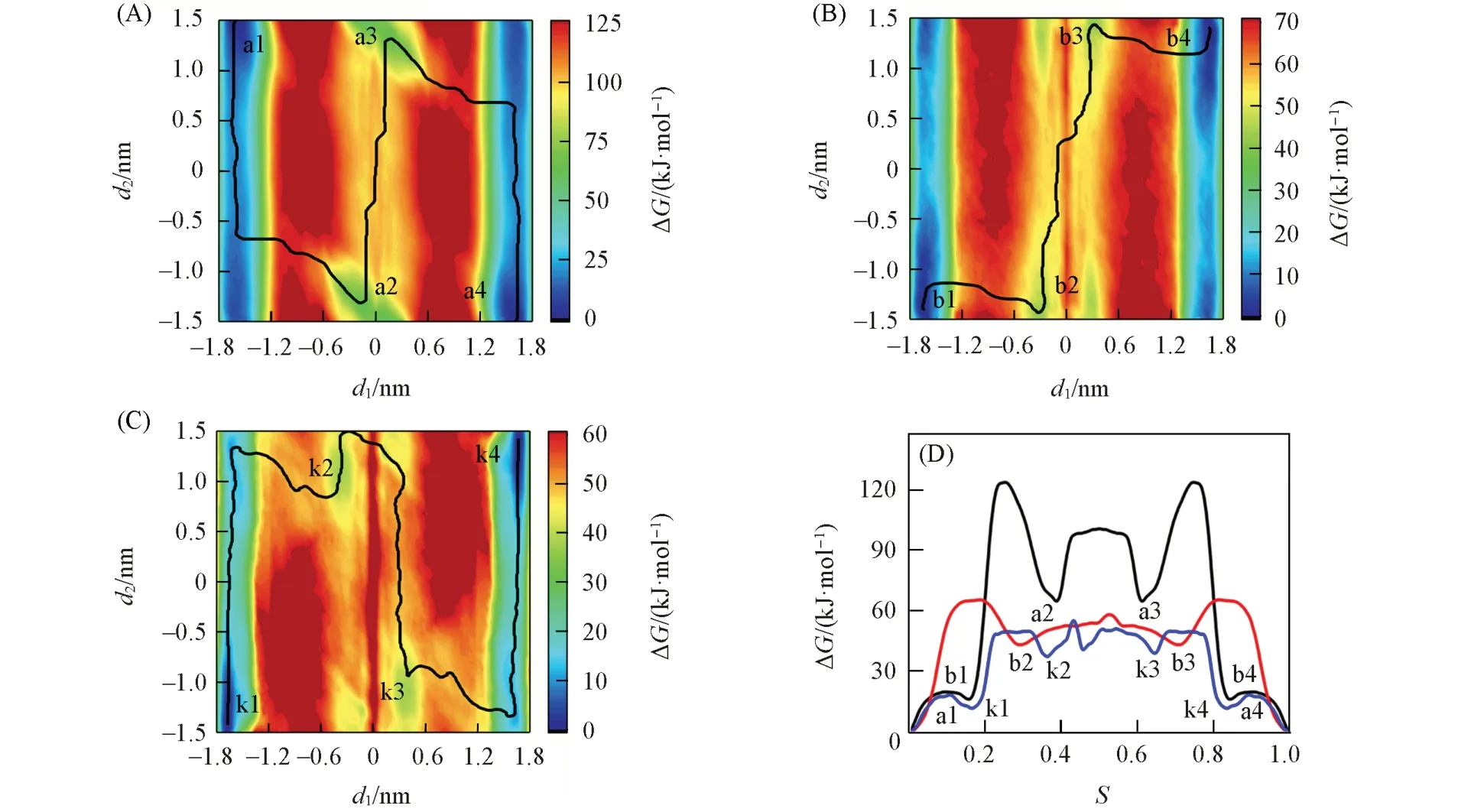
Fig.1 Free⁃energy profiles and the lowest free energy pathway(LFEP,black line)underlying the shuttling movement of rotaxane 2 in CHCl3(A),CH3CN(B),H2O(C)and the corresponding free⁃energy change along the LFEPs(D)
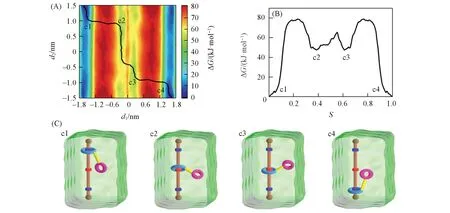
Fig.2 Free⁃energy profile and the lowest free energy pathway(LFEP,black line)underlying the shuttling movement of rotaxane 2 in CHCl3 and CH3CN(volume ratio:1∶1)(A),the corresponding free⁃energy change along the LFEP(B)and representative spatial arrangements along the LFEP(C)
图2 (A)~(C)分别给出了轮烷2(不携带K+)在氯仿-乙腈混合溶剂中穿梭过程的二维自由能图、在最低自由能路径上的一维投影及代表性结构示意图(其三维结构见本文支持信息图S1).大环带动小环在轴上滑动需要克服的自由能垒估计为79.1 kJ/mol,与实验值(79.2 kJ/mol)[14]一致.对称的两个低能区域(蓝色区域)代表了轮烷大环与轴上位点1和位点3的稳定结合区域;两个极小值点c1和c4代表了分子梭的两种最稳定结构,由于冠醚易于与带正电荷的基团相互作用,当大环处于位点1或位点3时,小环倾向于与位点2接触,如图2(C)所示;两个能量相当的次稳定点c2和c3,代表了大环穿梭到位点2时,小环相对大环的两种摆动,且对轮烷穿梭能垒无影响.此外,与图1对比发现,无论是在混合溶剂或单一的不同极性溶剂中,轮烷的运动模式均没有发生改变,位点2提供了大环穿梭过程中的次稳定区域,此时小环的摆动不影响大环穿梭的能垒.相比于轮烷在氯仿或乙腈中的穿梭能垒,发现其在混合溶剂中穿梭所需克服的能垒介于两者之间,说明随着溶剂极性的增加,轮烷穿梭能垒降低.
2.2 中间结合位点的去质子化对轮烷穿梭运动的影响
图3 (A)~(C)分别给出了轮烷1(不携带K+)在氯仿-乙腈混合溶剂中穿梭运动的二维自由能图、在最低自由能路径上的一维投影及代表性结构示意图(其三维结构见本文支持信息图S2).大环在轴上滑动所需克服的能垒约为73.3 kJ/mol.两个显著的低能区域(蓝色区域)代表轮烷大环处于位点1和位点3时,小环相对大环的摆动所需克服能垒较低;两个极小值点e1和e4代表了轮烷穿梭运动中的最稳定结构,此时小环与大环质心的连线倾向于垂直轴存在;两个次稳定点e2和e3代表了大环处于位点2时,小环倾向于与相邻的带一个正电荷的结合位点接触,且摆动对轮烷穿梭能垒影响较小.与图2对比发现,轴上位点2去质子化和质子化的轮烷在混合溶剂中穿梭所需克服的能垒相差不大,两种轮烷穿梭速率基本一致;在穿梭-摆动-穿梭运动中,小环始终倾向于靠近相邻的结合位点,这主要归因于载体冠醚倾向于与相邻的带正电荷的位点相互作用的固有特性,因此位点2的不同质子化状态是造成穿梭和摆动协同运动过程中稳态和亚稳态构象差异较大的主要原因.
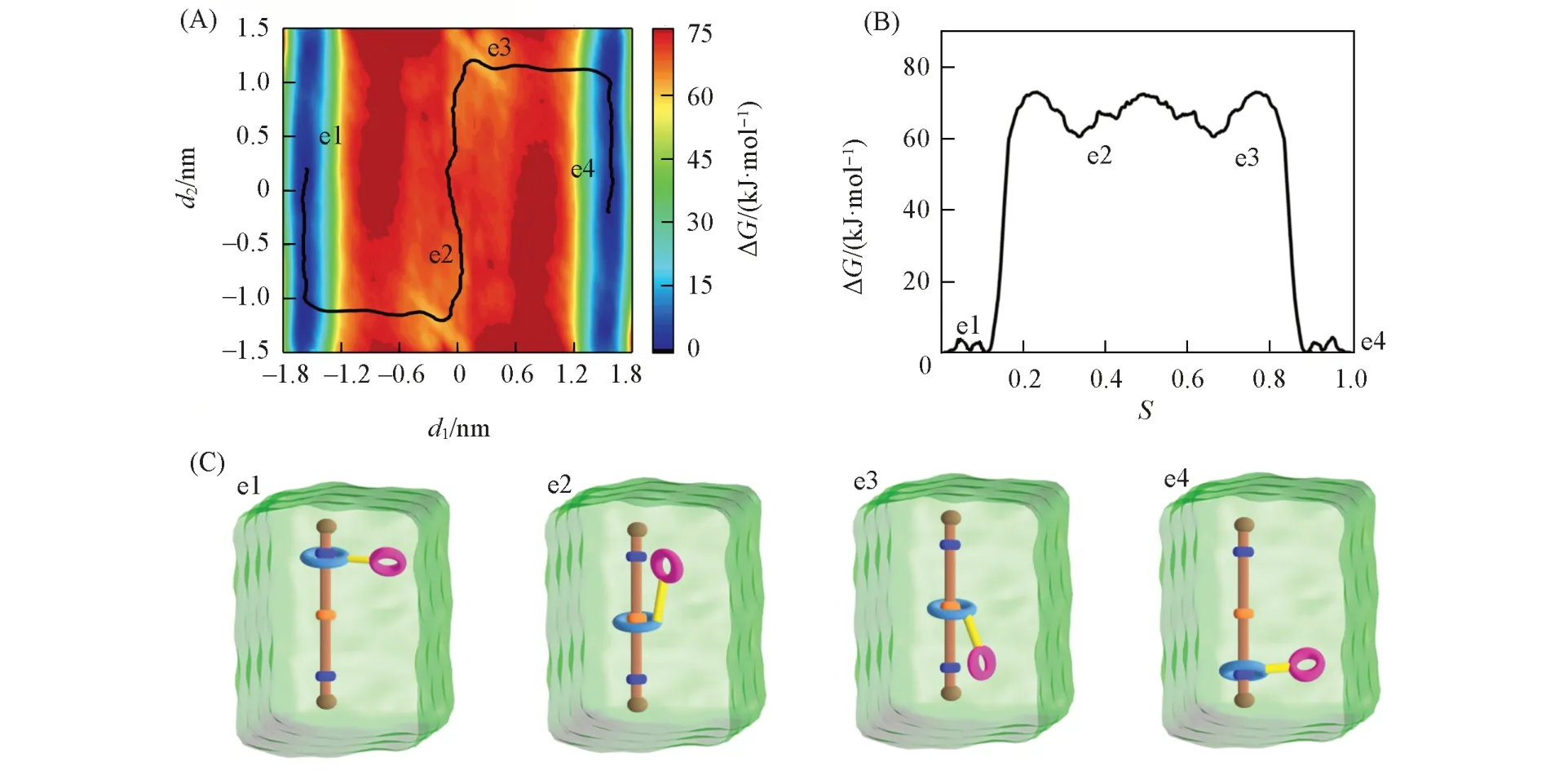
Fig.3 Free⁃energy profile and the lowest free energy pathway(LFEP,black line)underlying the shuttling movement of rotaxane 1 in CHCl3 and CH3CN(volume ratio:1∶1)(A),the corresponding free⁃ener⁃gy change along the LFEP(B)and representative spatial arrangements along the LFEP(C)
2.3 中间位点的质子化状态对轮烷携带离子跨膜运动的影响
轮烷协助K+跨膜运输的关键步骤是其小环携带离子在大环的带动下在膜中的穿梭运动.为了探究位点2质子化状态对轮烷携带离子跨膜运动的影响,分别对轮烷1和轮烷2的携带离子跨膜过程进行了计算.图4(A)~(C)分别给出了轮烷1携带K+在细胞膜简化模型中穿梭运动的二维自由能图、在最低自由能路径上的一维投影及代表性结构示意图(其三维结构见本文支持信息图S3).轮烷携带离子穿梭所需克服的能垒估计为134.1 kJ/mol.两个对称的低能区域(蓝色区域)代表大环稳定于位点1和位点3时,小环携带离子处于膜表面处的能量更有利;两个极小值点f1和f4代表了纳米机器转运离子过程中的两种最稳定结构,如图4(C)所示;两个局部极值点f2和f3代表大环沿轴从位点2穿梭到位点3时,小环未发生摆动.总而言之,轮烷大环沿轴历经位点1→位点2→位点3的长途运动过程中,小环始终未发生上下摆动,而当大环停留在位点3时,小环向下摆动停留在膜表面处.无协助K+在POPC磷脂双层膜中渗透所需克服的能垒约为111 kJ/mol[47],从图4(B)可见,轮烷协助的离子跨膜传输所需克服的能垒远高于此值,说明位点2去质子化的轮烷难以跨膜传输K+.
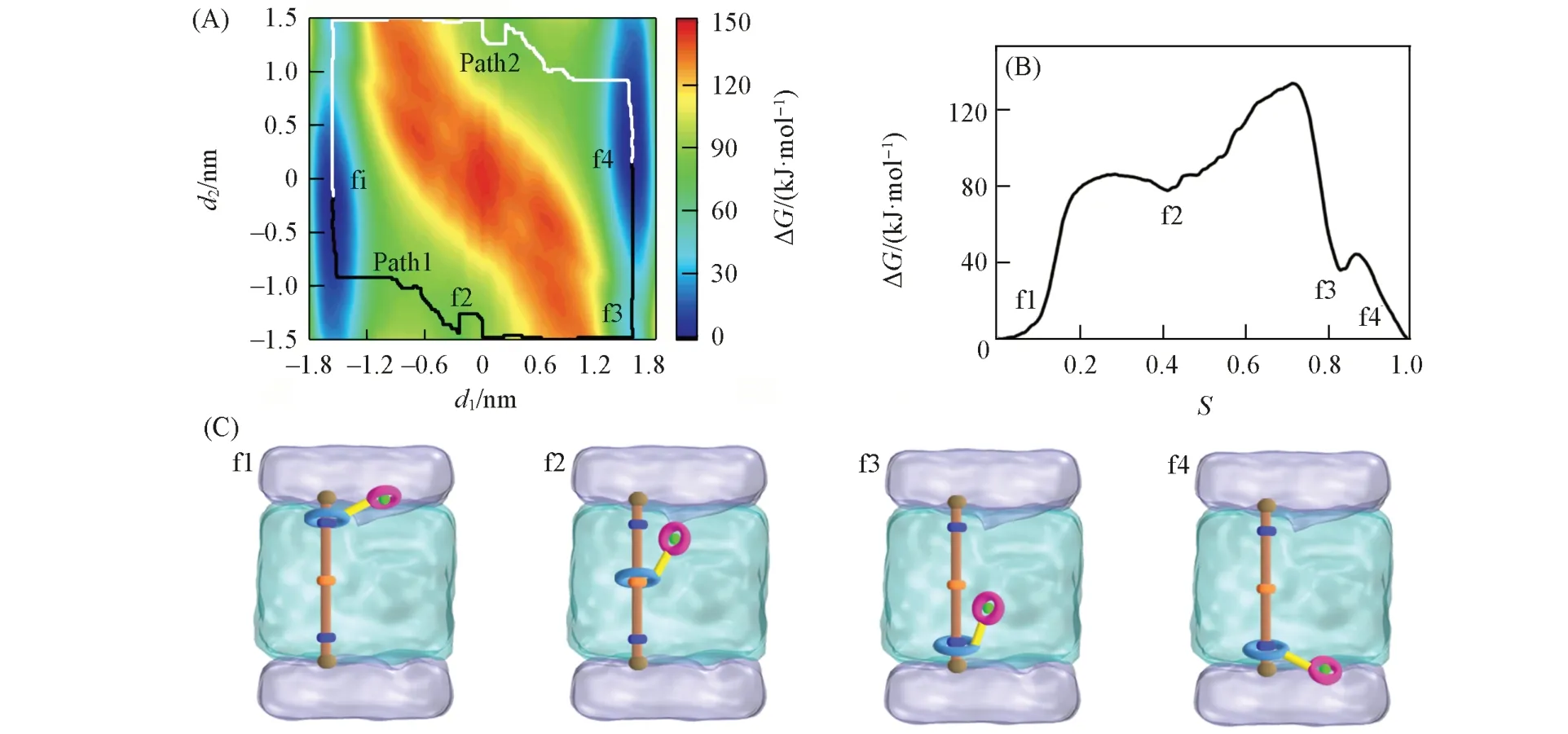
Fig.4 Free⁃energy profile and the lowest free energy pathway(LFEP,black and white line)underlying the shuttling movement of rotaxane 1 with one K+in a simplified model of a biological membrane(A),the corresponding free⁃energy change along the LFEP(B)and representative spatial arrangements along the LFEP(C)
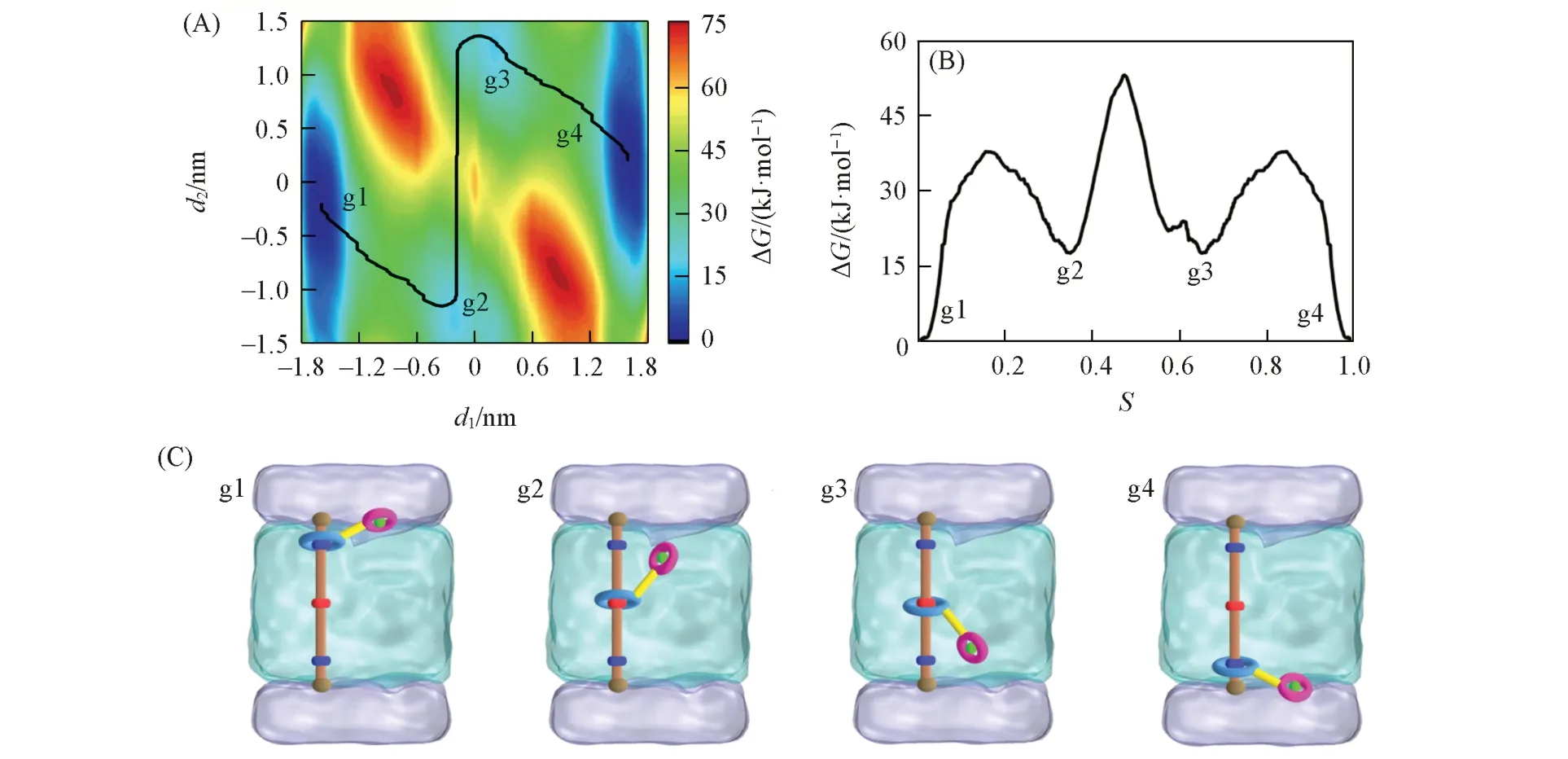
Fig.5 Free⁃energy profile and the lowest free energy pathway(LFEP,black line)underlying the shuttling move⁃ment of rotaxane 2 with one K+in a simplified model of a biological membrane(A),the corresponding free⁃energy change along the LFEP(B)and representative spatial arrangements along the LFEP(C)
图5 (A)~(C)分别给出了轮烷2携带K+在细胞膜简化模型中穿梭运动的二维自由能图、在最低自由能路径上的一维投影及代表性结构示意图(其三维结构见本文支持信息图S4).沿LFEP的自由能势垒约为52.9 kJ/mol,相比于K+在POPC膜内无协助传输[47]的能垒降低约58 kJ/mol,说明该分子梭的运动加速了离子的传输速度.同时,与图4对比发现,轮烷位点2质子化后,其携带离子跨膜的自由能势垒降低约81.2 kJ/mol,穿梭速率显著提高,说明“补给站”在轮烷跨膜传输离子过程中发挥了重要作用.两个对称的低能区域(蓝色区域)代表大环处于位点1和位点3时,小环携带离子倾向于停留在膜表面处,结果与图4一致;两个极小值点g1和g4表明大环与轴上位点1或位点3结合时,小环携带K+处在膜表面的结构是该分子梭的最稳定结构;两个能量相当的次稳定点代表大环处于位点2时,小环相对大环的上下两种摆动,且摆动对穿梭能垒影响较大,结构如图5(C)所示.另外,与该轮烷不携带阳离子在混合溶剂中穿梭运动(图2)相比,两种环境下轮烷的最稳定结构有明显差异,即小环携带K+后载体没有倾向于接触位点2,而是在膜界面处的能量更有利.
通过对轮烷2协助K+跨膜传输过程中的稳态结构和能垒进行分析,整个穿梭过程包括穿梭-摆动-穿梭3个步骤:(1)大环从轴上的结合位点1穿梭到位点2,此时小环处于膜表面;(2)大环保持在位点2,小环相对大环摆动,使小环进入到细胞膜的另一边;(3)大环从位点2穿梭到位点3,并将离子载体推出细胞膜.因此,轮烷轴上质子化的位点2诱发了小环相对大环的摆动,将长途穿梭运动切割为两个短途穿梭,从而降低穿梭能垒,且大环穿梭和小环摆动的协同运动在离子跨膜转运过程中起着至关重要的作用.2021年,Bao和Qu等[24]基于位点2在[2]轮烷穿梭运动中的重要作用,进一步在该位点引入偶氮苯光致异构基团,实现了仿生膜上可逆ON/OFF的光门控高效离子跨膜运输.图6(A)和(B)分别给出了轮烷2跨膜转运离子过程中大环和轴以及小环-离子复合物和水之间静电相互作用能(E)沿反应坐标的变化.结合LFEP可以明显看出,大环在位点1和位点3之间穿梭(沿d1)的驱动力是大环和轴上这两个结合位点的静电相互作用,而小环携带K+摆动(沿d2)的驱动力是小环-离子复合物和水的静电相互作用.
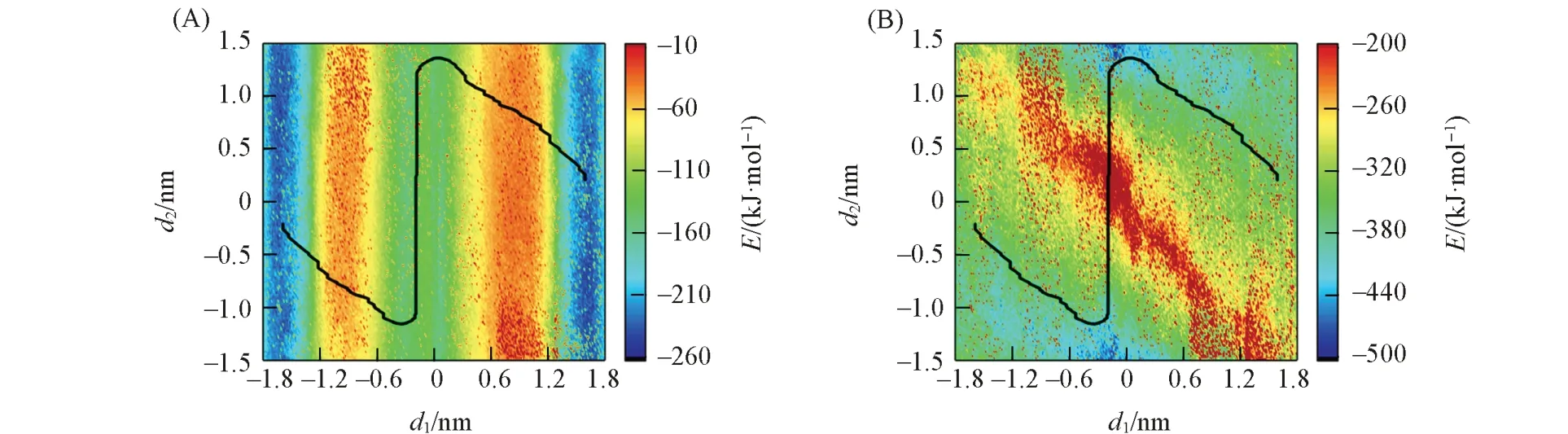
Fig.6 Variation of the electrostatic interaction energy between the wheel and the axle(A),carrier⁃ion complex and H2O along the transition coordinate for the shuttling movement of rotaxane 2 with one K+(B)
需要指出的是,计算所得的穿梭能垒比在POPC双层膜中的计算结果[22]要低约22 kJ/mol,但轮烷在携带K+穿越简化细胞膜过程中的稳态/亚稳态结构、穿梭-摆动-穿梭运动过程及协同作用机制,与其在POPC膜中跨膜转运K+的模拟结果一致,模拟时间是后者的近1/8.因此,利用水-氯仿-水构成的“夹心”溶剂来模拟简化细胞膜,在保证磷脂双分子层性质的同时,又可以缩短模拟时间,大幅度提升计算效率.
3 结 论
采用分子动力学模拟结合高效先进的自由能计算方法,研究了一个能够协助K+跨膜运动的轮烷型分子梭,探索了溶剂环境及中间结合位点(位点2)的不同质子化状态对其(不携带K+)穿梭行为的影响.结果表明,对于氯仿、乙腈、水和氯仿-乙腈混合溶剂而言,溶剂的改变不影响轮烷穿梭运动的模式,但随着溶剂极性的降低,轮烷穿梭过程所需克服的自由能能垒显著增加,且在弱极性溶剂氯仿中,轮烷的穿梭行为极难发生;在混合溶剂中,位点2的质子化和去质子化不影响小环的摆动及其穿梭能垒.进一步探究了位点2对该轮烷携带K+跨膜(“夹心”溶剂)行为的影响,发现其质子化后可以大幅度降低轮烷携带离子穿梭所需克服的能垒,提高离子转运速率,且带正电的位点2诱发了小环相对于大环的摆动,两种运动的协同,即穿梭-摆动-穿梭,使大环在轴上的穿梭能垒降低,是其跨膜离子转运功能得以实现的重要原因.基于本文的分子梭协助离子跨膜运输方式和转运机制的研究,对计算机辅助人工离子转运体的设计提出以下建议:(1)纳米器件应具有两亲性,其长度应该与膜的厚度一致,使其组装到膜内具有高度的稳定性;(2)冠醚环的大小需要匹配不同阳离子的尺寸,以实现人工转运体的离子选择性;(3)纳米器件不同组分在两亲性环境中的协同运动是提高穿梭速率不可忽略的因素;(4)利用分子梭对pH变化、光照、温度、溶剂等的响应,改变轮烷轴上结合位点的亲和力,有望实现离子的可控定向传输.
支持信息见http://www.cjcu.edu.cn/CN/10.7503/cjcu20210483.