紫杉醇诱导乳腺癌多倍体巨细胞产生及干性维持的研究
2021-10-15张正祥赵维东陶运香杨志敏
张正祥,赵维东,陶运香,杨志敏
(皖南医学院第一附属医院 弋矶山医院 1.肿瘤内科;2.皮肤科,安徽 芜湖 241001)
乳腺癌是女性发病率最高的恶性肿瘤[1],化疗是晚期乳腺癌重要的治疗手段,化疗后肿瘤内部会产生与普通癌细胞明显不同的形态和分子特征,这也是导致肿瘤异质性增强并产生化疗抵抗的原因。紫杉醇(paclitaxel,PTX)是一种微管降解抑制剂,是乳腺癌常见的一线化疗药物[2],但同样会存在乳腺癌治疗后耐药或进展,本研究运用PTX探索了体外乳腺癌细胞在化疗药物作用下的形态变化,探索了多倍体巨细胞(polypoid giant cancer cell,PGCC)的存在特征,并初步探索了PGCC的干性特征,为探索肿瘤复发机制和靶向治疗提供了一种思路。
1 材料与方法
1.1 材料 人乳腺癌细胞MDA-MB-231和鼠乳腺癌细胞4T1均购自中国科学院细胞库,细胞培养在含10%胎牛血清(杭州四季青)、1%青霉素和1%链霉素的Dulbecco改良Eagles′s培养基(北京,Thermo)中,培养箱环境温度37℃,含5%CO2。
1.2 临床样本 选取2020年1~12月弋矶山医院初诊乳腺癌患者44例,具有粗针穿刺活检(core needle biopsy,CNB)及手术切除的完整病理资料,病理确诊为乳腺浸润性癌,均为女性,平均年龄(53.70±7.65)岁,所有患者手术前均经过规范新辅助化疗(neoadjuvant chemotherapy,NACT),其中2例患者NACT过程中使用2种方案(1例TEC×4周期 + NP×1周期;另1例PEC×1周期 + TCbH×3周期)进行序贯化疗,其余患者均使用单一方案进行4~6周期化疗。所有患者化疗方案均含有“T”,即紫杉类药物,包括PTX、多西他赛、白蛋白紫杉醇。详见表1。
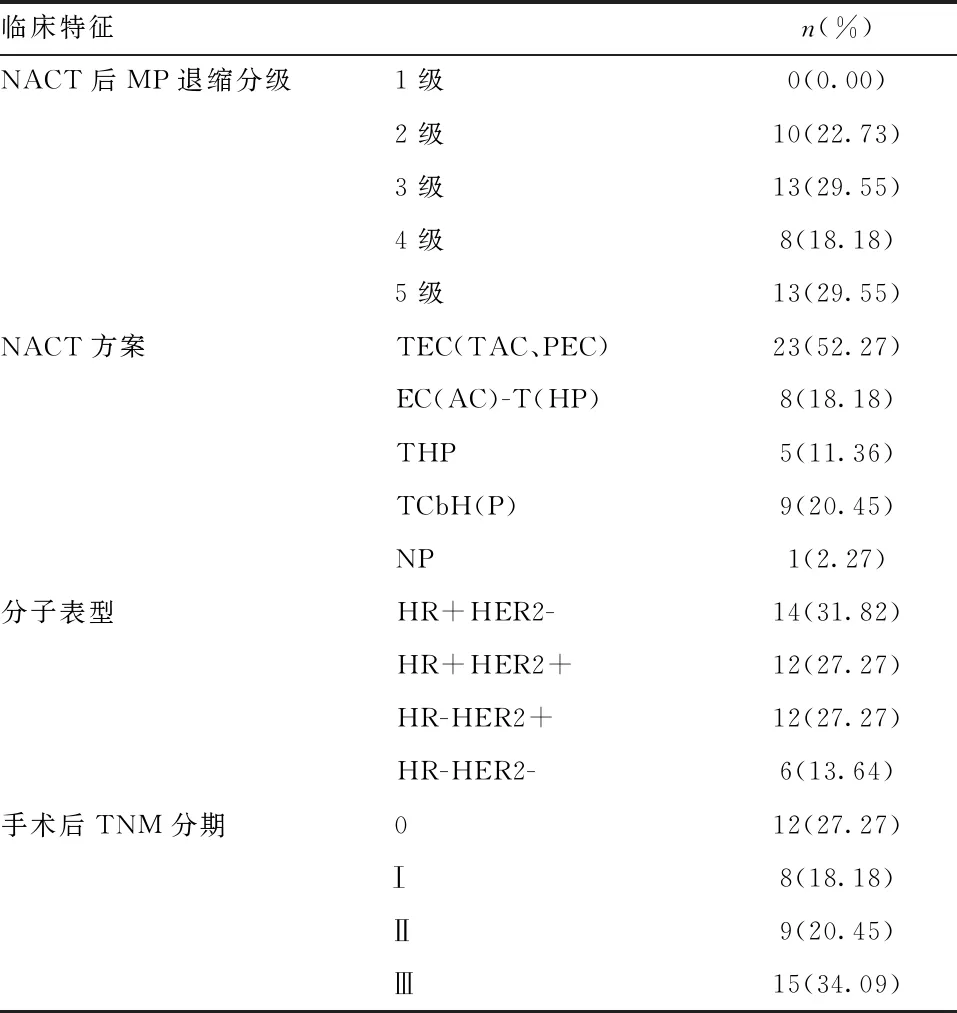
表1 44例NACT乳腺癌患者的临床基本资料
1.3 方法
1.3.1 细胞爬片及细胞染色 将专用细胞爬片铺入24孔板内,4T1和MDA-MB-231细胞以2×105/孔密度接种于其上,24 h后使用含10 nmol/L PTX培养液进行培养48 h[3],对照组加入DMSO培养,随后特定的时间点使用4%多聚甲醛(pH 7.4)固定30 min,蒸馏水洗,苏木精细胞核染色。入0.5%盐酸乙醇溶液分化,蒸馏水洗后伊红溶液染色,后用梯度乙醇溶液脱水,二甲苯透明,并用树胶固封后显微镜观察。
1.3.2 细胞免疫荧光 细胞经4%多聚甲醛(pH 7.4)固定,用0.3%Triton-X100渗透,并用5%的驴血清在PBS中于室温下阻断1 h,一抗4°C下孵育过夜后,荧光标记的二抗在室温下孵育20 min。细胞核用4′,6-二脒基-2-苯基吲哚(DAPI)染色。用徕卡SP8共聚焦激光扫描显微镜进行细胞分析。
1.3.3 免疫组织化学 因Miller-Payne (MP)分级5级标本中残存癌细胞难以评估,故选取非5级标本,经HE观察后选取蜡块进行切片,脱蜡、梯度酒精脱水,0.1 mol/L柠檬酸盐缓冲液(pH 6.0)高压锅内抗原修复,3% 过氧化氢溶液阻断内源性过氧化物酶。血清封闭,一抗 4℃ 孵育过夜。二抗室温孵育1 h。应用3,3′-二氨基联苯胺(DAB)显色,苏木精染色细胞核。阳性判定标准:在细胞浆及细胞核出现棕黄色颗粒为阳性。光镜下随机观察6个400倍视野,记录阳性细胞百分比。
1.3.4 Western blot 预冷的RIPA裂解液裂解细胞,离心机12 000 r /min×10 min收集制备蛋白,10% SDS-PAGE进行分离转移到PVDF膜,室温下用含有1%BSA的TBST封闭1h,加入鼠抗人 OCT-4(稀释度1∶1 000),SOX-2(稀释度1∶1 000),NANOG(稀释度1∶1 000),β-actin(稀释度1∶1 000)一抗后4℃ 孵育过夜,1×TBST洗涤3次,5 分钟/次。加入HRP 标记的驴抗鼠IgG二抗室温孵育1 h。ECL试剂显影检测。

2 结果
2.1 PTX诱导乳腺癌细胞产生PGCC 利用PTX处理乳腺癌细胞4T1和MDA-MB-231,PTX处理后两种细胞形态发生明显变化,异质性增强,主要表现为细胞增大,出现PGCC。PGCC除了多核特征外,也表现为奇异核、微核,染色质不均质浓染等表现。详见图1。
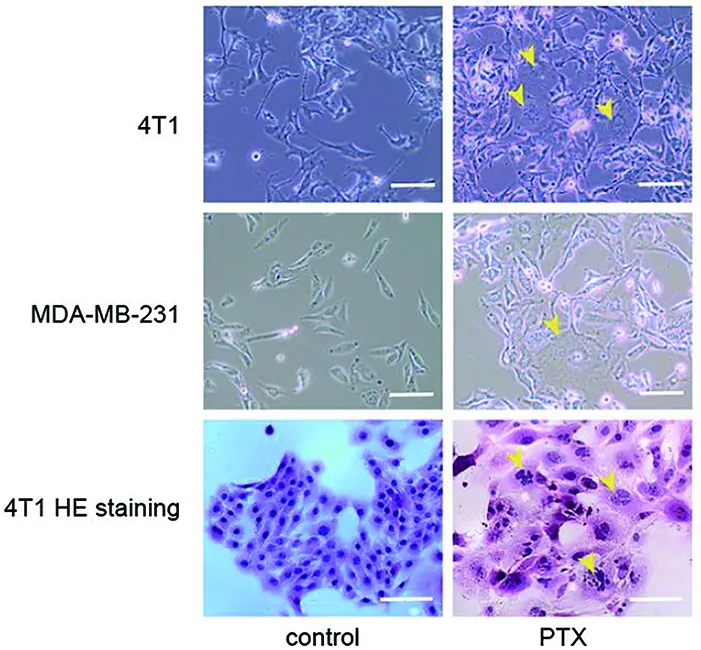
出现PGCC(箭头所示)。标尺100 μm。上、中图为相差显微镜下图像,下图为HE染色图像。
2.2 PGCC会维持存在较长时间 为了验证PGCC的最终归宿,本研究利用细胞爬片观察了PTX处理后15天内的乳腺癌PGCC数量变化。 PTX处理后第5天PGCC数量达到最高,在处理后第15天PGCC虽较前期明显减少,仍然存在于细胞群体内,且数量仍较对照组即未处理组增多,差异均有统计学意义(P<0.05)。详见图2。
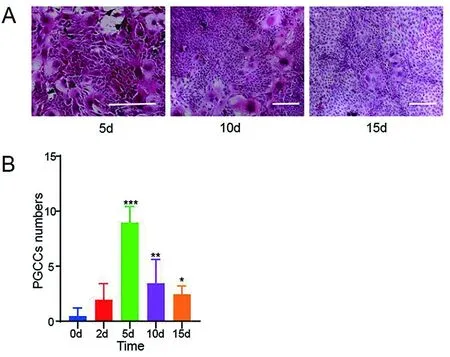
A.5、10、15 d的代表性图像,HE染色,标尺200 μm;B.不同时间点PGCC数量(计数6个随机高倍视野下)对比(F=28.425,P=0.000;与对照组比较,*P<0.05,**P<0.01,***P<0.001)。
2.3 PTX诱导乳腺癌细胞干性增加,且PGCC表达干性标志物 因为PGCC产生后有维持存在的特性,为了验证PGCC是否有干性特征,本研究进行了干性标志物的检测(图3A),在PTX处理后,细胞群体内的干性标志物NANOG、OCT-4、SOX-2明显增强。为了进一步验证PGCC是否有干性,本研究进行了OCT-4、NANOG免疫荧光检测,可见PGCC细胞浆呈强阳性表达,胞核呈弱阳性表达(图3B)。

A.Western blot检测紫杉醇处理后干性标志物NANOG、OCT-4、SOX-2表达;B.免疫荧光显示OCT-4、NANOG表达较对照组升高。标尺25 μm。
2.4 NACT后乳腺癌组织的PGCC明显增多,并具有增殖活性 为了进一步探索人体内化疗药物如PTX对癌细胞的作用,本研究选取了NACT乳腺癌患者资料,所有患者均进行了以PTX或多西他赛等紫杉类药物为主的术前化疗方案(表1)。HE切片上可以看出,和术化前粗针穿刺标本组织相比,经NACT后手术切除的癌组织内存在较多的PGCC,差异有统计学意义(t=7.672,P=0.000)(图4A、B)。干性标志物染色显示NACT后肿瘤细胞呈核及胞浆内表达(图4C),其中多核PGCC细胞同样呈阳性表达。Ki67免疫组化提示PGCC明显表达(图4D),而且和周围的非PGCC癌细胞相比,Ki67染色程度较深,证实该类细胞与普通癌细胞相比,有较强的增殖能力。且和术化前标本相比,经化疗刺激后再增殖的癌组织具有较高的Ki67指数,差异有统计学意义(t=2.485,P=0.017)(图4E)。
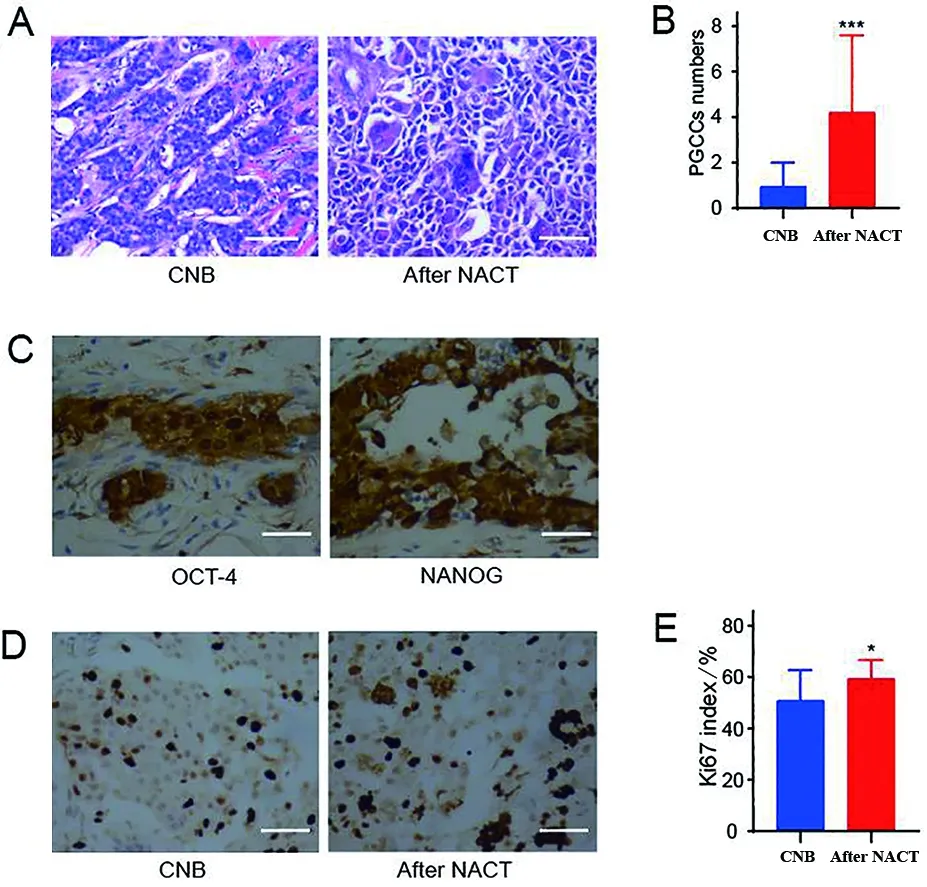
A.CNB标本与NACT后手术标本HE染色对比;B.NACT后PGCCs数量增多(计数6个高倍视野下);C.NACT后手术标本中检测OCT-4、NANOG干性标志物表达; D.1例患者NACT前后的Ki67染色代表图像;E.NACT后Ki67阳性指数增高。标尺100 μm,*P<0.05,***P<0.001。
3 讨论
癌组织内非程序化的细胞多倍体会导致基因组不稳定性[4],与肿瘤低分化程度及P53突变有关,高度多倍体肿瘤的侵袭性较高[5]。PGCC被认为是促进癌症的根源[6],但也有研究认为这些多倍体细胞存在肿瘤抑制作用[7]。
PTX诱导产生的PGCC和肿瘤组织内固有多核巨细胞有所不同,化疗药物产生的DNA损伤可以促使肿瘤组织内产生大量的PGCC,大部分PGCC会死亡,但是一部分PGCC可以存活并通过不对称分裂产生增殖活跃的子代细胞[8-10],反而成为肿瘤逃逸化疗的细胞机制。有研究证实小剂量放射线或化疗药物能使肿瘤组织产生干性增加[11],但具体机制不清。本研究从细胞和组织层面均证实了PGCC在化疗后产生增多,并持续维持较长时间,这和癌性干细胞具有自我更新能力、具有较长寿命相符,说明PGCC与肿瘤化疗抵抗相关[12]。 PGCC也表达干性标志物,是一种肿瘤起始细胞[13]。OCT-4、SOX-2在PGCC上均呈明显的胞浆表达,这和其他癌种的表现一致[14]。干性维持是一个动态的过程,肿瘤干性标志物的胞浆表达可能是干性维持过程的一个环节,OCT4细胞内不同定位表达可以被认为是干细胞不同阶段的指标,这也解释了不同癌症类型中OCT4定位差异[15]。另外,Ki67在PGCC中也观察到明显表达,说明PGCC处于增殖状态,这和PGCC的干性增殖特征是一致的。
随着综合治疗进步,乳腺癌患者接受术前NACT越来越多,生存率和生活质量都得到了极大提高,但是晚期乳腺癌仍然不能根治。本研究探索了NACT后乳腺癌内部异质性,特别是PGCC对肿瘤复发的意义,为复发机制研究提供了思路。但是要指出的是,不同患者从NACT中获益程度不尽相同[16],本次研究中肿瘤退缩程度也有明显差异,表1显示MP分级从1级至5级不等,这与NACT后手术的时间间隔、化疗药物的不同都可能相关,但也有可能是肿瘤某些本质特征导致的,如内分泌基因表型、P53基因是否突变等,有待后续进一步探索。
