程序性死亡配体1与结直肠癌预后的相关性分析
2021-10-15王胜男王臣慈盛莉莉谷生丽
潘 杨,王胜男,王臣慈,盛莉莉,谷生丽
(1.皖南医学院第一附属医院 弋矶山医院 肿瘤内科,安徽 芜湖 241001;2.皖南医学院 a.生物化学与分子生物学教研室;b.医学寄生虫学教研室,安徽 芜湖 241002)
结直肠癌(colorectal carcinoma,CRC)是常见的消化道恶性肿瘤之一,其病死率居世界第三位,已成为一种严重威胁健康的恶性疾病[1]。尽管目前针对结直肠癌的靶向治疗使患者的总体生存率显著提高,但仍有近半数患者死于复发或转移[2]。因此,探究结直肠癌的潜在治疗靶点具有重要的临床意义。程序性死亡配体1(programmed death-ligand 1,PD-L1)又称CD274或B7-H1,是免疫卡控点的重要成员,可与程序性死亡受体1(programmed death-1,PD-1)结合,传导T细胞抑制性信号,介导肿瘤的免疫逃逸[3]。众多研究表明,PD-L1可在肾细胞癌[4]、乳腺癌[5]、非小细胞肺癌[6]等多种恶性肿瘤中表达升高,并与患者的生存预后密切相关,但对结直肠癌的报道较少。因此,本研究旨在分析PD-L1在结直肠癌组织中的表达及与临床预后的相关性,从而为肿瘤的免疫治疗提供新的理论依据。
1 资料与方法
1.1 资料 收集2013年12月~2015年12月入住弋矶山医院肿瘤内科并接受D2根治术的100例结直肠癌患者,所有患者术前均未行放化疗,术后病理均证实为结直肠腺癌,病理和随访资料完整。100例患者中男性54例,女性46例;年龄34~80岁,中位年龄62岁;右半结肠癌19例,左半结肠癌24例,横结肠癌9例,直肠癌48例;有淋巴结转移者34例,无淋巴结转移者66例;有脉管浸润者38例,无脉管浸润者62例;大体类型:溃疡型70例,隆起型30例;分化程度:中分化87例,低分化13例;美国癌症联合会(AJCC)分期:Ⅰ期9例,Ⅱ期57例,Ⅲ期34例。采用电话、门诊等方式长期随访,时间截止于2020年10月,所有患者的肿瘤组织石蜡标本均取自病理科。随机抽取20例患者的癌旁组织石蜡标本(距手术切缘>5 cm)作为对照组,其中男性11例,女性9例;年龄34~76岁,中位年龄66岁。
1.2 方法 石蜡标本均经5 μm厚连续切片、40℃水温摊片和60℃ 1 h 烤片制成切片后,再用PV-6000通用型免疫组化试剂盒检测PD-L1的表达情况。其中PD-L1兔单克隆抗体的工作浓度为1∶100;阴性对照为PBS代替一抗,阳性对照为扁桃体阳性切片。
1.3 结果判读 细胞膜和(或)细胞质出现棕黄色颗粒为PD-L1阳性。根据阳性细胞所占肿瘤细胞总数的百分比(tumor proportion score,TPS),将5%定义为肿瘤组织中PD-L1阳性[7]。以上结果均由2名高年资病理医师独立评估,不一致时由第3名病理医师判决。
1.4 统计学方法 采用SPSS 26.0统计软件进行数据分析。χ2检验用于计数资料分析,Kaplan-Meier法用于生存分析,Cox风险回归模型用于预后的单因素和多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 PD-L1在结直肠癌组织及癌旁组织中的表达情况 PD-L1主要定位于细胞膜,呈棕黄色颗粒,见图1。结直肠癌组织的PD-L1阳性表达率高于癌旁组织[40.00%(40/100)vs.15.00%(3/20)],差异有统计学意义(χ2=4.530,P=0.033)。
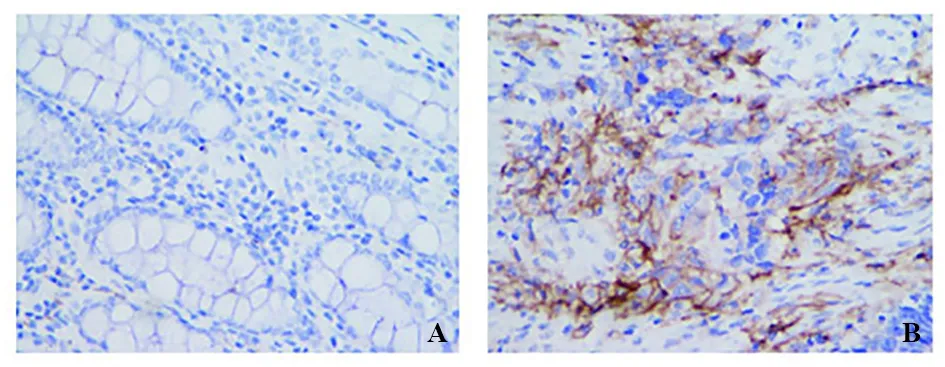
A.PD-L1在结直肠癌旁组织阴性表达(×400);B.PD-L1在结直肠癌组织阳性表达(×400)。
2.2 PD-L1与结直肠癌患者生存预后的相关性 100例结直肠癌患者的中位随访时间为65.5个月(0~82个月)。Kaplan-Meier生存分析显示,PD-L1阳性者的平均总生存期(OS)较阴性者缩短[(52.15±4.61)月vs.(71.55±2.80)月],且5年生存率也降低[45.00%(18/40)vs.80.00%(48/60)],差异均有统计学意义(P<0.05),见图2。由于PD-L1阴性组的死亡患者未过半,我们无法比较两组的中位OS。亚组分析显示,以淋巴结转移数目分组时,N0和N1亚组中PD-L1阳性者的OS缩短(P<0.05);再以TNM分期分组时,Ⅱ期亚组中PD-L1阳性者的OS也缩短(P<0.05),见图3、4。由于Ⅰ期患者数量过少,我们仅作Ⅱ期和Ⅲ期的分析,此外,N2和Ⅲ期亚组中PD-L1阳性者的OS虽有下降,差异却无统计学意义(P>0.05)。
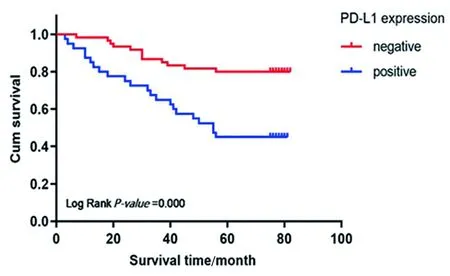
图2 PD-L1表达与结直肠癌患者OS的关系
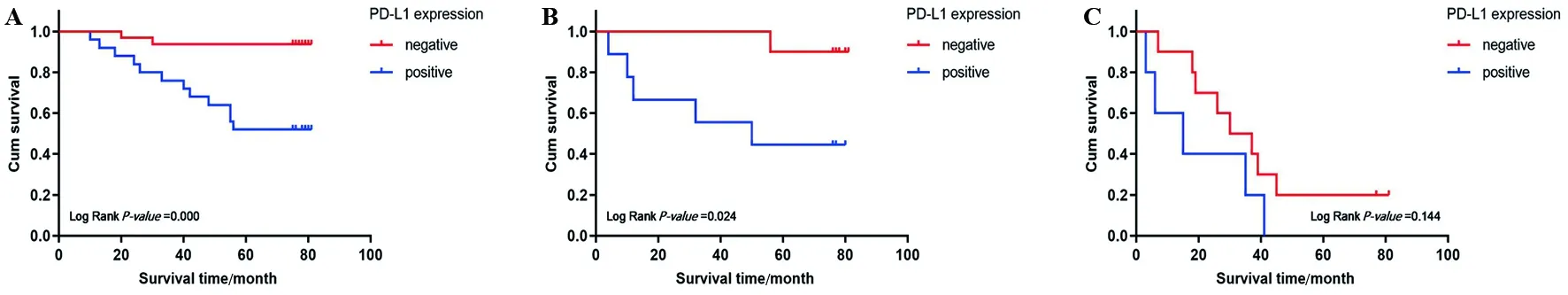
A.两组患者中N0亚组的生存曲线;B.两组患者中N1亚组的生存曲线;C.两组患者中N2亚组的生存曲线。
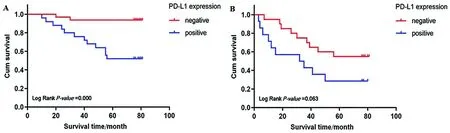
A.Ⅱ期亚组的生存曲线;B.Ⅲ期亚组的生存曲线。
2.3 结直肠癌预后危险因素的分析 单因素Cox回归分析显示,性别、有无淋巴结转移以及PD-L1表达情况与结直肠癌的预后存在相关性(P<0.05)。根据单因素分析结果,我们以P<0.10的标准进行多因素Cox回归分析。结果显示,有淋巴结转移或脉管转移以及PD-L1表达阳性是结直肠癌预后的独立危险因素(P<0.05),见表1、2。

表1 单因素分析结直肠癌的预后危险因素
3 讨论
人体免疫系统可识别、清除肿瘤细胞,发挥免疫监控效应;但肿瘤细胞自身也可表达免疫卡控点分子诱导T细胞衰竭,发挥免疫逃逸效应[8]。PD-1是免疫球蛋白超家族成员,具有胞外IgV结构域、跨膜结构域以及免疫受体酪氨酸抑制基序(ITIM)和转换基序(ITSM)组成的细胞浆尾区,主要表达于T细胞、B细胞、NK细胞等免疫细胞表面[9];而PD-L1是免疫卡控点重要成员,主要表达于活化的T细胞、B细胞、DC细胞或经细胞因子(IFN、TNF等)刺激的上皮、间质、免疫等细胞[10]。当PD-1与PD-L1结合时,可激活ITIM和ITSM基序使下游效应分子PI3K去磷酸化,从而抑制T细胞活化所需的基因和细胞因子的转录、翻译过程[11]。
鉴于PD-1/PD-L1信号通路是肿瘤免疫逃逸的重要途经,研究设计免疫卡控点的抑制剂成为免疫治疗的新方向。目前已有多项研究表明,PD-L1在非小细胞肺癌、恶性黑色素瘤、肾癌、乳腺癌等多种恶性肿瘤中表达升高,发挥免疫负性调节作用,促进肿瘤的发生发展[12]。Qing等[13]用免疫组化法分析了107例胃癌组织中PD-L1和APE1表达及与生存预后的关系,发现PD-L1和APE1高表达是胃癌预后的危险因素;而Jung等[14]也用免疫组化法分析了85例肝癌组织中PD-Ls(PD-L1和PD-L2)表达及与生存预后的关系,发现PD-Ls高表达是肝癌预后的危险因素。由此推测,PD-L1可能是判断癌症预后的重要参考指标。
关于PD-1/PD-L1与结直肠癌预后的研究尚有争议。复旦大学蔡三军[15]团队分析了TCGA数据库中356例结直肠癌标本,发现PD-1/PD-L1高表达患者的预后更好;然后用免疫组化法检测了276例结直肠癌标本中肿瘤细胞PD-L1(TCs-PD-L1)和肿瘤浸润淋巴细胞PD-1(TILs-PD-1)的表达水平,发现TCs-PD-L1和TILs-PD-1均与患者OS呈正相关,且TILs-PD-1是结直肠癌的独立预后因素。反之,Li等[16]对检索的10项PD-L1与结直肠癌预后关系的研究进行了Meta分析,发现PD-L1表达升高可能提示结直肠癌预后不良。为了进一步探究PD-L1对不同亚型结直肠癌预后的影响,Droeser等[17]将1 491例结直肠癌患者根据有无错配修复(MMR)缺陷进行分组,发现MMR阳性伴PD-L1高表达提示生存期延长;Koganemaru等[18]将235例结直肠癌患者根据PD-L1的表达细胞进行分组,发现TCs-PD-L1高表达提示生存期缩短,而TILs-PD-L1高表达则提示生存期延长。由此可见,国内外针对PD-L1与结直肠癌预后关系的研究缺乏共识,我们有必要对中国地区结直肠癌患者PD-L1的表达及与临床预后的相关性进行深入探讨。
本研究中,我们发现PD-L1在结直肠癌组织中的表达水平高于癌旁组织(40.00%vs.15.00%,P=0.033),且阳性患者的平均OS(52.15月vs.71.55月,P=0.000)和5年生存率(45.00%vs.80.00%,P=0.000)均降低。根据淋巴结转移数目和TNM分期进行分组时,发现N0、N1和Ⅱ期亚组中PD-L1阳性患者的OS均低于阴性患者(P<0.05);而N2和Ⅲ期亚组差异无统计学意义(P>0.05)。考虑原因可能是样本量过小导致结果不能反映总体,还需扩大样本进一步分析。单因素分析显示,女性结直肠癌患者的预后更差,这与Yang等[19]结论一致,即女性结直肠癌患者可能受内源性激素作用存在较高的死亡风险;而多因素分析显示,有淋巴结转移或脉管转移以及PD-L1表达阳性是结直肠癌预后的独立危险因素(P<0.05),至于分化程度和TNM分期不能影响结直肠癌预后的原因可能是病理医师存在主观评估的差异。鉴于PD-L1对抗肿瘤免疫反应的影响,我们推测高表达的PD-L1可能促进结直肠癌的淋巴结转移,这与Kamiya等[20]结论一致,即TCs-PD-L1高表达是皮肤鳞状细胞癌淋巴结转移的危险因素。
综上所述,我们认为PD-L1是判断结直肠癌临床预后的重要参考指标,并可能影响肿瘤的生长、侵袭、转移等生物学行为,但其确切的作用机制还有待于进一步探索。
