丹酚酸B通过Nrf2通路改善CCl4介导的大鼠肾损伤
2021-10-15王冬梅叶长江陈祥祥黄浩宇孙恩涛
周 欢,王冬梅,路 勇,叶长江,陈祥祥,黄浩宇,孙恩涛,浦 春
(1.皖南医学院 检验学院,安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 检验科,安徽 芜湖 241001)
肾脏在调节血容量和毒素及药物的排出方面起着关键作用,具有很高的药物吸收能力,也使得它们容易受到药物毒性影响导致肾脏损伤。四氯化碳(carbon tetrachloride,CCl4)是一种环境污染相关的肝毒性物质,在氧化应激过程中,肾脏是其另一个重要靶器官[1]。核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)是一种在细胞保护中具有重要作用的经典转录因子,在应激条件下ROS过量时Nrf2就会被激活[2]。丹酚酸B(salvianolic acid B,SalB)是中药丹参的水溶性成分,具有抗氧化、抗炎、肾脏保护等多种生物活性[3]。最新研究表明SalB参与了多种疾病中Nrf2信号通路的激活,并且发现SalB通过激活Nrf2信号通路保护缺血再灌注引起的肾损伤[4]。然而,目前尚无证据表明SalB是否通过Nrf2通路保护CCl4引起的急性肾损伤(acute kidney injury,AKI)。因此,本研究探讨CCl4诱导的大鼠模型中SalB的潜在作用,并探讨与Nrf2通路相关的分子机制。
1 材料和方法
1.1 材料 健康雄性SD大鼠,体质量(180±20)g,由浙江省医学科学院实验动物中心提供,动物许可证号[SCXK(浙)2019-000]。主要试剂包括丹酚酸B(上海麦克林),MDA及SOD检测试剂盒(南京建成生物研究所),RNA抽提剂TRIZOL(美国Invitrogen公司),M-MLV逆转录酶(Servicebio),SYBR Green荧光染料(Servicebio)。
1.2 方法
1.2.1 50只大鼠平均分为正常对照组,模型组,SalB低、高剂量组,SalB对照组。正常对照组生理盐水灌胃7 d,模型组生理盐水灌胃6 d,第7天给予3 mL/kg CCl4和橄榄油1∶1腹腔注射,SalB低、高剂量组分别给予SalB(80、160 mg/kg)灌胃7 d[8],3 h后给予3 mL/kg CCl4和橄榄油1∶1腹腔注射,SalB对照组给予SalB(160 mg/kg)灌胃7 d,CCl4腹腔注射后24 h,处死所有大鼠留取血清、肾组织。
1.2.2 血清SCr、BUN测定 腹主动脉采血,进行肌酐(SCr),尿素氮(BUN)检测。
1.2.3 HE病理染色 取左侧肾组织,于多聚甲醛中保存24 h后石蜡包埋,常规HE染色,观察大鼠肾组织病理变化。
1.2.4 氧化应激指标检测 依照试剂盒说明书,化学比色法测定肾组织总SOD活力、丙二醛(MDA)含量。
1.2.5 实时荧光定量聚合酶链式反应(qRT-PCR) 采用Prime 5.0软件设计GAPDH、Nrf2、HO-1基因引物序列,上海生物工程有限公司合成,GAPDH:5′-CTGGAGAAACCTGCCAAGTATG-3′,5′-GGTGGA-AGAATGGGAGTTGCT-3′;Nrf2:5′-GACAAGCCACA-GGACTACAAGAA-3′,5′-CGTATCCACCAGAGTGAA-AAGAA-3′;HO-1:5′-CAGCATGTCCCAGGATTTGTC-3′,5′-TTCTCTGTGGAGCTGAAGCA-3′。取大鼠肾脏组织100 mg,提取总RNA,逆转录成cDNA,qRT-PCR方法检测Nrf2、HO-1基因mRNA表达水平。

2 结果
2.1 病理学改变 光镜下正常对照组及SalB对照组大鼠肾组织结构均正常。各实验组大鼠可见不同程度的肾损伤,肾小球结构大体正常,肾小管上皮细胞肿胀,刷状缘脱落,部分肾小管管腔扩张,模型组偶可见炎性细胞。见图1。
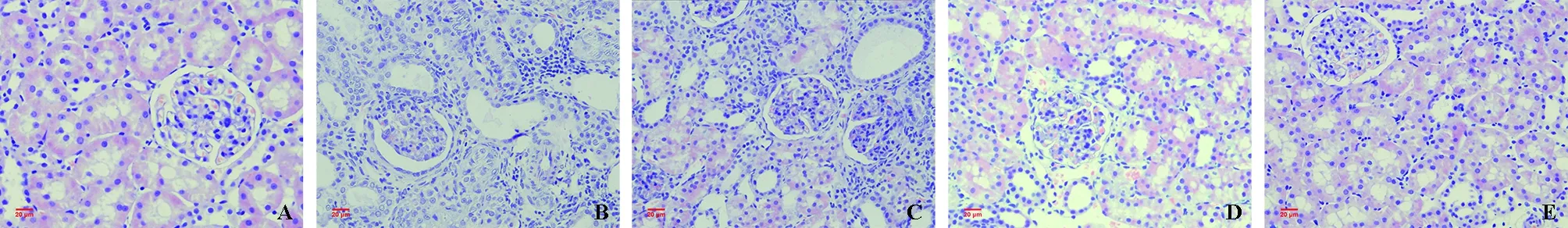
A.正常对照组;B.模型组;C.SalB低剂量组;D.SalB高剂量组;E.SalB对照组。
2.2 大鼠肾功能 与正常对照组比较,CCl4模型组,SalB低、高剂量组大鼠血清SCr、BUN均升高(P<0.05),而与SalB对照组比较差异无统计学意义(P>0.05);与CCl4模型组比较,SalB高剂量组和SalB对照组SCr、BUN均降低(P<0.05);与SalB高剂量组比较,SalB低剂量组SCr升高(P<0.05),SalB对照组SCr、BUN均降低(P<0.05)。见表1。
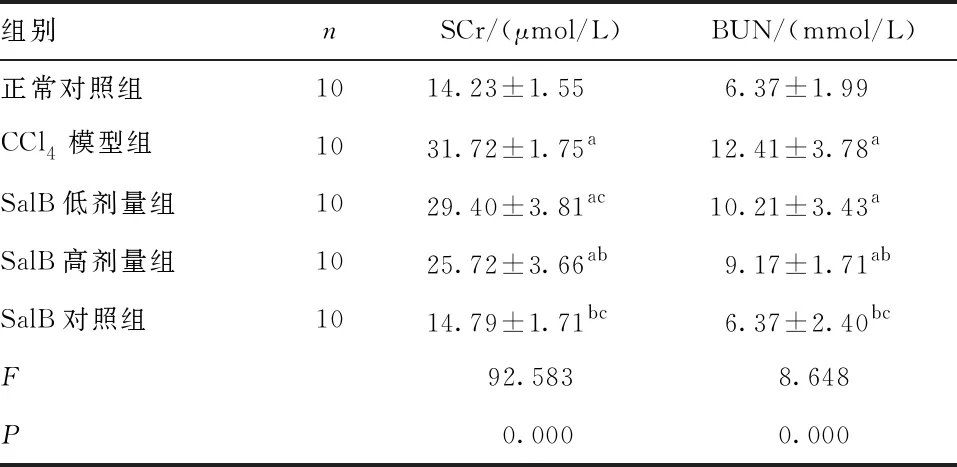
表1 各组大鼠SCr、BUN水平的比较
2.3 氧化应激指标 与正常对照组比较,CCl4模型组,SalB低、高剂量组大鼠肾组织SOD含量均降低(P<0.05),而与SalB对照组比较差异无统计学意义(P>0.05);与CCl4模型组比较,SalB高剂量组和SalB对照组SOD均升高(P<0.05);与SalB高剂量组比较,SalB对照组SOD升高(P<0.05)。与正常对照组比较,CCl4模型组,SalB低、高剂量组大鼠肾组织MDA含量均升高(P<0.05),而与SalB对照组比较差异无统计学意义(P>0.05),与CCl4模型组比较,SalB高剂量组和SalB对照组MDA均降低(P<0.05),与SalB高剂量组比较,SalB低剂量组MDA升高(P<0.05),SalB对照组MDA降低(P<0.05)。见表2。
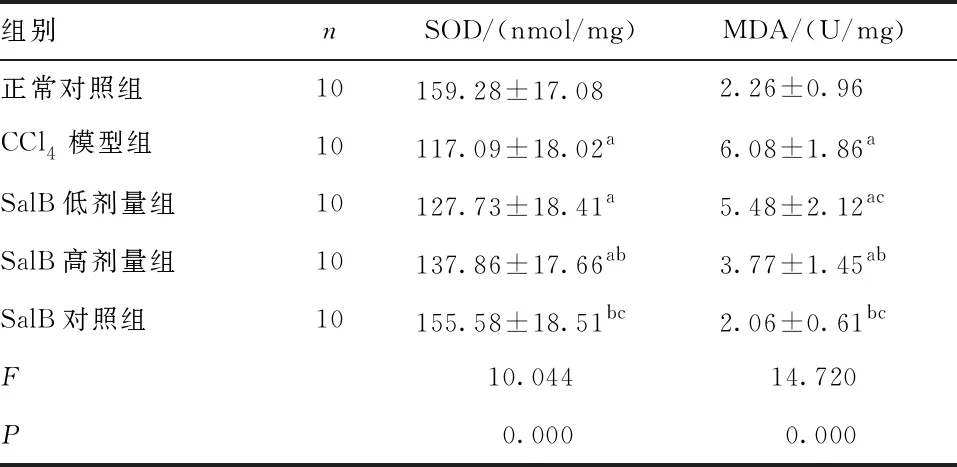
表2 各组大鼠SOD、MDA水平的比较
2.4 Nrf2和HO-1的mRNA表达水平 与正常对照组比较,CCl4模型组大鼠肾组织Nrf2含量降低,SalB对照组大鼠肾组织Nrf2含量升高(P<0.05);与CCl4组比较,SalB高剂量组和SalB对照组Nrf2均升高(P<0.05),与SalB高剂量组比较,SalB低剂量组Nrf2降低(P<0.05),SalB对照组Nrf2升高(P<0.05)。与正常对照组比较,CCl4模型组和SalB低剂量组大鼠肾组织HO-1含量降低(P<0.05),SalB高剂量组大鼠肾组织HO-1含量升高(P<0.05),而与SalB对照组比较差异无统计学意义(P>0.05),与CCl4组比较,SalB高剂量组和SalB对照组HO-1均升高(P<0.05),与SalB高剂量组比较,SalB低剂量组和SalB对照组HO-1降低(P<0.05)。见表3。
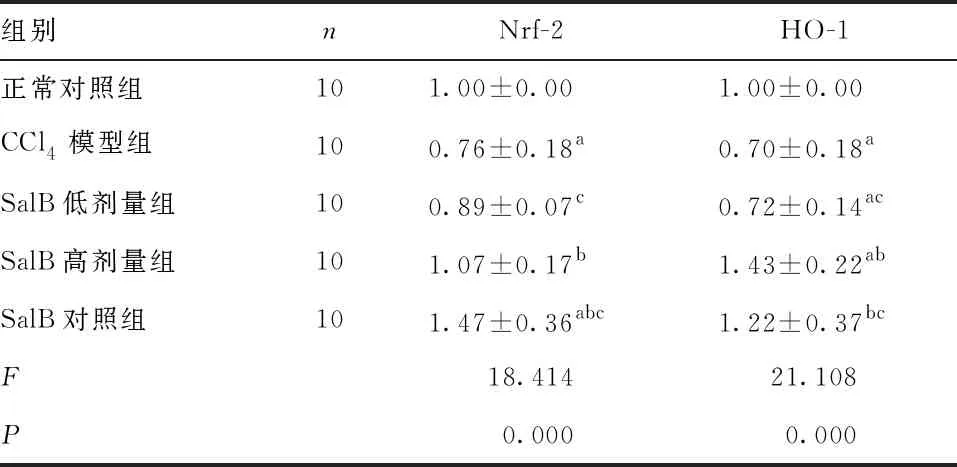
表3 各组大鼠Nrf-2和HO-1的mRNA表达水平的比较
3 讨论
急性肾损伤与各种肾脏疾病密切相关,肾脏在调节血容量和毒素及药物的排出方面起着关键作用,也使它们容易受到药物毒性影响从而导致肾脏损伤。本研究结果表明,在CCl4模型中氧化应激增加,SalB治疗后氧化应激指标下降,肾功能改善,表明氧化应激的增加可能在CCl4所致的肾脏损伤中有重要作用。
在造模成功的前提下,SalB低、高剂量组和SalB对照组SCr和BUN与CCl4组相比均降低,提示SalB对肾脏有保护作用。HE结果表明CCl4组大鼠在SalB治疗后小管病变明显改善,小管损伤减少,说明SalB能缓解CCl4所致的肾损伤。不同剂量SalB对大鼠的治疗作用,高剂量组的治疗效果比低剂量组好,提示SalB的作用可能有不同剂量的依赖性。
氧化应激是指CCl4自由基衍生物产生和积累的病理过程,内源性抗氧化酶(CAT、SOD等)代表机体对抗ROS的第一道防线[6]。本研究中,暴露于CCl424 h后,SOD的抗氧化防御酶活性降低,正如其他研究结果所示[7],说明CCl4能引起肾脏的氧化损伤。SalB各组大鼠肾组织MDA均低于CCl4模型组,SOD高于CCl4模型组,前期的研究也发现SalB可以保护组织躲避氧化剂的损伤[8],表明SalB可显著抑制CCl4所致大鼠肾脏的脂质过氧化,降低MDA水平、增加SOD等抗氧化产物的生成。而本研究中SalB高剂量组抗氧化能力最强,一定的浓度范围内SalB对ROS清除能力增强,之前的报道[9]也提示SalB在ROS的清除上有不同剂量的依赖性。
Nrf2是在抗氧化防御系统中起着关键作用的转录因子,它能够在ROS的产生和内源性细胞抗氧化系统之间保持平衡[10]。氧化应激条件下Nrf-2进入细胞核,然后激活各种抗氧化剂酶,如HO-1、GST等。本研究中肾组织实时定量PCR 结果显示,CCl4模型组中Nrf-2和HO-1的mRNA表达量受到抑制,与以往文献报道一致[11],说明Nrf-2和HO-1参与了CCl4模型大鼠的氧化应激过程。与CCl4模型组比较,SalB低、高剂量组和SalB对照组Nrf-2和HO-1的mRNA表达量均升高,表明SalB能够增加Nrf-2和HO-1的mRNA表达,与前期研究一致[12]。AKI是一个较为复杂的过程,本研究结果提示SalB具有抗氧化反应的作用,这可能只是肾脏氧化应激反应众多机制中的一种,后续我们还将继续完善动物模型研究及体外氧化应激细胞增殖等经典通路的探索。此外,本研究结果提示SalB高剂量组的抗氧化应激的作用优于低剂量组,后续也将重点探讨SalB的最佳剂量及其可能机制。
综上所述,本研究观察SalB作用下CCl4模型大鼠血清、肾组织相关指标的变化,结果发现SalB能够减轻CCl4大鼠肾脏组织中氧化应激水平,并对肾功能起到相当程度的保护作用。SalB已被证实在多种疾病中有较好疗效,其在肾脏损伤及保护作用仍然需要进一步研究,为基础研究向临床及产业化转化提供有力的理论支持。
