STX2通过调控JNK信号途径抑制肺癌细胞的增殖和迁移
2021-10-15吴兴伟
吴兴伟,吕 坤,耿 彪
(皖南医学院第一附属医院 弋矶山医院 1.中心实验室;2.呼吸内科,安徽 芜湖 241001)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的癌症,其侵袭性强,治疗困难,近年来死于肺癌的人数在世界范围内一直呈指数级增长[1-2],其中NSCLC约占所有肺癌病例的85%[3-5],肺癌的主要诱因是环境污染和吸烟[6],NSCLC的治疗技术包括手术、靶向治疗、化疗等[7-8]。尽管在过去的20年内,NSCLC的治疗取得了重大进展,但NSCLC患者的5年生存率仍然小于15%[9],患者局部复发、转移和耐药等常见[10-12]。因此,目前迫切需要探明NSCLC的致病机理,以便寻找准确的肿瘤标志物和治疗靶点。Syntaxin2(STX2)是突触融合家族的重要成员,并且高度保守。STX2通过其C末端域锚定到细胞膜上,并通过其N末端域起作用,在几种癌症的肿瘤发生或转移中,STX2参与通过调节几个关键癌基因的表达水平,如β-catenin和MMP9的表达[13-15]。然而,STX2在肿瘤中,特别是NSCLC中的临床和生物学作用尚不清楚。在本研究中,我们旨在探讨STX2在NSCLC增殖、迁移和侵袭中的作用及其可能的分子机制。
1 材料与方法
1.1 细胞培养和转染 肺癌细胞系来源于中国科学院(上海)细胞库。细胞在含有10%胎牛血清(Gibco,USA)的RPMI-1640(Gibco,USA)中于37℃和5% CO2的培养箱中培养。设计并合成抗STX2的siRNA(si-STX2)。根据GenMute转染试剂盒(SignaGen,USA)的协议,在大约60%的汇合处用siRNA转染细胞。
1.2 实时定量PCR 用TRIzol(Ambion,life technologied,Carlsbad,CA,USA)从细胞和组织中提取的总RNA(1 μg),在cDNA合成试剂盒(Thermol-scientific)反转录成cDNA。定量实时PCR(RT-PCR)用QuantiNovaTMSYBR® Green PCR Kit(Qiagen,Hilden,Germany)。STX2的引物,正向:ATTCGGTGCTGTCTCGGAAGTTTG;反向:TCGTCGTCTGTGGTGGTTCTCC。用ΔΔCt法估计STX2表达的差异。si-STX2的引物,si-STX2-1:GGATCTTCGGATACGA-AGA;si-STX2-2:GCATCCGAGAGTTGCATGA;si-STX2-3:GGTGCTGTCTCGGAAGTTT。
1.3 Western blot 整个细胞在裂解缓冲液中裂解(KeyGen,China)。用BCA蛋白检测试剂盒(Beyotime,China)测定蛋白浓度。蛋白质样品(30 μg)用SDS-PAGE分离,蛋白质转移到NC膜上(PALL)。在室温下用5%脱脂牛奶(Bio-Rad,美国)将膜封闭1h,然后在4℃下用稀释的一级抗体孵育过夜。然后在室温下用HRP结合的次级抗体孵育1h。用ECL溶液(Bio-Rad,USA)观察印迹。本研究中使用的CDK2、E-cadherin、MMP-2、MMP-9、p-JNK、JNK、β-actin兔单克隆抗体均购自Cell Signaling Technology(CST)。
1.4 CCK-8实验 根据制造商的指南,使用CCK-8试剂盒检测肺癌细胞株的细胞活性。简单的说,细胞以5×103/孔的密度接种于96孔板中,转染24、48、72 h后,将CCK-8分别加入每孔孵育2 h后。450 nm处的OD吸光度由多检测微板阅读器(美国Bio-Tek)检测,每次重复3次。
1.5 平板克隆实验 在6孔细胞培养板中培养2 000个/孔转染处理后的细胞,随后在新的培养基中培养2周。4%多聚甲醛室温固定细胞20 min。PBS洗涤,结晶紫染色20 min,结果用Image,J 1.52版软件进行分析。
1.6 Transwell实验 用微孔膜过滤器(8 μm孔径,微孔)进行侵入实验。简单地说,将50 μL基质凝胶(BD)加入上腔,37℃孵育1h,在上腔中接种5×104个体积为200 μL的细胞。然后在24孔板的孔中放置Transwell室,在下室中加入600 μL RPIM 1 640培养基(含10%FBS)。孵育24 h后,用棉签去除未迁移的细胞。移行细胞用4% PFA固定30 min,结晶紫溶液染色20 min,用磷酸盐缓冲液冲洗后,对5个随机场进行拍照。
1.7 STX2的TCGA验证 UALCAN(http://ualcan.path.uab.edu/index.html)是一个有效的癌症数据在线分析和挖掘网站,主要是基于TCGA的相关癌症数据在数据库中进行分析。我们验证了STX2在UALCAN肺癌数据库中的表达水平。
1.8 统计学分析 使用GraphPad Prism 5.0进行统计学分析。采用单因素方差分析或者t检验进行组间分析比较,所有值至少代表3个独立实验。用t检验分析平均数之间的差异,P<0.05为差异有统计学意义。
2 结果
2.1 肺癌细胞系中的STX2低表达 本课题组在TCGA数据库中分析了肺癌和癌旁组织中STX2的表达。与癌旁组织相比,癌组织中STX2的表达水平均下降(LUAD:Tumorvs.NormalP=0.034,LUSC:Tumorvs.NormalP=0.026,图1A)。本课题组用RT-qPCR检测了STX2在正常人支气管上皮细胞株(16HBE)和两种肺癌细胞株(A549和H1299)中的表达。结果表明,肺癌细胞株A549和H1299中STX2的表达低于人支气管上皮细胞株16HBE(16HBEvs.A549P=0.006;16HBEvs.H1299P=0.004,图1B)。
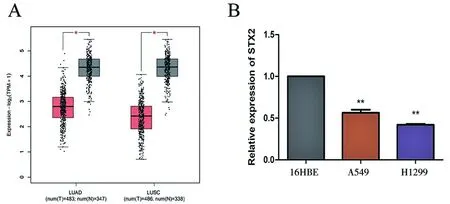
**P<0.01。
2.2 下调STX2可以促进NSCLC细胞的增殖和迁移 为了研究STX2对NSCLC的增殖和迁移的影响,本课题组将STX2特异性小干扰RNA(si-STX2)转染到A549和H1299中。本课题组证实转染后,STX2的表达水平降低(A549:si-STX2-1vs.si-NCP=0.000,si-STX2-2vs.si-NCP=0.003,si-STX2-3vs.si-NCP=0.034;H1299:si-STX2-1vs.si-NCP=0.000,si-STX2-2vs.si-NCP=0.000,si-STX2-3vs.si-NCP=0.034,图2A)。接下来,本课题组研究了表达低水平STX2在NSCLC细胞增殖和迁移中的作用。本课题组发现下调的STX2可以促进A549和H1299细胞的活性和增殖能力。用CCK8检测细胞活性,与对照组相比,STX2下调显著促进A549和H1299细胞的细胞活性(A549:24 h,si-NCvs.si-STX2P=0.047,48 h,si-NCvs.si-STX2P=0.003,72 h,si-NCvs.si-STX2P=0.003;H1299:24 h,si-NCvs.si-STX2P=0.039,48 h,si-NCvs.si-STX2P=0.003,72 h,si-NCvs.si-STX2P=0.000,图2B)。平板克隆实验结果表明STX2下调可以促进A549和H1299的细胞增殖(A549:si-NCvs.si-STX2P=0.005;H1299:si-NCvs.si-STX2P=0.005,图2C)。用Transwell检测其迁移和侵袭能力,与对照组相比,STX2下调显著促进A549和H1299细胞的迁移和侵袭能力(A549 Migration:si-NCvs.si-STX2P=0.000,Invasion:si-NCvs.si-STX2P=0.043;H1299 Migration:si-NCvs.si-STX2P=0.000,Invasion:si-NCvs.si-STX2P=0.000,图2D)。

*P<0.05,**P<0.01,***P<0.001。
2.3 下调STX2可以促进增殖相关蛋白CDK2的表达、促进MMP-2、MMP-9的表达水平和上皮细胞间质化 CDK2是经典的增殖相关蛋白;基质金属蛋白酶2(MMP-2)和基质金属蛋白酶9(MMP-9)是降解IV型胶原的主要酶,它被证明与肺癌的发生发展密切相关;上皮间充质转化(EMT)在肿瘤细胞转移过程中起着重要作用,已被广泛认识。因此,本课题组用si-STX2处理A549和H1299细胞,用Western blot检测CDK2、MMP2、MMP9和E-cadherin的蛋白水平。本课题组发现与对照组相比,下调STX2组可以显著促进CDK2、MMP-2、MMP-9的表达水平以及降低E-cadherin的表达水平(A549,E-cadherin:si-NCvs.si-STX2P=0.006,MMP2:si-NCvs.si-STX2P=0.000,MMP9:si-NCvs.si-STX2P=0.000,CDK2:si-NCvs.si-STX2P=0.029;H1299,E-cadherin:si-NCvs.si-STX2P=0.000,MMP2:si-NCvs.si-STX2P=0.000,MMP9:si-NCvs.si-STX2P=0.000,CDK2:si-NCvs.si-STX2P=0.000,图3)。
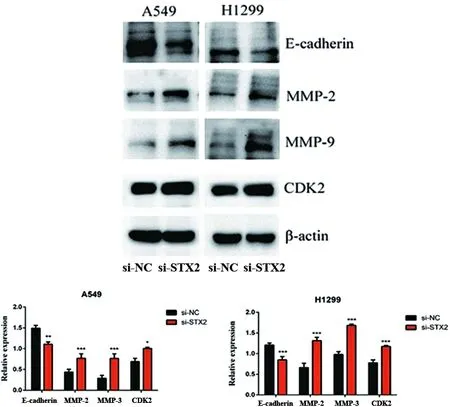
*P<0.05,**P<0.01,***P<0.001。
2.4 下调STX2影响JNK信号分子的磷酸化水平 JNK信号分子在肿瘤的发生发展过程中起着很重要的作用,与肿瘤的恶性增殖、侵袭和迁移密切相关。因此,本课题组研究了si-STX2能否影响JNK的磷酸化水平。结果显示在A549和H1299细胞中si-STX2与si-NC相比,si-STX2组显著促进JNK的磷酸化水平。此外,JNK的总蛋白水平变化差异无统计学意义(A549,P-JNK:si-NCvs.si-STX2P=0.000;H1299,P-JNK:si-NCvs.si-STX2P=0.005,图4)。这些结果提示si-STX2可以通过激活JNK的磷酸化水平促进NSCLC细胞的增殖、迁移和侵袭。
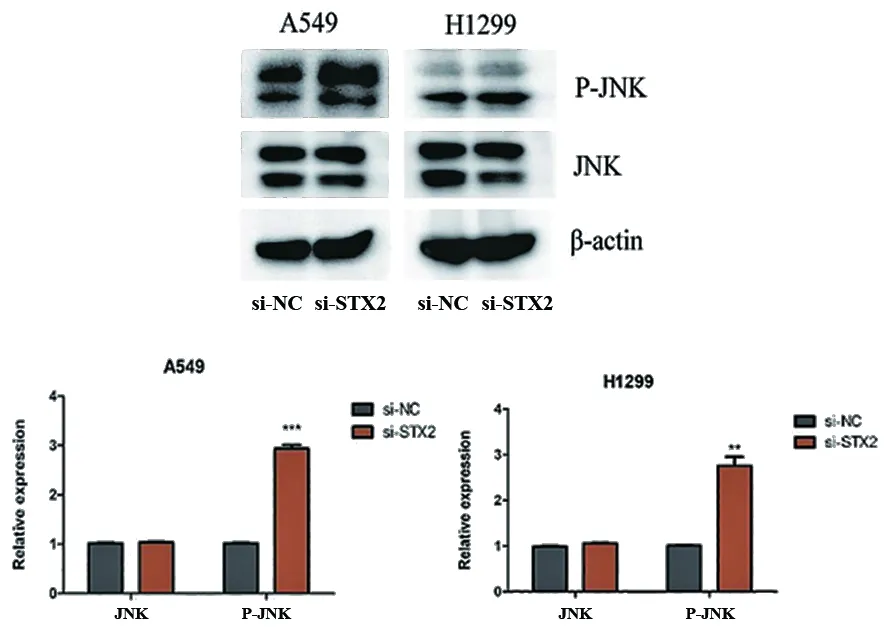
**P<0.01,***P<0.001。
3 讨论
STX2是突触融合家族的重要成员,并且高度保守。已有报道STX2在癌症中的作用[16]。然而,这些发现并没有深入地去探讨STX2所参与的分子机制,这表明STX2在肿瘤发生和癌症发展中的作用仍然知之甚少。因此,在本研究中本课题组主要探究STX2对肺癌的生物学功能的影响和其所参与的分子机制。抑制肿瘤细胞的增殖、迁移和侵袭是肿瘤治疗的重要策略。因此在本研究中,本课题组主要探讨了STX2对NSCLC增殖、迁移和侵袭的影响,并探讨其可能的分子机制。
本研究中,本课题组从TCGA和GEO 数据库中分析NSCLC中的基因差异性表达,并且发现STX2在肺癌组织中的表达与正常组织相比表达下调。RT-qPCR结果表明STX2在NSCLC细胞与正常支气管上皮细胞相比是低表达的。本课题组还发现将STX2在NSCLC细胞系中表达下调后,促进了NSCLC细胞增殖,同时促进了NSCLC细胞的迁移、侵袭能力。实验结果说明STX2可以影响NSCLC的增殖、迁移和侵袭等生物学功能。CDK2是重要的细胞增殖相关蛋白,与肿瘤的发生密切相关[17]。基质金属蛋白酶(MMPs)已被认为与癌症的增殖、侵袭等生物学功能密切相关[18]。E-cadherin在癌症中表达改变标志着癌细胞的恶性特性,比如侵袭行为[19]。为了研究STX2对NSCLC细胞增殖、迁移和侵袭的影响机制,本课题组将STX2在NSCLC细胞系A549和H1299中下调处理后,Western blot检测NSCLC细胞系A549和H1299中CDK2、MMP-2、MMP-9以及E-cadherin的表达,本课题组发现STX2下调后CDK2表达水平升高,MMP-2和MMP-9表达水平也上升,EMT标志物中的E-cadherin表达水平降低。
JNK信号分子(c-Jun氨基末端激酶,c-Jun N-terminal kinase)又被称为应激活化蛋白激酶,是哺乳类细胞中丝裂原活化蛋白激酶信号通路的一类。它在细胞增殖、凋亡和应激等多种生理和病理过程中起重要作用,也在肿瘤的发生发展过程中起着很重要的作用[20-21]。为了确定STX2是否影响NSCLC细胞的JNK信号分子,本课题组检测了其表达这种信号分子的磷酸化水平,将siRNA-STX2转染到细胞内,用Western blot检测JNK总蛋白和磷酸化水平,观察到STX2的敲低可以通过JNK信号分子的激活,促进JNK的磷酸化的表达,但是JNK总蛋白水平没有变化。JNK及其家族其他信号分子是否参与STX2对NSCLC细胞的抑癌作用我们尚不清楚。下一步,我们将进一步分析研究STX2/JNK信号分子对NSCLC的影响。
综上所述,本研究结果表明,敲低STX2可以激活JNK信号分子促进NSCLC细胞的CDK2以及MMPs和EMT标志物的表达,从而促进NSCLC细胞的增殖和迁移,为其抗肿瘤活性提供了新的见解,为STX2可能作为肺癌治疗的生物标记物和治疗靶点提供了理论支持。
