二甲双胍调节骨质疏松大鼠颌骨BMSCs成骨分化的机制研究
2021-10-15嵇步云张银昌林家婷
嵇步云,张银昌,万 媛,林家婷
(1.皖南医学院第一附属医院 弋矶山医院 a.口腔科;b.关节外科,安徽 芜湖 241001;2.皖南医学院 口腔医学院,安徽 芜湖 241002)
目前,种植牙技术具有很高的成功率,但是仍有些患者因为骨整合不良等原因导致种植体脱落,这可能与种植体周围可获得的骨质和骨量有关[1]。全身性骨质疏松相关的骨代谢疾病,增加了骨愈合延迟的风险[2],导致骨微结构损坏,骨量减少,活性氧生成增加,成骨细胞功能障碍、生存能力和增殖能力显著降低等[3]。
大量流行病学和临床试验研究表明,二甲双胍可促进人骨髓细胞向成骨细胞分化[4]。实验表明二甲双胍可刺激成骨细胞相关的Runx转录因子2(Runx2)和骨保护素表达,抑制糖基化终产物和细胞内氧化应激的产生,从而在临床上提高种植牙的成功率[5]。然而,二甲双胍对骨质疏松大鼠颌骨间充质干细胞(bone mesenchymal stem cells,BMSCs)向成骨细胞转化的潜在机制仍不清楚。
本研究旨在体外构建骨质疏松大鼠颌骨BMSCs细胞模型基础上,通过研究对比二甲双胍作用于BMSCs后,细胞增殖能力、抗衰老能力和成骨分化能力等的变化,为临床骨质疏松患者牙周治疗和种植牙手术的局部用药提供新思路。
1 材料与方法
1.1 实验材料及实验试剂 12周龄雌性SD大鼠20只,体质量约(240±10)g,分为对照组[去卵巢(ovx)]和用药组[去卵巢 +50 mmol/L二甲双胍(ovx+met)] ,每组10只。购于南京医科大学动物研究所;DMEM低糖培养基(美国Gibco有限公司);胎牛血清(美国Hyclone有限公司);二甲双胍(美国Sigma有限公司);Nanog(美国Abcam有限公司);SOX2(美国R&D有限公司);OCT3/4(美国Santa Cruz有限公司);P16(武汉三鹰有限公司);P21(武汉三鹰有限公司);P53(武汉三鹰有限公司);Runx2(Cell Signal公司);ALP(美国Abcam公司);GAPDH(美国Bioworld公司);山羊抗兔IgG(北京中杉金桥有限公司)和山羊抗小鼠IgG(北京中杉金桥有限公司)。
1.2 实验方法
1.2.1 二甲双胍溶液的制备 将5 mg二甲双胍溶解在1 mL PBS中,将溶液用膜过滤并用PBS稀释至50 mmol/L终浓度,用于后续实验。
1.2.2 骨质疏松大鼠造模 采用10%水合氯醛按照0.3 mL/100 g的浓度行SD大鼠腹腔麻醉,手术线结扎后切除卵巢,按照同样的方法完成对侧卵巢切除手术。
1.2.3 细胞培养与处理 处死大鼠断头后取下颌骨,剥除下颌骨上的肌肉和肌腱,将骨髓冲洗入15 mL的离心管,反复3次。离心,弃上清,加入含4 mL培养液的大皿中,移入孵育箱,每隔3 d换液1次。每组实验重复3次。
1.2.4 胞内活性氧(reactive oxygen species,ROS)测定 将BMSCs爬片,待爬满盖玻片后,加入1 mL稀释后的DCFH-DA,37℃乏氧细胞培养箱内孵育30 min,行正置荧光显微镜观察阳性细胞。
1.2.5 BMSCs增殖能力的测定 取第3~4代BMSCs消化、离心,按照5.0×103的细胞密度接种于96孔培养板内。待BMSCs贴壁1、3、5、7 d后取出96孔板,每孔加入10 mL细胞计数kit-8试剂盒(cell counting kit-8,CCK-8)溶液,37℃、5%CO2孵育箱孵育4 h后,利用酶标仪测定450 nm处的吸光度值。
1.2.6 细胞衰老相关的β-半乳糖苷酶染色技术(senescence-associated β-galactosidase,SA-β-Gal)染色 将BMSCs以5×104/孔的密度接种在12孔板中,培养过夜。后用PBS洗涤,β-半乳糖苷酶染色溶液于37℃条件下孵育16 h,行倒置显微镜观察阳性细胞,并计数。
1.2.7 成骨诱导 将BMSCs接种到12孔板中(5.0×104个细胞/孔),当细胞生长到80%时,将ovx组和ovx+met组培养基换成成骨诱导液,第14天后行2%茜素红S(pH 4.2)染色10 min,并在光学显微镜下观察钙化结节。
1.2.8 Western blot蛋白印迹实验 将ovx组和ovx+met组BMSCs接种于6孔板中培养7 d,后提取总蛋白,曝光机曝光。
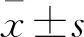
2 结果
2.1 二甲双胍对骨质疏松大鼠颌骨BMSCs胞内ROS的影响 在体外缺氧和无血清(hypoxia and serum deprivation culturing conditions,H/SD)培养条件下,骨质疏松大鼠颌骨BMSCs胞内ROS生成增加,50 mmol/L二甲双胍刺激6 h后,胞内ROS水平下降。实验结果显示,与ovx+met组相比,ovx组的ROS细胞呈亮绿色;且二甲双胍改善骨质疏松大鼠颌骨BMSCs胞内ROS水平增高(P<0.01)(图1)。
标尺=100 μm,n=3,每个值代表mean±SD;**P<0.01。
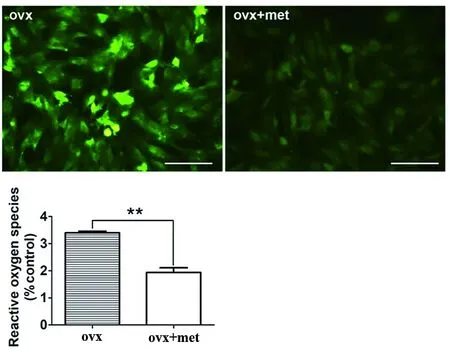
2.2 二甲双胍对骨质疏松大鼠颌骨BMSCs增殖能力的影响 本实验将第3~4代大鼠颌骨BMSCs以5×103/孔的密度接种于96孔细胞培养板内,ovx+met组加入50 mmol/L二甲双胍培养液,37℃、5%CO2培养至第1、3、5、7天取出,CCK-8试剂盒检测细胞增殖能力。结果显示,ovx+met组自第3 d起BMSCs增殖能力均强于ovx组(P<0.001)(图2A)。同时,将大鼠颌骨BMSCs以5×104/孔的密度接种于6孔细胞培养板,待细胞生长至70%~80%后,在ovx+met组加入50 mmol/L二甲双胍溶液,7 d后提取总蛋白,Western blot蛋白印迹技术检测BMSCs的Nanog、SOX2和OCT4干性因子的表达。结果显示,ovx+met组Nanog、SOX2和OCT4干性因子表达水平均较ovx组上调(P<0.01)(图2B)。
A.酶标仪检测颌骨BMSCs在不同时间点,450 nm处的吸光度值;B.Western blot蛋白印迹技术检测大鼠颌骨BMSCs中Nanog、SOX2和OCT4干性因子的表达,以GAPH为内参,n=3,每个值代表mean±SD;**P<0.01,***P<0.001。
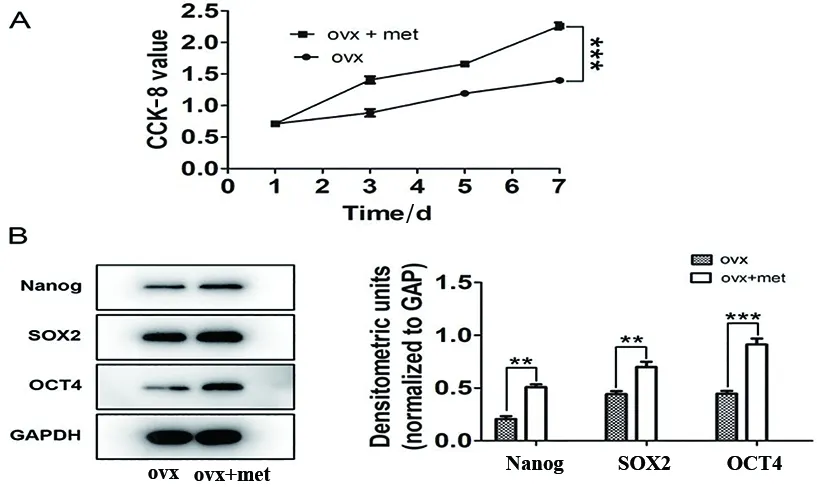
2.3 二甲双胍对骨质疏松大鼠颌骨BMSCs衰老的影响 倒置显微镜观察50 mmol/L二甲双胍刺激后,ovx+met组BMSCs衰老细胞(蓝染细胞)少于ovx组(P<0.05)(图3A)。同时,本实验利用Western blot蛋白印迹技术检测加入二甲双胍后BMSCs的衰老因子的表达情况。待第3~4代BMSCs细胞生长至70%~80%后提取总蛋白,Western blot蛋白印迹技术检测P16、P21和P53蛋白表达。结果显示,ovx+met组衰老因子P16、P21和P53的表达均较ovx组下调(P<0.01)(图3B)。
A.SA-β-Gal实验检测加入二甲双胍后,倒置显微镜观察ovx+met组骨质疏松大鼠BMSCs的蓝染细胞;B.Western blot蛋白印迹技术检测50 mmol/L二甲双胍逆转骨质疏松大鼠颌骨BMSCs衰老(标尺=100 μm,n=3;*P<0.05,**P<0.01,***P<0.001)。
2.4 二甲双胍对骨质疏松大鼠颌骨BMSCs的成骨分化能力的影响 茜素红染色技术提示,成骨诱导液培养14 d后,光学显微镜下观察,50 mmol/L二甲双胍刺激后,骨质疏松大鼠颌骨BMSCs胞内钙化结节着色范围大,颜色深,ovx组BMSCs胞内钙化结节着色范围小。实验结果显示,ovx+met组BMSCs成骨分化能力强于ovx组(P<0.05)(图4)。

标尺=100 μm,n=3,*P<0.05。
2.5 二甲双胍对骨质疏松大鼠颌骨BMSCs成骨分化因子的表达影响 本实验将第3~4代大鼠颌骨BMSCs细胞以5×104/孔的密度接种于细胞培养板内,ovx+met组加入50 mmol/L二甲双胍培养液,37℃、5%CO2培养至第7天取出,Western blot 蛋白印迹技术检测细胞成骨分化因子Runx2和ALP的表达能力。实验结果显示,ovx+met组BMSCs成骨分化因子的表达水平均高于ovx组(P<0.01)(图5)。
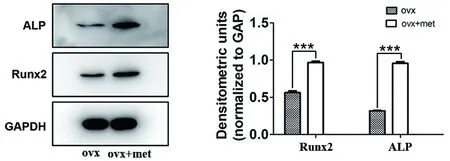
Western blot蛋白印迹技术检测大鼠颌骨BMSCs中Runx2和ALP的表达,以GAPH为内参(n=3,***P<0.001)。
3 讨论
越来越多的证据表明二甲双胍对葡萄糖和脂质代谢具有有益作用,并且取得良好的治疗指数和安全性[6]。有研究证实,将1%二甲双胍凝胶局部输送到牙周袋中,可显著改善牙周袋的探诊深度和临床附着水平[7],说明二甲双胍能渗透到骨组织中并保持一定的浓度,从而发挥成骨作用。
有研究证实,壳聚糖基二甲双胍在体外可增强抗菌活性,改善牙槽骨特性[8]。二甲双胍作用于骨的机制可能通过AMPK信号传导来改善骨形成[9]。作为AMPK信号的激动剂,二甲双胍可通过增加细胞内成骨因子如Runx2的表达,直接和间接增强细胞代谢,促进细胞成骨[10]。二甲双胍减少细胞内ROS的产生并逆转高糖下AGEs对成骨细胞的有害作用[11],还可以防止氧化应激对成骨细胞在内的许多组织和细胞的改变[12]。
在体外,本研究利用全骨髓贴壁培养法提取骨质疏松大鼠和正常大鼠颌骨BMSCs,构建BMSCs增殖、衰老和矿化成骨等细胞模型,研究二甲双胍对颌骨BMSCs的作用机制。
在H/SD培养条件下,50 mmol/L二甲双胍作用于BMSCs后,正置荧光显微镜下可见ovx+met组大鼠颌骨BMSCs胞内ROS水平下降(P<0.001)。CCK-8实验结果显示自第3天起二甲双胍培养的BMSCs(ovx+met组)增殖能力强于全培养液培养的BMSCs(ovx组)。Western blot蛋白印迹技术验证二甲双胍上调大鼠颌骨BMSCs胞内Nanog、SOX2和OCT4干性因子的表达(P<0.01)。
在体外对两组BMSCs进行SA-β-Gal试剂盒检测,进一步验证二甲双胍抗衰老的实验假设,培养液中加入二甲双胍后,BMSCs衰老细胞(蓝染细胞)少于普通培养液培养的BMSCs的ovx组。
本研究使用成骨矿化诱导液培养BMSCs 14 d后,ovx+met组BMSCs着色范围很大,说明在体外,使用现配制的矿化诱导液后,BMSCs具有向成骨细胞分化的能力,符合BMSCs具有多向分化的特性。Western blot蛋白印迹技术从蛋白水平验证了我们的假设,这与茜素红实验结果一致,具有可信性。具体机制可能有:①二甲双胍通过降低ROS水平来促进BMSCs年轻化,向成骨细胞分化;②二甲双胍可增加BMSCs的干细胞数量,表明二甲双胍通过增加BMSCs的增殖和抗衰老能力间接介导成骨作用[13];③二甲双胍可直接促进BMSCs的成骨分化[14]。因此二甲双胍相关的成骨作用增加是个多途径的过程。
本研究结果表明:在体外,二甲双胍可通过降低胞内ROS,促进增殖和抗衰老,调节骨质疏松大鼠颌骨BMSCs向成骨细胞分化,这项研究有助于我们进一步了解二甲双胍在口腔临床中的潜在应用价值,但二甲双胍作用于BMSCs的具体机制尚需进一步研究。
