蒽环类药物所致心脏毒性的研究进展
2021-10-15彭韵朴综述周珏珉审校
彭韵朴 综述 周珏珉 审校
遂宁市中心医院心内科,四川 遂宁 629000
蒽环类药物(anthracyclines,ANT)是一类来源于波赛链霉菌青灰变种(Streptomyces peucetius var.caesius)的化疗药物,于20世纪60年代应用于临床,至2012年成为全球应用最广泛的化疗药物之一,至今仍用于许多实体癌和血液恶性肿瘤的基础治疗。不幸的是,ANT 被认为是诱导心脏毒性的罪魁祸首[1-3],于1967 年首次发现,病理表现为动力减退型心肌病,最终可导致进行性心力衰竭。现从作用机制、发生率、危险因素、分类、诊断、治疗和有效的预防措施等方面对ANT引起的心脏毒性进行综述。
1 作用机制
ANT心脏毒性的发病机制尚未明确,可能与活性氧自由基(ROS)、铁代谢和钙信号等有关。ANT 通过酶作用、氧化还原反应和形成铁配合物等途径诱导产生ROS,氧化应激系统的活化和ROS的积累导致线粒体损伤、微粒体脂质过氧化,心肌细胞超微结构改变,最终引起心肌细胞不可逆损伤。ANT 还会诱导促炎症细胞因子和肿瘤坏死因子(TNF)的过度表达,引起心脏组织的炎症反应,从而增加心脏毒性。细胞凋亡被认为是ANT 引起心脏毒性的最直接的原因,ANT可直接激活转录因子,上调肿瘤细胞Fas基因的表达、下调Bcl-2基因表达,增强p53蛋白表达启动细胞凋亡程序,使得心肌细胞内铁和过氧化氢进一步沉积,最终导致心力衰竭[4]。
由于心脏组织缺少过氧化氢酶,抗氧化活性较弱,而且心肌细胞富含线粒体,是产生ROS的根源,因此心肌细胞被认为是ANT 心脏毒性的主要靶点细胞。最新研究表明其他类型的细胞,如心脏祖细胞、心脏成纤维细胞和内皮细胞等也是潜在的细胞靶点,从而使发病机制更加复杂,见图1[5]。
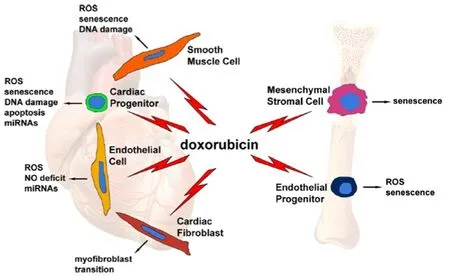
图1 阿霉素的几种靶细胞
2 分类
ANT 心脏毒性分为三类:急性,单次服药或单程治疗后14 d 内出现,通常是可逆的;早发型慢性,1 年内出现,主要表现为扩张性低动力心肌病,伴随进展性心力衰竭;迟发型慢性,治疗结束后数年甚至数十年出现。两种慢型是不可逆转的,预后差,心衰治疗受限。此分类方法可追溯至20 世纪80 年代早期,主要是基于一些儿童癌症患者出现心力衰竭症状的小规模回顾性研究[6-8]。
最新研究表明ANT 的心脏毒性可能是一种持续的现象,从心肌细胞水平开始,随后发展为进行性功能衰退,最后导致明显的心力衰竭。目前认为心脏毒性可能在ANT首次暴露时就出现了,临床表现可能在初始损伤的几年后出现[9-10]。根据症状,确诊需要数年时间(“晚期”心脏毒性);依据LVEF 降低,确诊需要数月(“早期”心脏毒性);根据生物标志物,如肌钙蛋白,可以迅速确定心脏毒性,即“急性”表现。因此,观察到的可能是同一现象的不同演变阶段,而不是三种不同疾病。
3 发病率和危险因素
ANT引起心力衰竭的风险随着累积剂量的增加而增加:剂量为400 mg/m2时概率为3%~5%,700 mg/m2时可达18%~48%[4]。不同患者具有不同的风险水平:年龄在5岁以下或65岁以上、之前或现在接受过胸部照射、有心脏病史(如心力衰竭,无症状左心室功能障碍,冠心病,中度和重度心脏瓣膜病伴左心室肥厚/左心室功能障碍,限制性扩张型/肥厚性梗阻型心肌病,高血压性心脏病伴左心室肥厚,严重心律失常等)或已知心血管危险因素(包括动脉高血压,糖尿病和高胆固醇血症等)的患者的风险增加。此外,如有吸烟、高酒精摄入、久坐不动以及肥胖等不良生活方式,蒽环素与其他药物联用,尤其是曲妥珠单抗,可能会导致心脏毒性的发生率增加[11-12]。
4 诊断标准
ANT心脏毒性的诊断标准60年来基本未变,始终依据心力衰竭症状,后来也可以根据LVEF 的下降情况(超声心动图或多门采集扫描)。标准定义为LVEF绝对值下降超过10%,或与基线相比下降<50%[5]。PLANA 等[13]认为应定义为LVEF 下降>10%,且终值<53%。由于心脏损害可能是不可逆的,基于有症状或无症状的LVEF 下降进行诊断可能会造成病情延误,还可能影响有效预防。
5 治疗
过去认为ANT 引起的心脏毒性不可逆,确诊后2年内的死亡率高达60%。最新研究表明心脏毒性并非不可逆转,但可逆性与时间相关,取决于早期诊断和及时治疗。因而迫切需要能够早期识别心脏毒性的检测方法,以及可以预防左心室功能障碍发生、发展的方法。
有文献对血管紧张素转换酶(ACE)抑制剂和β受体阻滞剂的疗效进行了前瞻性评估[14]。ANT 化疗后密切监测LVEF,几乎所有(98%)心脏毒性患者在12个月随访时出现心脏毒性。大多数病例(82%)早期使用ACE抑制剂(依那普利)和β受体阻滞剂(卡维地洛或比索洛尔),可以使心脏功能正常化,但是只有11%的LVEF正常化的患者能够完全康复,即LVEF值恢复至化疗前水平,最终71%的患者的LVEF值仍低于基线值。
6 检测方法
如今可在早期心力衰肌竭症状以及LVEF无症状下降出现之前检测到心脏毒性,主要包括肌钙蛋白、组织多普勒超声心动图和应变。
6.1 肌钙蛋白测定肌钙蛋白(TnI)是不同原因/病因引起的心肌损伤和心脏毒性的金标准生物标志物,能够预测左心室功能不全的发展和受损程度,评估ANT治疗后心脏风险分层,鉴别高危表型并指导预防治疗。与成像方法相比,具有特异性强、灵敏度高、方便有效、成本低、可变性因素少等优点;缺点是方法未完全标准化,需要反复测定肌钙蛋白和确定理想检测时间等。在一项包括703例癌症患者的大规模临床研究中,于化疗前和化疗后72 h (早期TnI)以及化疗后1 个月(晚期TnI)检测患者的肌钙蛋白I (TnI),发现三种肌钙蛋白释放模式:72%的患者肌钙蛋白I保持在正常范围内,21%患者仅在早期检测时升高,9%的患者在早期和晚期检测时均升高[15]。TnI 阳性患者具有较高的心脏不良事件(MACE)发生率:尤其是严重的心功能不全,而与TnI 短暂升高的患者相比,TnI 持续升高患者的MACE发生率更高(P<0.001)。
6.2 其他生物标志物利钠肽( 脑钠肽和N-末端原脑利钠肽)阳性的患者更易发生心脏事件(包括心功能不全)[16-18]。对其他生物标志物包括微核糖核酸(miRNAs)、C反应蛋白(CRP)、生长分化因子-15(GDF-15)、髓过氧化物酶(MPO)和半乳糖凝集素-3(Gal-3)[19-20]。KY 等[21]在接受相同抗癌治疗方案的乳腺癌患者中试验了多种标记物方法,当ANT治疗结束时,只有TnI绝对值、TnI及MPO水平的变化值能够作为左室功能障碍进一步发展的预测指标。
6.3 组织多普勒和应变超声心动图超声心动图技术为早期发现心脏毒性的有效手段,尤其是组织多普勒和应变成像技术。心肌变形(应变成像)能够灵敏地预测早期心肌功能障碍,特别是2D (以及最近的3D)散斑跟踪成像技术,能够评估整体心肌纵轴变形(整体纵向应变,GLS,%),已经成为临床诊断标准。有文献证实了GLS 在亚临床心肌功能障碍检测方面的价值,表明GLS与癌症患者明显的左室功能障碍的预后相关[22-25]。美国超声心动图学会(ASE)和欧洲协会心血管影像协会(EACVI)推荐将GLS 相对基线降低>15%定义为亚临床LV功能障碍的指标,运用多模态成像技术监测化疗患者的标准[26]。
6.4 生物标志物与心脏成像的联用随着实验室技术的不断突破,肌钙蛋白的特异性和灵敏度越来越高,能够检测出以往方法无法检测到的生物标志物(高精[HS]剂量系统)[27]。国际和地区惯例联合应用组织多普勒应变成像和肌钙蛋白法,每3 个月定期检查基线,进行心肌功能检测。纵向应变降低和HS 肌钙蛋白升高可预测ANT治疗后的晚期左室功能不全,两者联用可提高方法的特异性。
7 预防
7.1 使用对心脏毒性较小的蒽环类似物临床上常用的蒽环类药物有柔红霉素、多柔比星、吡柔比星、伊达比星、戊柔比星以及米托蒽醌等。1963年,柔红霉素首先被合成,立即被应用于血液系统恶性肿瘤等疾病的治疗。1968年,多柔比星问世,对RNA的抑制作用最强,抗瘤谱最广。吡柔比星、表柔比星与多柔比星相比,其疗效相当,心脏毒性更低。在临床前研究和动物模型中,伊达霉素和米托蒽醌的心脏毒性均比多柔比星低。
7.2 使用ANT脂质体由于心脏毛细血管紧密相连,脂质体无法透过血管,因而在心脏细胞中蓄积有限,从而降低心脏毒性风险。相反,脂质体在肿瘤部位浓度较高,使肿瘤生长的毛细血管循环系统遭到破坏[28-29]。
7.3 生活方式及行为治疗癌症和心血管危险因素之间关系密切,因而纠正吸烟、久坐习惯(可能导致肥胖,尤其是对绝经后妇女有害)以及高酒精摄入至关重要。健康的饮食对癌症复发和心血管疾病具有保护作用,而吸烟的危害作用尚不清楚。虽然轻度到中度的酒精摄入对心血管疾病具有保护作用,但却是心脏毒性的风险因素[30-31]。另外,有证据表明有氧运动训练对心脏毒性有保护作用,散步、自行车锻炼等有效性研究提示锻炼强度越大获益越大,但不推荐精疲力竭式强度锻炼[32]。
7.4 使用心脏保护剂右唑嗪与ANT合用时是一种有效的心脏保护剂,不会降低抗肿瘤疗效或生存率,也不会增加第二原发性恶性肿瘤的风险,特别是对儿童和青少年患者,对其预后有重要影响[33]。其他一些潜在的心脏保护剂正处于动物模型和小型临床试验研究阶段,初步数据显示有希望,但仍需要深入研究[2,5]。
7.5 使用心血管药物
7.5.1 β受体阻滞剂非心脏选择性β受体阻滞剂卡维地洛对ANT 具有心脏保护作用。体外研究和一项小型临床随机试验表明卡维地洛能够防止心室功能障碍[34]。卡维地洛和阿替洛尔(选择性β1拮抗剂,不具有抗氧化作用)的比较研究表明,卡维地洛可防止阿霉素相关的线粒体损伤,减少超微结构变化,而阿替洛尔不能[35]。尼比洛尔是一种具有血管舒张功能的选择性β1拮抗剂,27 例乳腺癌患者在ANT 化疗前7 d开始用药,连续用药6 个月,可防止LVEF 显著降低以及NT-proBNP 显著升高。现有临床前研究数据表明心脏特异性β受体阻滞剂比非心脏特异性具有更好的心脏保护作用[11]。
7.5.2 血管紧张素转换酶抑制剂和沙坦类药物肾素-血管紧张素系统(RAS)在ANT 心肌病的发生、发展中起关键作用[36]。缬沙坦与ANT 联合应用,能够降低多柔比星治疗的非霍奇金淋巴瘤患者的排尿肽升高程度,并防止房室容积增大[37]。表阿霉素化疗前使用替米沙坦,能够有效防止应变减少和炎症标记物增加[38]。“辅助性乳腺癌治疗期间预防心脏功能障碍”(PRADA)试验发现坎地沙坦(而非美托洛尔)与包含ANT在内的辅助化疗(含或不含曲妥珠单抗)联用,可防止早期LVEF下降[39]。MANTICORE-101试验(肿瘤心脏病学多学科新疗法)比较了培哚普利与比索洛尔在预防先给予ANT 化疗再采用曲妥珠单抗治疗的HER2+乳腺癌患者的左心室重构(定义为舒张末期直径和主要研究点的增加)以及左心室功能障碍方面的作用[40]。两种药物都不能阻止左心室重构;但是,多变量分析发现左心室功能保得以保留与两种药物有关。
7.5.3 醛固酮拮抗剂一项随机试验对43 例乳腺癌患者采用螺内酯与安慰剂治疗进行了研究。在ANT化疗前1周开始使用螺内酯,化疗结束后3周,治疗组的左室射血分数无明显变化,肌钙蛋白I 和NT-proBNP无明显升高[41]。一项随机安慰剂对照试验研究了依普利酮对ANT 化疗乳腺癌患者的左心室舒张功能的影响,用药6个月后,对照组的心室功能与安慰剂组无显著差异[42]。
7.5.4 他汀类药物他汀类药物对ANT 心脏毒性的作用与其多效性,特别是抗氧化活性相关。40例无心脏病史的血液系统癌症患者随机分为两组,分别在ANT化疗前接受阿托伐他汀或安慰剂治疗,连续用药6 个月,他汀组的高敏C 反应蛋白水平降低,LVEF无明显变化[43]。相反,对照组的LVEF 值较基线显著降低。患者在化疗前使用他汀类药物时,心脏保护作用就已经启动了[44]。一项对67 例接受ANT 治疗的乳腺癌患者进行的回顾性研究发现,他汀类药物能显著降低随访期间心力衰竭的风险和死亡率。
8 结论
ANT 所致心脏毒性严重影响了癌症患者生活质量和整体生存率。最新研究表明:该类型的心肌病经早期发现和及时的治疗大多是可逆的。ANT 引起的心脏毒性是一种从细胞到临床阶段的、单一的、持续的现象,首先是心肌细胞损伤,然后是LVEF进行性下降,并有可能出现明显的心力衰竭。现行诊断方法(LVEF定期评估)只能在晚期发现心脏毒性,此时心脏已经发生了严重的损害,错失了有效预防和进一步治疗的机会。采用肌钙蛋白诊断亚临床心脏毒性,结合早期使用ACE 抑制剂治疗,可能是预防ANT 相关心脏不良反应的有效方法。
