铂类药物不良反应患者的严重程度及转归临床分析
2021-10-15雷彦平巴晶晶侯浪超
雷彦平,巴晶晶,侯浪超
渭南市妇幼保健院药剂科,陕西 渭南 714000
近年来恶性肿瘤的发生率呈显著上升趋势,研究显示,大多数恶性肿瘤的恶性程度较高,预后不甚理想[1]。铂类药物为目前治疗恶性肿瘤的基础药物,其抗肿瘤谱广,可抑制DNA 的转录及复制,促进肿瘤细胞凋亡,从而发挥治疗作用[2]。有研究报道,铂类药物对恶性肿瘤患者的远期生存有积极影响[3]。尽管铂类药物在恶性肿瘤治疗中有重要作用,但其作用于肿瘤细胞的同时能够破坏机体正常组织,引起程度不一的药物不良反应(adverse drug reactions,ADR)。ADR 不仅降低患者生存质量,其程度较重时可使患者疗程延迟或中断,影响治疗效果[4]。阮连军等[5]研究也指出,铂类药物的ADR较突出,多见于耳毒性、肾毒性、血液毒性及胃肠道反应。另有研究报道,抗肿瘤药物的ADR能够明显影响患者治疗依从性,并增加其心理负担[6]。目前临床有关铂类ADR 的研究较多,但结论尚未统一。本研究旨在探讨近年来我院收治的铂类ADR患者的严重程度及转归情况,提高患者临床用药的安全性。
1 资料与方法
1.1 一般资料回顾性分析渭南市妇幼保健院2017 年3 月至2020 年8 月收治的72 例铂类ADR患者就诊情况。纳入标准:首次经临床明确诊断为恶性肿瘤,有化疗指征,并接受铂类药物的化疗;心功能、肝肾功能、血常规等结果均无明显异常;无头晕、恶心、呕吐等胃肠道反应;临床信息完整。排除标准:预计生存期在6 个月内;卡氏(Karnofsky,KPS)评分低于60 分;明显恶液质或者危重患者;同时接受其他抗肿瘤药物或放疗治疗;哺乳阶段或者妊娠阶段女性。72 例患者年龄22~69 岁,平均(50.28±6.14)岁;男性39 例,女性33 例;肿瘤类型:消化系统肿瘤34 例,呼吸系统肿瘤21 例,生殖系统肿瘤9 例,乳腺癌8 例;铂类药物:顺铂30 例,卡铂9 例,奈达铂10 例,洛铂10 例,奥利沙铂13 例。
1.2 ADR 严重程度评价参照相关抗肿瘤药物不良反应分类和分级标准[7]进行,ADR分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ级,其中Ⅲ、Ⅳ级为严重不良反应。
1.3 ADR治疗方法针对铂类ADR患者的胃肠道毒性、肾毒性、血液毒性、神经毒性、过敏反应等进行对应的干预,其中Ⅰ级ADR无需治疗。疗程结束时观察ADR患者临床转归情况。
1.4 统计学方法应用SPSS20.0 软件进行数据统计学分析,计数资料采用χ2检验,当理论频数≤5时用连续校正比较,以P<0.05表示差异有统计学意义。
2 结果
2.1 铂类ADR 的发生时间铂类ADR 在用药20 min~1 d内发生率为58.33% (42/72),在用药>1~10 d内发生率为36.11% (26/72),在用药≥10 d内发生率为5.56% (4/72),其中铂类药物ADR 在用药20 min~1 d内发生率最高。
2.2 不同铂类药物的ADR发生情况比较顺铂的胃肠道毒性反应率高于卡铂、奈达铂、洛铂及奥利沙铂,差异有统计学意义(P<0.05);卡铂的血液毒性反应率高于顺铂、奈达铂、洛铂及奥利沙铂,差异有统计学意义(P<0.05);奥利沙铂的神经毒性反应率高于顺铂、卡铂、奈达铂及洛铂,差异有统计学意义(P<0.05),见表1。
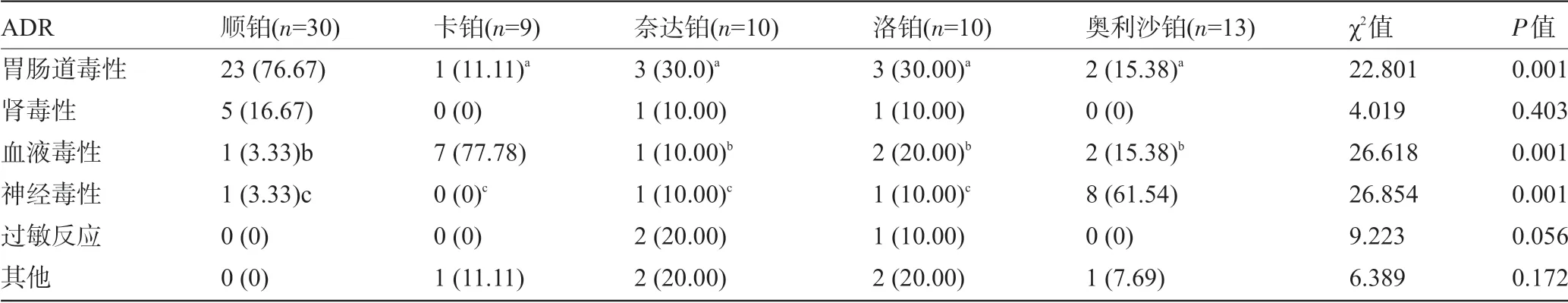
表1 不同铂类药物的ADR发生情况比较[例(%)]
2.3 铂类ADR 的严重程度比较72 例铂类ADR 中严重不良反应有3 例,其余均为一般不良反应。铂类药物ADR中胃肠道毒性反应率最高,与其他毒性反应率比较差异均有统计学意义(χ2=54.400,P=0.001<0.05),见表2。

表2 72例铂类ADR的严重程度比较[例(%)]
2.4 铂类ADR患者转归72 例铂类ADR 患者经对症干预后70 例患者得到痊愈或改善,有2 例患者产生了不可逆的听力受损,无患者因ADR 发生死亡。
3 讨论
恶性肿瘤为临床高发疾病,近年来其已成为危害生命安全的主要疾病之一。目前,大部分恶性肿瘤以手术治疗为主,并辅以生物靶向治疗、放化疗等综合疗法。化疗是中晚期恶性肿瘤的主要治疗手段,能够控制疾病进展,延缓肿瘤的复发及转移。铂类药物是目前抗肿瘤的代表药物,具有抗肿瘤活性高、作用强、高效广谱等特点[8]。但铂类药物无细胞特异性,大部分化疗药物在治疗的同时也可引起一定程度的副反应。
顺铂是铂类第一代药物,联合顺铂药物是既往治疗恶性肿瘤的常见化疗方案,但顺铂存在剂量依赖性[9]。近年来,第二代及第三代铂类药物在临床治疗中有良好的效果。卡铂及奈达铂为铂类第二代药物,化学毒性反应较顺铂轻,但卡铂的骨髓抑制反应较突出。洛铂及奥沙利铂为铂类的第三代药物,洛铂的稳定性好,水溶性高,神经毒性和肾毒性较少。奥利沙铂与卡铂、顺铂无交叉耐药,在乳腺癌、肺癌及结肠癌等治疗上均有不错效果。临床研究报道,奥沙利铂的血液毒性、肾毒性及胃肠道毒性已显著降低,但其所致的神经毒性反应较明显[10]。
相关研究指出,铂类药物能够抑制胃肠道上皮细胞,从而引起程度不一的胃肠道反应[11]。金星等[12]研究也表示,消化道反应在铂类ADR 最为常见,且多见于恶心呕吐,严重者能够发生血性腹泻。严重的恶心、呕吐为顺铂的主要限制性毒性,且多发生在用药后1~6 h内。有研究发现,卡铂、奈达铂的胃肠道刺激性较顺铂轻微,极少患者发生Ⅳ度不良反应[13]。一项研究报道,洛铂及奥利沙铂的恶心、呕吐反应率较其他铂类药物低[14]。本研究结果显示,顺铂的胃肠道反应发生率显著高于其他铂类药物,洛铂、奥沙利铂的胃肠道反应率较低。以上结果表明,新型铂类药物的胃肠道刺激反应不断减弱,安全性相应提高。
国外研究指出,铂元素能够在肾脏中沉积,产生一定程度的肾毒性[15]。顺铂在肾脏中具有高聚集、高代谢、高排泄的特点,因此其肾毒性反应较突出。统计资料报道,顺铂常规剂量可导致可逆行肾小管受损,反复大剂量应用能导致不可逆的肾功能损伤[16]。卡铂在机体存留时间相对较少,无明显的肾毒性反应。奈达铂、洛铂、奥利沙铂的肾毒性反应率较顺铂显著降低。本研究数据显示,顺铂的肾毒性反应率最高,建议肾功能不全的恶性肿瘤患者尽可能避免顺铂的使用。骨髓抑制为铂类药物最常见的血液毒性反应,表现为血小板、粒细胞及白细胞减少,且以白细胞减少最为常见[17]。顺铂及卡铂的骨髓抑制反应有明显的剂量依赖性,且卡铂的骨髓抑制反应较顺铂明显。本研究中,卡铂的骨髓抑制反应率最高,洛铂与奥利沙铂骨髓抑制率较低。铂类药物作用于癌细胞的同时对正常神经细胞有一定影响,临床出现听神经毒性、外周神经毒性和中枢神经毒性等反应[18]。有资料发现,顺铂总量大于300 mg/m2时可引起周围神经损伤[19]。另外顺铂能够影响患者高频听力,并发生耳鸣,但多为可逆性。卡铂的神经毒性反应较顺铂低,有一定蓄积作用。谷麟等[20]研究发现,奥利沙铂的神经毒性较其他铂类药物高,主要为口周和手足感觉异常、迟钝等反应。本研究中洛铂的神经毒性反应最低且最为轻微,奥利沙铂的神经毒性反应率显著高于其他铂类,和文献报道相似。同时本研究有少数铂类患者用药后发生过敏反应,不同铂类之间的过敏反应率无显著差异。
铂类药物ADR能够在用药后各个时间段发生,但不同系统对药物的代偿性和敏感性存在差异,其中胃肠道反应多在用药后1 d 内发生,骨髓存在一定代偿能力,其发生相对较晚[21]。临床用药期间需定期监测患者血尿常规变化情况,及时予以相应干预措施,纠正患者的ADR,提高药物安全性。本研究72 例铂类ADR 患者中69例为一般不良反应,严重不良反应有3例,经对症干预后70例患者得到痊愈或改善,有2例患者产生了不可逆的听力受损,无患者因ADR发生死亡。
综上所述,临床应加强对铂类药物ADR 的监测,对相关ADR进行预防和处理,提高患者用药安全。
