AIF和BNIP3在血清剥夺诱导的PC12细胞损伤和死亡过程中的变化
2021-10-15梁历廷邓玉敏刘攀赵珅婷
梁历廷,邓玉敏,刘攀,赵珅婷
(广州医科大学生理学教研室,广东 广州 510182)
虽然脑缺血在预防和治疗方面取得了重大进展,但是缺血性脑血管病仍是世界上最常见的死亡原因之一[1],已成为人类重大的健康难题。若在短时间内阻断大脑供血,会导致葡萄糖、氧气和营养素供应不足,从而造成能量供应丧失和局灶性脑缺血[2]。中枢神经系统(CNS)中的缺血往往会导致毁灭性的、不可逆转的后果,最终造成神经的结构和功能受损[3]。血清剥夺(serum deprivation,SD)是一种用来模拟脑缺血的可靠体外模型[4]。
线粒体功能障碍与细胞的损伤和死亡有关。凋亡诱导因子(apoptosis-inducing factor,AIF)是近年来发现的一种促细胞死亡效应分子,是一种定位于线粒体的膜间隙蛋白,具有氧化还原酶和诱导细胞死亡两种活性,在缺血/缺氧等不利刺激下被释放到细胞核,诱导并参与细胞的损伤和死亡过程[5]。
BNIP3为Bcl-2(B细胞淋巴瘤-2,B-cell lymphoma-2)蛋白蛋白家族成员,属于仅含有BH-3结构域的BH3-only(bcl-2 homology domain only proteins)亚族[6]。神经元细胞BNIP3的表达通常很低,但在缺氧或缺血后显著增加[7]。同时,该蛋白的跨膜区形成同源二聚体锚定在线粒体外膜发挥促细胞损伤和死亡等作用。大量的研究结果显示,在缺氧/缺血或放、化疗等外界不利条件刺激下,BNIP3可以诱导细胞发生自噬,促使细胞死亡,保证机体正常生理状态[8]。
起源于实体大鼠肾上腺髓质肿瘤的克隆系的PC12细胞已被广泛用于神经细胞的体外研究[9]。PC12细胞在体外一直是研究各种神经疾病的某些方面的优秀工具,如谷氨酸兴奋毒性[10]、癫痫[11]等,并有助于研究缺氧/缺血或放、化疗等对神经细胞存活的相关影响。
为探讨AIF和BNIP3在血清剥夺后的PC12细胞中分布和表达的变化,我们使用MTT检测血清剥夺后PC12细胞的细胞平均活力,免疫印迹法(western blot)检测AIF和BNIP3在细胞和线粒体的蛋白表达,细胞免疫荧光技术检测AIF在细胞中的分布和表达情况。
1 材料和方法
1.1 细胞系和试剂
PC12细胞(大鼠肾上腺髓质嗜铬瘤分化细胞株)(高分化)购自南方医科大学神经生物实验室。高糖DMEM培养基购自Gibco(美国),胎牛血清购自上海碧云天生物技术有限公司。MTT细胞增殖及细胞毒性检测试剂盒购自Sigma(美国)。PC12细胞置于高糖DMEM(4.5 g/L,添加10%胎牛血清和100 u/mL青霉素/链霉素中)培养。所有细胞均于37 ℃、含5%CO2的培养箱中生长。细胞种植于6孔培养板中用于细胞和线粒体蛋白提取,每孔接种的细胞数为2×106个。细胞接种于96孔板中用于细胞增殖实验,每孔接种的细胞数为4×104个。细胞接种于24孔板中用于免疫荧光检测,每孔接种的细胞数为2.5×105个。取对数生长期的PC12细胞进行实验。
1.2 SD诱导细胞损伤的实验研究
为模拟缺血条件,将PC12细胞置于无血清的高糖DMEM中(4.5 g/L,添加100 U/mL青霉素和100 U/mL链霉素培养)分别培养6、12、24、48 h[4]。
1.3 细胞总蛋白的提取
PC12细胞加入裂解液并添加蛋白酶抑制剂混合物(PIC)(ThermoFisher Scientific,#RG235174),磷酸酶抑制剂混合物(PHIC)(APExBIO Technology LLC,#K1012)和苯甲基磺酰氟(PMSF)(APExBIO Technology LLC,#A2587)。冰上裂解5 min,100 ℃沸水中煮5 min,分装并冻存于-80 ℃。
1.4 细胞线粒体蛋白的提取与纯化
用胰酶消化PC12细胞并1 300 r/min离心10 min。弃上清,加入0.25 mM/L蔗糖溶液悬浮细胞。用匀浆器放置于冰上匀浆20秒3次。冷冻离心机中5 000 r/min离心10 min,将上清转移至干净的离心管中。取上清一滴置于载玻片上,并用0.02%詹纳斯绿B染液,镜下观察线粒体呈蓝绿色棒状颗粒。冷冻离心机中12 000 r/min离心10 min。弃上清,加入蛋白裂解液,冰上裂解5 min,100 ℃沸水中煮5 min,分装并冻存于-80 ℃。
1.5 细胞增殖实验
将MTT染色液和无血清培养基以1∶10的比例均匀混合,每孔加入100 μL,置于37 ℃培养箱中避光培养4 h。取出培养板,每孔加入100 μL的formazan溶解液,在振荡器上振荡混匀,让还原产物充分溶解。置酶联检测仪上测定光密度A值,检测波长570 nm。以A值计算细胞增值情况。计算公式:细胞增殖抑制率=(空白组A值-干预组A值)÷空白组A值×100%
1.6 western blot
通过BCA蛋白质测定试剂盒(Thermo Scientific Pierce,#23225)测量PC12细胞及线粒体提取物的蛋白浓度。一抗使用如下:兔抗AIF多克隆抗体(Abcam,ab1998,1∶1 000),兔抗BNIP3多克隆抗体(Boster,BA4304-2,1∶1 000),小鼠抗β-Actin单克隆抗体(Affinity,T0022,1∶10 000),兔抗COX-4多克隆抗体(Proteintech,11242-1-AP,1∶5 000)。使用辣根过氧化物酶偶联的羊抗兔IgG (H+L)(Bioworld,#BS13278,1∶5 000)和羊抗鼠IgG (H+L) (Bioworld,#BS12478,1∶5 000)为二抗。使用ImageJ软件定量蛋白质印迹带,数据以对照组的倍数表示。
1.7 细胞免疫荧光(immunofluorescence)
将细胞置于4%多聚甲醛中固定,用10%牛血清白蛋白(BSA)和0.6%Triton X-100在室温下封闭1 h。细胞核用DAPI标记。用兔抗AIF多克隆抗体(Abcam,ab1998,1∶200)孵育过夜。山羊抗兔IgG(H&L 488)(Abcam,#ab150077,1∶500)用作二抗,室温孵育2 h。荧光显微镜下采集图像。
1.8 统计分析
所有数据均以均数±标准差表示,实验采用配对t检验,P<0.05差异有统计学意义。使用Graphpad Prism 6.01软件进行统计分析。
2 结 果
2.1 PC12细胞血清剥夺模型的建立及血清剥夺过程中细胞形态学的变化
图1-A表示血清剥夺不同时间点PC12细胞的细胞平均活力。对照组为使用含10% FBS的培养基正常培养的PC12细胞。血清剥夺6 h的细胞活力为97.38%,无明显降低(P=0.120 7);血清剥夺12 h的细胞平均活力为94.02%(P=0.000 7),细胞存活率有明显降低;血清剥夺24 h和48 h的细胞平均活力分别为74.57%和52.21%,存活率均有明显降低(P=0.000 1)。

AB1.51.00.50.0对照组6h12h24h48h血清剥夺组PC12细胞活力CDEF***
用含10% FBS的培养基正常培养的细胞:细胞胞体饱满,成椭圆状,细胞贴壁良好,突触向四周延伸,形状细长(图1-B)。血清剥夺6 h后,较正常细胞胞体变大,细胞贴壁正常,突触向四周延伸但在一定程度上变短(图1-C)。血清剥夺12 h后,胞体变圆,细胞贴壁开始松散,突触变短,细胞形状呈梭形(图1-D)。血清剥夺24 h后,胞体变圆,体积减少,细胞贴壁松散,突触消失,细胞形状不规则(图1-E)。血清剥夺48 h后,胞体变圆,体积减少,细胞贴壁松散,突触消失,细胞形状不规则且出现成堆聚集现象(图1-F)。以上结果说明经PC12在血清剥夺一定时间后,出现细胞损伤和死亡现象,细胞存活率降低。
2.2 AIF蛋白在细胞中分布的变化
如图2所示,免疫荧光结果显示,当用含10% FBS的培养基正常培养PC12细胞,AIF主要分布在胞浆中,细胞核AIF蛋白分布较少。细胞核轻微皱缩,呈圆型,胞核胞浆界线分明。血清剥夺6 h后,AIF蛋白同时分布在胞浆和胞核中,呈颗粒状,AIF荧光强度稍有上调,但尚无统计学意义。且细胞核变形,呈似圆型状,胞核胞浆界线模糊。血清剥夺12 h后,AIF蛋白同时分布在胞浆和胞核中,呈颗粒状,可见AIF荧光强度上调,有统计学意义(P=0.026 9)。此时,细胞核开始变形,呈不规则状,胞核胞浆界线不清。血清剥夺24 h后,AIF蛋白同时分布在胞浆和胞核中,呈颗粒状,可见AIF荧光强度上调,有统计学意义(P=0.012 2)。细胞核已变形,呈不规则状,胞核胞浆无界线。血清剥夺48 h后,AIF蛋白同时分布在胞浆和胞核中,呈颗粒状,可见荧光强度显著上调(P=0.002 7)。细胞核已变形,呈不规则状,成堆出现,胞核胞浆无界线。

B1.51.00.50.0对照组6122448血清剥夺时间(h)荧光强度A对照组6h12h24h48hDAPIAIFMerged***
2.3 BNIP3和AIF蛋白在血清剥夺培养PC12细胞以及线粒体中表达量的变化
为探究BNIP3和AIF在血清剥夺培养PC12细胞以及线粒体中表达量的变化。如图3A,C所示,与对照组相比,全细胞AIF蛋白在PC12细胞经血清剥夺后12 h(P=0.011 8),24 h(P=0.040 2),48 h(P=0.008 5)的表达有不同程度的上调,且有统计学意义。如图3A,D所示,与对照组相比,全细胞30kD的BNIP3蛋白在PC12细胞经血清剥夺后12 h(P=0.023 0),24 h(P=0.023 7),48 h(P=0.005 2)的表达有不同程度的上调,且有统计学意义。如图3A,E所示,与对照组相比,全细胞19kD的BNIP3蛋白在PC12细胞经血清剥夺后12 h(P=0.030 9),24 h(P=0.041 7),48 h(P=0.001 7)的表达有不同程度的上调,且有统计学意义。如图3B,F所示,与对照组相比,线粒体AIF蛋白在PC12细胞经血清剥夺后12 h(P=0.012 9),24 h(P=0.003 4),48 h(P=0.009 3)的表达有不同程度的上调,且有统计学意义。如图3B,G所示,与对照组相比,线粒体30kD的BNIP3蛋白在PC12细胞经血清剥夺后6 h(P=0.010 2),12 h(P=0.003 8),24 h(P=0.003 2),48 h(P=0.000 8)的表达有不同程度的上调,且有统计学意义。如图3B,H所示,与对照组相比,线粒体19kD的BNIP3蛋白在PC12细胞经血清剥夺后6 h(P=0.023 9),12 h(P=0.000 5),24 h(P=0.000 2),48 h(P=0.002 9)的表达有不同程度的上调,且有统计学意义。
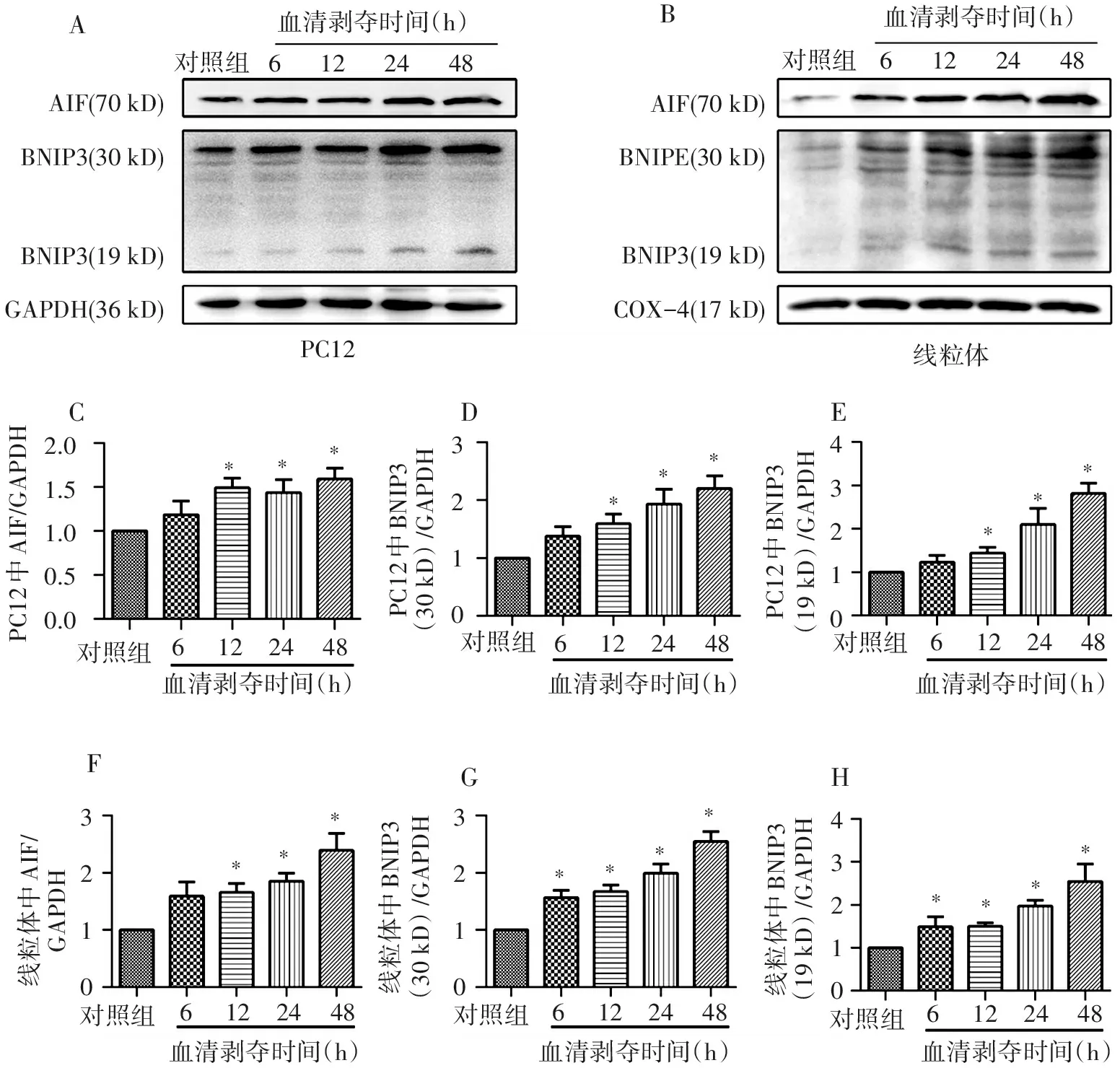
ABCDEGFHAIF(70kD)BNIPE(30kD)BNIP3(19kD)COX-4(17kD)AIF(70kD)BNIP3(30kD)BNIP3(19kD)GAPDH(36kD)2.01.51.00.50.03210321032104321043210PC12PC12中AIF/GAPDHPC12中BNIP3(30kD)/GAPDHPC12中BNIP3(19kD)/GAPDH线粒体中AIF/GAPDH线粒体中BNIP3(30kD)/GAPDH线粒体中BNIP3(19kD)/GAPDH血清剥夺时间(h)血清剥夺时间(h)血清剥夺时间(h)血清剥夺时间(h)血清剥夺时间(h)血清剥夺时间(h)对照组6122448血清剥夺时间(h)对照组血清剥夺时间(h)对照组对照组对照组对照组对照组对照组6122448612244861224486122448612244861224486122448********************线粒体
综合以上结果,我们可以得出结论:随着血清剥夺的时间加长,AIF和BNIP3(30 kD,19 kD)在PC12细胞和线粒体中的表达水平逐渐升高,在48 h达到了表达峰值。
3 讨 论
本研究结果提示,随血清剥夺时间的加长,PC12细胞出现损伤和死亡现象愈加严重,细胞的存活率变低。细胞的形态也出现不同程度改变,细胞突触逐渐消失,胞体变圆变大直至形成空泡状而死亡。AIF蛋白也随之在细胞核内分布增多。通过Western Blot实验进一步证实BNIP3和AIF在血清剥夺的PC12细胞和线粒体中表达上升。
我们的研究表明,随血清剥夺时间的加长,AIF蛋白在细胞和线粒体内表达均升高,同时在细胞核内分布增多。AIF与神经细胞死亡有关。当细胞遭遇外部刺激诱导细胞死亡信号激活后,将核信号传递给线粒体,随后,AIF通过染色质凝聚和DNA片段从线粒体释放到细胞核,介导细胞的损伤和死亡过程[12]。有研究指出,减少AIF表达在脑缺血或脑创伤模型中提供了神经保护作用,使神经元免受谷氨酸毒性的影响[13]。聚腺苷二磷酸核糖(PAR)聚合酶-1(PARP-1)/凋亡诱导因子(AIF)信号通路介导的细胞死亡是中风等神经系统疾病中广泛存在的非Caspase依赖的细胞死亡过程之一。此通路被认为是介导谷氨酸诱导的兴奋性毒性的主要机制。这一过程是由DNA损伤、PARP-1过度激活、PAR移位到线粒体,引起AIF释放增加,从线粒体移位到细胞核介导的[14]。在血清剥夺的过程中,细胞核和线粒体AIF的分布增加,有可能是此通路被激活后导致的。
我们的研究表明,随血清剥夺时间的加长,BNIP3蛋白在细胞和线粒体内表达均升高。说明BNIP3可能介导了PC12的损伤和死亡过程。BNIP3定位于细胞内不同位置,研究表明,BNIP3主要参与促进线粒体的损伤和死亡,可与线粒体结合,使线粒体发生功能障碍[15]。BNIP3是BH3-only蛋白亚家族Bcl-2蛋白的促凋亡成员的成员,Bcl-2是一种完整的膜蛋白,通过抑制蛋白外流来防止细胞损伤和死亡,其中BNIP3、Bcl-2,蛋白和BH3相互作用后介导结构域死亡激动剂从细胞质转移到线粒体膜外膜,触发细胞损伤和死亡[16]。
对于BNIP3和AIF这两种重要的诱导细胞损伤和死亡的因子在细胞死亡过程中是否共同协作或是相互作用,目前未有研究证实。许多研究集中在Caspase非依赖的凋亡途径。Lee等[17]发现,核内PARP-1蛋白过度表达导致PAR合成增加,PAR移位到线粒体,导致AIF和线粒体内切酶G(Endo G)释放,继而移位至细胞核,导致细胞死亡。先前有研究报道,BNIP3也可以通过非Caspase依赖性的方式诱导细胞死亡[18],而Endo G是BNIP3激活的神经元死亡的介质[19]。有研究表明,BNIP3可能位于AIF/Endo G的上游。若诱导线粒体BNIP3表达增强,则胞浆AIF/Endo G表达上升便转位至细胞核。沉默BNIP-3可显著抑制AIF和Endo G易位,降低细胞死亡率、细胞色素C释放、Caspase-9和Caspase-3活性[20]。
综上所述,目前的研究结果仅观察到经血清剥夺后PC12细胞发生损伤和死亡现象,AIF和BNIP3在血清剥夺的PC12细胞和线粒体中表达上升和AIF蛋白在细胞核内分布增加。但是对于BNIP3和AIF这2种因子在血清剥夺诱导损伤和死亡的过程中是否存在共同协作或是相互作用,我们还未涉猎,将会在后续的研究中重点探索血清剥夺诱导的细胞损伤和死亡过程中的具体机制。
