微波辅助无催化剂绿色高效合成2,8-二氧双环[3.3.1]壬烷衍生物
2021-10-14林俊洁杨丽娟
王 爽,吴 沁,林俊洁,杨丽娟,黄 超
(云南民族大学 化学与环境学院,生物基材料绿色制备技术国家地方联合工程研究中心,云南省高校智能超分子化学重点实验室,云南 昆明 650503)
2,8-二氧双环[3.3.1]壬烷是一种V 型刚性结构的含氧杂环分子,是天然含氧杂环化合物的常见骨架结构,如Biflavonoid,Dracoflavan D,Dracoflavan C1,Dracoflavan C2 等 (图1). 该类化合物生物活性多样,具有抗菌、抗炎、抗病毒和抗癌等活性[1-2],可以作为多种药物的先导化合物[3-5]. 目前对2,8-二氧杂双环[3.3.1]壬烷类化合物的研究主要集中于分离鉴定、合成、生物活性筛选和天然产物开发等[6-7],有关其骨架的合成方法近年来受到了有机及药物合成化学家的持续关注[8-10]. 2013年,Ganguly[11]等利用碘催化 (x=10 %),在乙醇水溶液回流条件下,实现了2-羟基查尔酮与双甲酮的有效偶联. 2013 年,Yin[12]课题组利用酸催化发展了一种简便有效的二芳香环稠合2,8-二氧杂双环[3.3.1]壬烷衍生物的合成方法. 2019 年,苏州大学Yang[13]课题组利用阳离子铝化合物[AlCl(CH3CN)5]2+[(AlCl4)2]2-·CH3CN 催化2-羟基查尔酮和萘酚的傅克烷基化/缩酮化反应生成二芳基稠合2,8-二氧杂双环[3.3.1]壬烷,为合成2,8-二氧杂双环[3.3.1]壬烷化合物提供了一种实用的新方法. 然而,现有的合成方法存在反应时间长、使用环境不友好的溶剂和催化剂、后处理复杂等问题[14-16]. 因此,需要开发串联成键效率高、反应简单且副产物少的绿色合成2,8-二氧双环[3.3.1]壬烷方法.
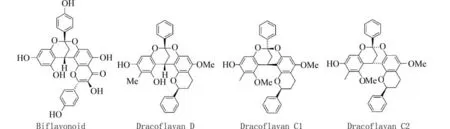
图1 天然产物中存在的2,8-二氧双环[3.3.1]壬烷结构Fig. 1 Structure of 2,8-dioxane [3.3.1] nonane in natural products
微波作为一种高能电磁波,具有较高的加热效率和促进反应作用[17],因此微波辐射技术被认为是直接、快速和有效的有机合成方法之一[18]. 微波辐射反应在可持续和高效的化学转化方面也有应用[19],它克服了传统反应时间长、产率低和副产物易生成等缺陷,从而减少对环境的污染,为有机合成技术提供有益补充[20-22]. 本课题组关注微波应用于杂环化合物的构建,运用微波辐射实现了廉价原料多组分多米诺反应高效合成2-吡啶酮衍生物[23]和功能化吡咯衍生物[24]. 基于前期工作基础,我们探索开发微波辅助下高效绿色构筑2,8-二氧双环[3.3.1]壬烷类化合物的新方法.
在构筑含氧化合物报道中,查尔酮是一类常用的有机合成中间体[25]. 查尔酮分子有多个活性位点,羟基的引入为多步连续构环反应提供可能,同时微波对于底物极性端有活化作用. 因此,2-羟基查尔酮能与具有亲核性的底物通过连续的迈克尔加成/分子内环化的反应历程合成2,8-二氧双环[3.3.1]壬烷类化合物[26]. 我们采用微波辐射在无催化剂条件下以2-羟基查尔酮与2-羟基-1,4-萘醌发生亲核加成反应,探索并实现了与醌类化合物融合的2,8-二氧双环[3.3.1]壬烷的有效合成. 该方法使用微波辐射大大缩短反应时间,利用环境友好的溶剂乙醇,一锅中形成多键,后处理简单,无需柱层析分离产物,产率高,且只有水作为唯一的副产物.
我们选择以苯乙酮衍生物及水杨醛衍生物为原料经Claisen-Schmidt 反应合成了14 个2-羟基查尔酮类衍生物 (3a~3n),再经微波辅助高效、高选择性地合成一系列2,8-二氧双环[3.3.1]壬烷化合物 (5a~5n). 合成路线如图2 所示.
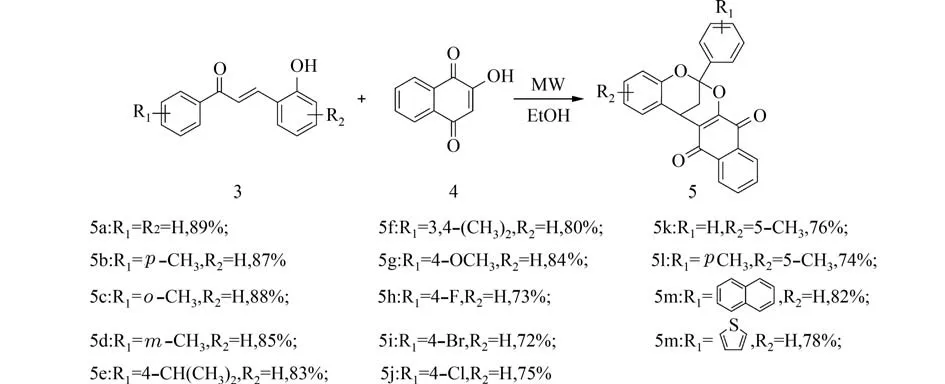
图2 目标化合物合成路线Fig. 2 Synthetic route of target compounds
1 实验部分
1.1 仪器与试剂FA1004 电子分析天平 (上海天平仪器厂);X-5 LED 显微熔点测定仪控温型 (北京泰克仪器有限公司);NICOLET iS10 傅里叶红外光谱 仪 (美 国Thermo Fisher Scientific 公 司);LTQ Orbitrap XL 高 分 辨 质 谱 仪 (美 国Thermo Fisher Scientific 公司);BRUKER AV Ⅲ-400 核磁共振仪(美国BRUKER 公司);微波合成仪 (CEM Discover SP-Microwave Synthesizer);天平;注射器.
GF-254 高效板薄层色谱硅胶板 (青岛海洋化工厂);水杨醛衍生物、苯乙酮衍生物、2-羟基-1,4-萘醌、氢氧化钾、盐酸、乙醇、氘代氯仿 (探索平台、阿拉丁生化科技股份有限公司),所用试剂均为分析纯或化学纯.
1.2 合成方法
1.2.1 2-羟基查尔酮类化合物3的合成 在干燥的密封反应管中加入苯乙酮衍生物 (1,5 mmol)、水杨醛衍生物 (2,5 mmol),3 mL 乙醇作为溶剂,再加入0.5 g 氢氧化钾,132 ℃反应3 min,待冷却至室温,倒入50 mL 冰水中,加入HCl 调节pH 至1.0~2.0 时析出黄色固体,水洗抽滤,乙醇重结晶,干燥得到反应原料2-羟基查尔酮类化合物3.
1.2.2 2,8-二氧双环[3.3.1]壬烷类化合物5a~5n的合成 以2-羟基查尔酮3 和2-羟基-1,4-萘醌4为底物,通过改变反应溶剂、温度、催化剂等条件对反应进行了筛选,优化后反应过程如下:
将2-羟基查尔酮 (3,1 mmol)和2-羟基-1,4-萘醌 (4,1 mmol)置于10 mL 微波反应试管内,加入1.5 mL 乙醇使其完全溶解,随后放入微波反应器中,120 ℃反应40 min. 反应完成后,加入适量乙醇,静置沉淀,待沉淀完全析出后,用10 mL 乙醇洗涤抽滤3 次,再用10 mL 水洗涤抽滤3 次,真空干燥,制得2,8-二氧双环[3.3.1]壬烷类化合物5 (化合物5a~5n 核磁谱图见支撑文件).
6-苯基-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5a). 黄色粉末;收率89%;熔 点185~186 ℃;1H NMR (400 MHz,CDCl3)δ: 8.11~ 8.08 (m,2H),7.77~7.75 (m,2H),7.73~7.66 (m,2H),7.51~7.44 (m,4H),7.19~7.17(m,1H),7.06 ~7.04 (m,1H),6.98~6.94 (m,1H),4.56 (t,J= 2.9 Hz, 1H), 2.48~2.44 (m, 1H),2.33~2.29 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.7,177.8,152.2,150.8,138.4,133.0,132.4,130.7,130.0,128.3,127.5,125.5,125.2,124.8,123.7,123.2,120.9,115.6,99.1,31.1,25.2;IR (KBr) (νmax,cm-1):3 440,1 662,1 644,1 591,1 334,1 239,1 105,955,763; HRMS (ESI-TOF)m/z: C25H17O4+[M+H]+381.111 9,实测 381.1121.
6-(对甲苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5b). 黄色粉末;收率87%;熔点230~231 ℃;1H NMR (400 MHz,CDCl3)δ:8.09~8.07 (m,2H),7.73~7.67 (m,2H),7.64 (d,J= 8.3 Hz,2H),7.48 ~7.45 (m,1H),7.28 (d,J= 8.0 Hz,2H),7.20~7.16 (m,1H),7.04 (d,J= 7.4 Hz,1H),6.97~ 6.93 (m,1H),4.54 (t,J= 2.9 Hz,1H),2.47~ 2.43 (m,1H),2.41 (s,3H),2.32~2.27 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.7,177.8,152.28,150.9,138.2,135.5,133.0,132.4,130.7,130.0,128.2,127.4,127.3,125.5,125.2,124.7,123.7,123.2,120.9,115.6,99.1,31.1,25.2,20.2;IR (KBr) (νmax,cm-1):3 442,1 663,1 644,1 602,1 335,1 236,1 099,945,766; HRMS (ESI-TOF)m/z: C26H19O4+[M+H]+395.127 7,实测 395.1278.
6-(邻甲苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5c). 黄色粉末;收率88%;熔点224~225 ℃;1H NMR (400 MHz,CDCl3)δ:8.10 ~8.07 (m,2H),7.83~7.81 (m,1H),7.72~7.65 (m,2H),7.49~7.47 (m,1H),7.36~7.27(m,3H),7.21 ~7.17 (m,1H),7.03 ~7.01 (m,1H),6.98~6.94 (m,1H),4.56 (t,J= 2.9 Hz,1H),2.55 (q,J= 2.9 Hz,4H),2.40~2.35 (m,1H);13C NMR (100 MHz,CDCl3)δ181.6,177.8,151.8,150.4,135.8,135.6,133.0,132.4,131.6,130.7,129.9,128.3,127.5,127.4,125.4,125.3,125.2,125.0,123.7,123.4,120.9,115.6,100.1,28.7,24.9,20.3;IR (KBr) (νmax,cm-1):3 426,1 666,1 639,1 590,1 336,1 328,1 009,951,761; HRMS (ESI-TOF)m/z: C26H19O4+[M+H]+395.127 6,实测 395.1278.
6-(间甲苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5d). 黄色粉末;收率85%;熔点226~227 ℃;1H NMR (400 MHz,CDCl3)δ:8.03 ~8.00 (m,2H),7.65~7.59 (m,2H),7.56 (d,J= 8.2 Hz,2H),7.40~7.38 (m,1H),7.20 (d,J= 8.0 Hz,2H),7.10~ 7.09 (m,1H),6.96 (d,J= 7.4 Hz,1H),6.90~ 6.86 (m,1H),4.47 (t,J= 2.8 Hz,1H),2.40~2.35 (m,1H),2.33 (s,3H),2.24~2.20 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.7,177.8,152.3,150.9,138.2,135.5,133.0,132.4,130.7,130.0,128.2,127.5,127.4,125.4,125.2,124.7,123.7,123.2,120.9,115.6,99.2,31.1,25.2,20.2;IR (KBr) (νmax,cm-1):3 424,1 682,1 623,1 588,1 337,1 228,1 102,956,764; HRMS (ESI-TOF)m/z: C26H19O4+[M+H]+395.127 8,实测 395.1278.
6-(4-异丙基苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5e). 黄色粉 末;收 率83%;熔 点232~233 ℃;1H NMR(400 MHz,CDCl3)δ:8.11~8.08 (m,2H),7.71~7.67 (m,4H),7.48 ~7.46 (m,1H),7.33 (d,J= 8.3 Hz,2H),7.20~7.16 (m,1H),7.04 (d,J= 7.3 Hz,1H),6.98 ~6.94 (m, 1H), 4.55 (t,J= 2.9 Hz, 1H),3.01~2.94 (m,1H),2.49 ~2.45 (m,1H),2.34~2.29(m,1H),1.30 (s,3H),1.28 (s,3H);13C NMR (100 MHz,CDCl3)δ:181.7,177.8,152.3,150.9,149.1,135.8,132.9,132.4,130.7,130.0,127.4,127.3,125.6,125.5,125.2,124.7,123.7,123.2,120.9,115.6,99.1,32.9,30.9,25.2,22.9;IR (KBr) (νmax,cm-1): 3 437,1 684,1 633,1 593,1 344,1 264,1 009,761;HRMS(ESI-TOF)m/z: C28H23O4+[M+H]+423.158 9,实 测423.1591.
6-(3,4-二甲基苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5f). 黄色粉末;收率80%;熔点219~220 ℃;1H NMR (400 MHz,CDCl3)δ:8.10 ~8.07 (m,2H),7.69~7.65 (m,2H),7.50~7.45 (m,3H),7.23 (d,J= 7.6 Hz,1H),7.20~7.16 (m,1H),7.06~7.04 (m,1H),6.97~6.93(m,1H),4.54 (t,J= 2.9 Hz,1H),2.48~2.43 (m,1H),2.33 (s,3H),2.30 (q,J= 2.7 Hz,4H);13C NMR (100 MHz,CDCl3)δ:181.8,177.8,152.3,150.9,136.9,135.9,135.8,132.9,132.4,130.7,130.0,128.7,127.4,127.3,125.9,125.4,125.2,123.7,123.3,122.1,120.8,115.6,99.1,31.1,25.2,18.9,18.6;IR (KBr) (νmax,cm-1):3 438,1 677,1 639,1 588,1 349,1 248,1 124,957,758; HRMS (ESI-TOF)m/z: C27H21O4+[M+H]+409.143 6,实测 409.1434.
6-(4-甲氧基苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5g). 黄色粉末;收率84%;熔点189~190 ℃;1H NMR (400 MHz,CDCl3)δ:8.09~8.08 (m,1H),8.07~ 8.06 (m,1H),7.7 ~7.66 (m,4H),7.47 ~7.45 (m,1H),7.20~7.15 (m,1H),7.03 (d,J= 7.7 Hz,1H),7.00~6.93 (m,3H),4.54 (t,J= 2.8 Hz,1H),3.85 (s,3H),2.47~2.43(m,1H),2.32 ~2.27 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.7,177.8,159.3,152.2,150.9,132.9,132.4,130.7,130.6,129.9,127.4,127.3,126.2,125.4,125.2,123.6,123.2,120.8,115.6,112.8,99.1,54.4,31.1,25.3;IR (KBr) (νmax,cm-1): 3 445,1 680,1 621,1 593, 1 512, 1 334, 1 164, 1 097, 941, 883, 756;HRMS (ESI-TOF)m/z: C26H19O5+[M+H]+411.122 4,实测 411.1227.
6-(4-氟苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5h). 黄色粉末;收率73%;熔点188~189 ℃;1H NMR (400 MHz,CDCl3)δ:8.10~ 8.07 (m,2H),7.76~7.73 (m,2H),7.71~7.65 (m,2H),7.48 ~7.46 (m,1H),7.21 ~7.13(m,3H),7.04 (d,J= 8.1 Hz,1H),6.99 ~6.95 (m,1H),4.55 (t,J= 2.9 Hz, 1H), 2.46~2.42 (m, 1H),2.31~2.27 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.6,177.7,162.2 (d,J= 247 Hz),152.0,150.6,134.4,133.1,132.4,130.7,129.9,127.5,127.4,126.9,126.8,125.5,125.2,123.7,123.0,121.1,115.6,114.6,114.3,98.7,31.1,25.2;IR (KBr) (νmax,cm-1): 3 435,1 667,1 632,1 621,1 598,1 513,1 335,1 236,1 158,947,758;HRMS (ESI-TOF)m/z: C25H16FO4+[M+H]+399.102 9,实测399.1027.
6-(4-溴苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5i). 黄色粉末;收率72%;熔点234~235 ℃;1H NMR (400 MHz,CDCl3)δ:8.10~8.07 (m,2H),7.73~7.66 (m,2H),7.64~7.59 (m,4H),7.48~7.46 (m,1H),7.21~7.17(m,1H),7.03 (d,J= 7.3 Hz,1H),6.99~ 6.95 (m,1H),4.55 (t,J= 2.9 Hz,1H),2.45~2.41 (m,1H),2.30~2.25 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.6,177.7,151.9,150.6,137.5,133.1,132.5,130.7,130.6,129.9,127.5,127.4,126.6,125.5,125.2,123.7,122.9,122.6,121.1,115.6,98.7,30.9,25.1;IR (KBr) (νmax,cm-1): 3 444,1 689,1 623,1 594,1 486,1 332,1 248,1 093, 1 013, 951, 760; HRMS (ESI-TOF)m/z:C25H16BrO4+[M+H]+459.022 3,实测 459.0226.
6-(4-氯苯基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5j). 黄色粉末;收率75%;熔点219~220 ℃;1H NMR (400 MHz,CDCl3)δ:8.11~ 8.08 (m,2H),7.72 ~7.66 (m,4H),7.48 ~7.44 (m,3H),7.19~7.17 (m,1H),7.05 ~7.03(m,1H),6.99~6.95 (m,1H),4.56 (t,J= 2.9 Hz,1H),2.45~2.41 (m,1H),2.30~2.26 (m,1H);13C NMR(100 MHz, CDCl3)δ: 181.6, 177.7, 151.9, 150.6,136.9,134.4,133.1,132.5,130.7,129.9,127.7,127.5,127.4,126.4,125.5,125.2,123.7,122.9,121.1,115.6,98.6,31.0,25.1;IR (KBr) (νmax,cm-1): 3 425,1 681,1 630,1 594,1 488,1 403,1 335,1 242,1 007,951,761; HRMS (ESI-TOF)m/z: C25H16ClO4+[M+H]+415.073 3,实测 415.0732.
2-甲基-6-苯基-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5k). 黄色粉末;收率76%;熔点204~205 ℃;1H NMR (400 MHz,CDCl3)δ:8.10~8.08 (m,2H),7.76~7.74 (m,2H),7.71 ~7.66 (m,2H),7.50~7.44 (m,3H),7.27(d,J= 1.5 Hz,1H),7.00~6.98 (m,1H),6.95 (d,J=8.2 Hz,1H),4.51 (t,J= 2.8 Hz,1H),2.46~ 2.42 (m,1H), 2.30 ~2.26 (m, 4H);13C NMR (100 MHz,CDCl3)δ:181.7,177.8,152.3,148.5,138.5,133.0,132.4,130.7,130.4,129.9,128.2,127.9,127.7,127.5,125.4,125.2,124.8,123.7,122.8,115.3,99.1,31.2,25.1,19.5;IR (KBr) (νmax,cm-1): 3 448,1 688,1 632,1 493, 1 433, 1 398, 1 334, 1 290, 1 023, 984, 758;HRMS (ESI-TOF)m/z: C26H19O4+[M+H]+395.127 8,实测 395.1278.
2-甲 基-6-(对 甲 苯 基)-13H-6,14-亚 甲 基 苯 并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5l).黄色粉末;收率74%;熔点192~193 ℃;1H NMR(400 MHz,CDCl3)δ:8.10 ~8.08 (m,2H),7.73~7.65 (m,2H),7.63 (d,J= 8.2 Hz,2H),7.28 (s,3H),6.99~6.97 (m,1H),6.93 (d,J= 8.2 Hz,1H),4.50 (t,J= 2.8 Hz,1H),2.45~2.42 (m,1H),2.41 (s,3H),2.28 (s,3H),2.27~ 2.24 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.8,177.8,152.4,148.6,138.1,135.6,132.9,132.4,130.7,130.3,130.0,128.1,127.9,127.7,125.4,125.2,124.7,123.7,122.8,115.4,99.2,31.2,25.2,20.2,19.5;IR (KBr) (νmax,cm-1): 3 428,1 679, 1 643, 1 606, 1 456, 1 386, 1 335, 958, 728;HRMS (ESI-TOF)m/z: C27H21O4+[M+H]+409.143 2,实测409.1434.
6-(萘-2-基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5m). 黄色粉末;收率82%;熔点188~189 ℃;1H NMR (400 MHz,CDCl3)δ:8.29 (d,J= 1.4 Hz,1H),8.13~8.09 (m,2H),7.96~7.94 (m,2H),7.89~7.88 (m,1H),7.80~7.77 (m,1H),7.72~7.67 (m,2H),7.56~7.53 (m,2H),7.51~7.49 (m,1H),7.24~7.20 (m,1H),7.11 (d,J= 7.2 Hz,1H),7.01~6.97 (m,1H),4.60 (t,J= 2.9 Hz,1H),2.57~2.53 (m,1H),2.42~2.38 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.7,177.8,152.2,150.9,135.6,133.1,132.5,132.4,131.9,130.7,130.0,127.5,126.6,125.8,125.5,12.4,125.2,124.3,123.7,123.2,122.3,120.9,115.7,99.2,31.1,25.2;IR (KBr) (νmax,cm-1): 3 450,1 688,1 619,1 605,1 463,1 348,1 008,946,759;HRMS (ESI-TOF)m/z: C29H19O4+[M+H]+431.127 9,实测 431.1278.
6-(噻吩-2-基)-13H-6,14-亚甲基苯并[d]萘酚[2,3-g][1,3]二氧桥-8,13(14H)-二酮 (5n). 黄色粉末;收率78%;熔点193~194 ℃;1H NMR (400 MHz,CDCl3)δ:8.10~8.07 (m,2H),7.73~7.65 (m,2H),7.47 ~7.45 (m,1H),7.42~7.40 (m,1H),7.39~7.38(m,1H),7.20~7.16 (m,1H),7.10~7.07 (m,1H),7.03 (d,J= 7.9 Hz,1H),6.98~ 6.94 (m,1H),4.57 (t,J= 2.9 Hz,1H),2.62~2.58 (m,1H),2.49 ~2.45 (m,1H);13C NMR (100 MHz,CDCl3)δ:181.7,177.5,151.8,150.4,141.4,133.1,132.5,130.6,129.9,127.4,127.3,125.9,125.6,125.5,125.2,124.7,123.6,122.9,121.1,115.7,97.9,31.2,25.2;IR (KBr) (νmax,cm-1):3 442,1 658,1 621,1 592,1 323,1 230,1 194,1 096,950,754;HRMS (ESI-TOF)m/z: C23H15O4S+[M+H]+387.068 6,实测 387.0686.
2 结果与讨论
2.1 合成
2.1.1 反应条件的筛选 以2-羟基查尔酮3a 和2-羟基-1,4-萘醌4 作为反应原料,对合成2,8-二氧双环[3.3.1]壬烷类化合物5a 的反应条件进行考察,结果见表1. 从结果可以看出,反应的溶剂和温度对反应的影响较大,升高温度可以提高产率和降低反应时间. 使用微波可以促进反应更快进行,缩短反应时间. 得到的最佳反应条件为: 2-羟基查尔酮(3,1 mmol) 和2-羟基-1,4-萘醌 (4,1 mmol),1.5 mL乙醇为溶剂,微波辅助下,120 ℃反应40 min,以89%的产率得到目标产物5a.
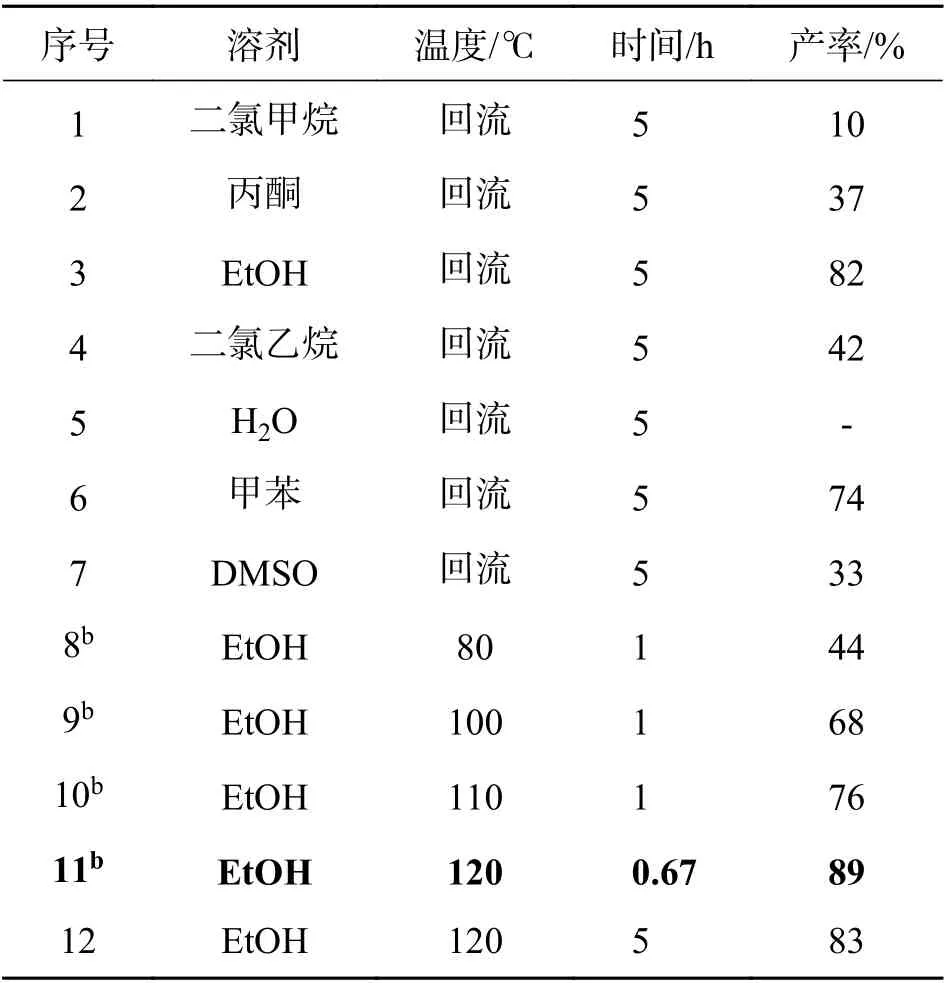
表1 制备2,8-二氧双环[3.3.1]壬烷类化合物5a 条件筛选aTab. 1 Optimization of reaction condition for the systhesis of 5a
2.1.2 2-羟基查尔酮上不同取代基对反应的影响以2-羟基查尔酮3a 和2-羟基-1,4-萘醌4 作为反应原料,在最佳反应条件下通过改变2-羟基查尔酮的不同取代基对合成2,8-二氧双环[3.3.1]壬烷类化合物5a 的反应条件进行考察,结果表明,2-羟基查尔酮R1为供电子基团取代时对反应产率没有明显的影响,邻位、间位、对位取代时也能以良好的产率得到目标产物. R1为卤素取代时产率稍微降低,但也能达到72%. 2-羟基查尔酮R2为供电子基团取代时产率也没有明显变化. 此外,2-羟基查尔酮为萘环、杂环或双取代时也能得到目标产物,且反应产率并没有降低. 因此,此合成方法反应条件简单同时能够获得分子结构多样性的2,8-二氧双环[3.3.1]壬烷类化合物.
2.2 机 理以2-羟 基 查 尔 酮3a 和2-羟 基-1,4-萘醌4 作为反应原料,在最佳反应条件下合成2,8-二氧双环[3.3.1]壬烷类化合物5a. 对该反应的机理进行探讨 (图3). 首先,作为亲核试剂的2-羟基-1,4-萘醌4 与2-羟基查尔酮3a 发生迈克尔加成反应生成中间体A,再次加成生成中间体B,中间体B 脱水经分子内环化反应生成目标产物5a. 机理研究表明,由于微波具有较高的加热效率,对第一步的迈克尔加成有一定的促进作用. 同时微波具有可能的催化作用[21],使连续的分子内加成/脱水/环化历程更容易进行. 因此,引入微波辅助可以加快反应,在短时间内以较高的产率得到目标化合物. 该反应在一锅中形成2 个C—C 键和2 个C—O 键,只生成水作为唯一的副产物,成键效率高,原子经济性高.
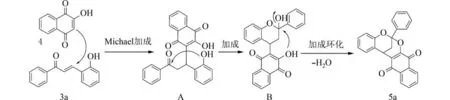
图3 可能的反应机理Fig. 3 Possible mechanisms
3 结语
本文在微波反应无催化剂条件下以2-羟基查尔酮和2-羟基-1,4-萘醌为原料合成了复杂多环2,8-二氧双环[3.3.1]壬烷衍生物. 该方法反应条件绿色,使用环境友好的溶剂乙醇;串联成键效率高,一锅中形成2 个C—C 键和2 个C—O 键;后处理简单,无需柱层析分离产物;产率高达72%~89%且原子经济性高,只有水作为唯一的副产物. 在微波辅助促进下反应经历了迈克尔加成/脱水/分子内环化的串联反应,构筑了14 个2,8-二氧双环[3.3.1]壬烷类化合物 (其中7 个新化合物). 该方法利用微波新技术为复杂多环化合物的合成方法提供了新思路,为后续2,8-二氧双环[3.3.1]壬烷类氧杂环化合物的活性筛选提供了物质基础.
