方沸石/氧化石墨烯复合材料的制备及其对溶液中Cs+的吸附性能试验研究
2021-10-14刘若妍邹丽霞
徐 琼,刘若妍,黄 前,邹丽霞
(1.东华理工大学 核资源与环境国家重点实验室,江西 南昌 330013;2.东华理工大学 化学生物与材料科学学院,江西 南昌 330013)
137Cs(强γ辐射源)的半衰期约为30年[1],它们会在动植物体内不断累积,进而导致环境和人类健康问题[2-3],因此,去除环境废水中的铯,对于环保和资源回收都有重要意义[4]。
沸石是一种具有优良热稳定性、抗辐射性及化学稳定性的吸附剂,被广泛用于处理放射性废水[5-9]。但沸石的吸附能力较弱[10-13],对其改性制备复合型吸附材料可提高其吸附性能。氧化石墨烯[14-16]是典型的吸附材料,其表面及片层之间含有大量羟基、羧基等含氧官能团,比表面积大,有较多结合位点,可用于吸附去除放射性废水中的Cs+[17]。沸石与氧化石墨烯复合可以提高氧化石墨烯的热稳定性及循环使用稳定性,也会增大其比表面积,增加结合位点。
研究了采用原位水热法制备方沸石(ANA),进一步制备方沸石/氧化石墨烯(GO-ANA)复合材料,并借助SEM&EDS、FT-IR、XRD、TG、BET对复合材料的结构进行表征,通过试验考察了溶液pH、吸附时间、Cs+初始质量浓度和温度等对GO-ANA吸附溶液中Cs+的影响,讨论了吸附机制。
1 试验部分
1.1 主要试剂
石墨粉、浓硫酸、氢氧化钠、氧化铝、氧化硅、无水乙醇均为分析纯;水为去离子水。
方沸石(ANA),自制。
1.2 主要仪器
傅里叶红外光谱仪(Nicolet380型,美国尼高力公司),热重分析仪(STA2500型,耐驰公司),扫描电子显微镜(Nova Nano 450型,荷兰FEI公司),比表面仪(NOVA-4200e型,美国 Quanta chrome公司),X射线衍射仪(D8 Advance型,德国Bruker AXS公司),X射线荧光光谱仪(RIX2100型,荷兰 PANalytical 公司),火焰原子吸收分光光度计(TAS-990型,北京普析通用仪器有限公司)。
1.3 试验方法
1.3.1 材料的制备
ANA的制备:按ANA的组成取二氧化硅与氧化铝,加入去离子水,溶于2 mol/L氢氧化钠溶液中,再放入水热反应釜中于180 ℃下水热反应12 h,自然冷却后过滤、干燥,得ANA。
GO的制备:参考改进后的Hummers方法[18]制备。
GO-ANA复合材料的制备:称取0.5 g预处理的ANA于烧杯中,加入20 mL无水乙醇,搅拌2 h,放入超声仪中超声3 h使其溶解分散,然后缓慢加入0.3 g GO,再超声并搅拌2 h,之后冷却过滤、干燥,得GO-ANA。
1.3.2 复合材料的表征与分析
借助SEM、FT-IR、XRD、TG、Zeat电位分析仪和BET等分析复合材料的微观形貌、官能团、物相结构、热稳定性、表面电位和比表面积。
利用火焰原子吸收分光光度计(AAS)测定吸附前、后溶液中Cs+浓度。
1.3.3 复合材料吸附Cs+
采用静态吸附法进行试验。25 ℃条件下,准确称取30 mg吸附剂于100 mL具塞锥形瓶中,加入Cs+溶液50 mL;以200 r/min速率在恒温摇床中振荡至反应达到平衡,离心分离后,取上层清液,测定其中Cs+质量浓度,根据公式(1)计算吸附量(qe)。
(1)
式中:ρ0—溶液中初始Cs+质量浓度,mg/L;ρe—吸附平衡时溶液中Cs+质量浓度,mg/L;V—溶液体积,L;m—吸附剂质量,mg。
1.3.4 复合材料的再生
用50 mL NaCl溶液(1 mol/L)洗涤吸附平衡后的GO-ANA,然后用于吸附,重复5次吸附—解吸,室温下振荡1 h,考察GO-ANA的重复使用性能。
2 试验结果与讨论
2.1 材料的表征
2.1.1 SEM&EDS分析
材料的微观结构与形貌如图1所示。GO-ANA的EDS分析结果如图2所示。

图1 ANA(a)、GO(b)和GO-ANA(c)的SEM分析结果

图2 GO-ANA的EDS分析结果
由图1看出:所制备的ANA为二十四面体结构,表面光滑;GO为薄片状,表面光滑,具有褶皱的波纹;GO表面上出现大量ANA颗粒,表明复合材料GO-ANA制备成功。
由图2看出:GO-ANA中主要含有Na、O、C、Al、Si元素,既有GO所含元素,也有ANA所含元素,且元素分散均匀,表明所合成的GO-ANA分布均匀。
2.1.2 FT-IR分析
ANA、GO和GO-ANA的FT-IR分析结果如图3所示。ANA中,633 cm-1处有1个窄的吸收峰,这是由水分子的弯曲振动引起;1 014、790 cm-1处出现尖锐且强的吸收峰,这是由T—O(T=Si,Al)的不对称伸缩振动引起;597 cm-1处的吸收峰与T—O—T(T=Si,Al)内部结构弯曲振动有关[19]。GO中,3 244 cm-1处的峰是O—H的伸缩振动峰,1 029 cm-1处的峰为环氧基团C—O—C的伸缩振动峰,1 590 cm-1附近的峰是C=C的伸缩振动峰,1 715 cm-1处的峰是C=O的伸缩振动峰。GO-ANA中,在987、787、609 cm-1处的峰为ANA中的T—O(T=Si,Al)的特征峰,1 618 cm-1处的峰是C=C的伸缩振动峰,1 710 cm-1处的峰是C=O的伸缩振动峰,3 329 cm-1处的峰是O—H伸缩振动峰。图中未出现C—O—C伸缩振动峰,且除了C=C特征峰外,其余含氧官能团较GO峰值减弱且左移,这是因为ANA与GO表面的含氧基团相互作用,造成相邻的C原子缔合成C=C,使得GO-ANA中的C=C伸缩振动峰右移且增强。

图3 ANA、GO和GO-ANA的FT-IR分析结果
2.1.3 XRD分析
ANA、GO和GO-ANA的XRD分析结果如图4所示。

图4 ANA、GO和GO-ANA的XRD分析结果
由图4看出:在10.8°处的衍射峰峰形尖锐,这是GO的特征衍射峰;GO-ANA中,在10°~11° 范围内出现较强衍射峰,与GO特征衍射峰一致;在15°~80°区间出现了ANA的衍射峰,但峰强度减弱,这是ANA覆盖到GO表面造成照射到GO上的X射线强度减弱所致,说明GO已成功与ANA复合。
2.1.4 TG分析
GO与GO-ANA的TG曲线如图5所示。可以看出:在0~150 ℃范围内,GO和GO-ANA均只有少部分质量损失,主要是脱水引起的;在150~300 ℃范围内,GO质量下降较快,表明高温导致GO化学键断裂,基本骨架发生坍塌;而在423 ℃左右,GO发生燃烧,导致质量损失殆尽;GO-ANA质量损失相对较少,这是GO表面的含氧官能团与ANA上的羟基脱水缩合后形成了较强的化学键,从而使热稳定性增强。
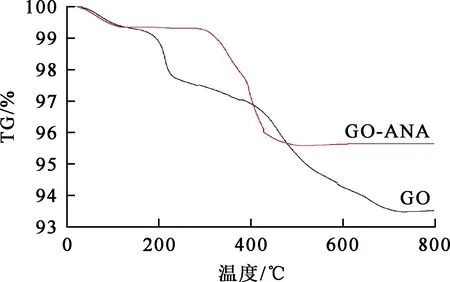
图5 GO与GO-ANA的TG曲线
2.1.5 N2吸附—脱附分析
GO-ANA对N2的吸附—脱附等温线如图6所示,其相关参数见表1。可以看出:GO-ANA对N2的吸附—脱附等温线呈Ⅲ型,具有明显的滞后环,表明GO-ANA主要是中大孔结构。与ANA相比,GO-ANA的比表面积和孔体积均增大。
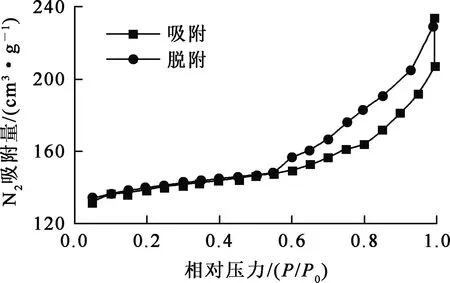
图6 GO-ANA对N2的吸附—脱附等温线

表1 GO-ANA对N2的吸附—脱附试验结果
2.2 溶液中Cs+的吸附
2.2.1 溶液pH对吸附Cs+的影响
溶液中初始Cs+质量浓度为100 mg/L,吸附时间为240 min,温度为298.15 K,溶液pH对GO与GO-ANA吸附Cs+的影响试验结果如图7所示。
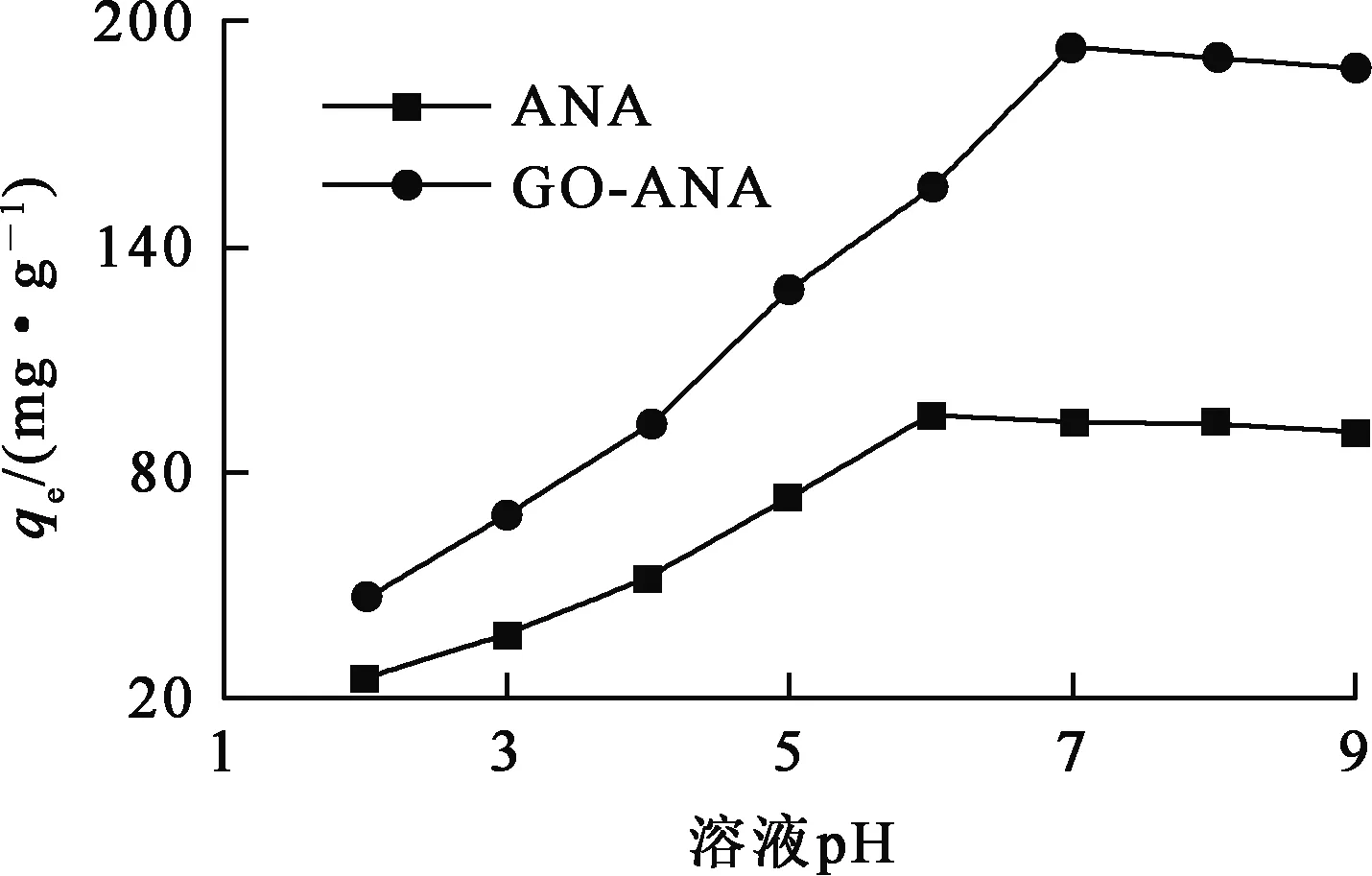
图7 溶液pH对ANA和GO-ANA吸附Cs+的影响
由图7看出:2
2.2.2 吸附时间对吸附Cs+的影响
溶液pH=7,初始Cs+质量浓度为100 mg/L,温度为298.15 K,吸附时间对ANA和GO-ANA吸附Cs+的影响试验结果如图8所示。

图8 吸附时间对ANA和GO-ANA吸附Cs+的影响
由图8看出:在吸附反应的前80 min,ANA和GO-ANA对Cs+的吸附量明显较高,且GO-ANA的吸附速率更快,这是因为GO-ANA的表面含氧官能团更多、活性位点更多;ANA与GO-ANA分别在80 min和160 min达到吸附平衡,吸附量不再发生明显变化。后续试验中,吸附时间设为160 min。
2.2.3 溶液初始Cs+质量浓度对吸附Cs+的影响
溶液pH=7,吸附时间240 min,温度298.15 K,初始Cs+质量浓度对ANA和GO-ANA吸附Cs+的影响试验结果如图9所示。
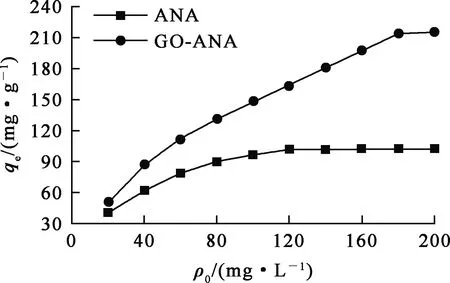
图9 初始Cs+质量浓度对ANA和GO-ANA吸附Cs+的影响
由图9看出:溶液初始Cs+质量浓度在20~120 mg/L范围内,GO-ANA及ANA对Cs+的吸附量均随浓度增大而提高,且分别在初始Cs+质量浓度为180、120 mg/L时达到吸附平衡,表面的活性位点被充分占据,吸附量不再变化。试验确定溶液初始Cs+质量浓度为100 mg/L。
2.2.4 温度对吸附Cs+的影响
溶液pH=7,初始Cs+质量浓度为100 mg/L,吸附时间240 min,温度对ANA与GO-ANA吸附Cs+的影响试验结果如图10所示。

图10 温度对ANA和GO-ANA吸附Cs+的影响
由图10看出:ANA与GO-ANA对Cs+的吸附量均随温度升高而提高,表明升高温度有利于ANA与GO-ANA吸附Cs+。随温度升高,溶液中Cs+运动速率加快,扩散系数增大,传质速率更快,有利于吸附反应进行。
2.3 吸附机制的探讨
2.3.1 吸附动力学
根据准一级、准二级动力学模型,见式(2)、(3),对溶液体积50 mL、pH=7、初始Cs+质量浓度100 mg/L、温度298.15 K 条件下ANA与GO-ANA吸附Cs+的试验数据进行拟合。得到的拟合曲线如图11所示,相关的动力学拟合参数见表2。
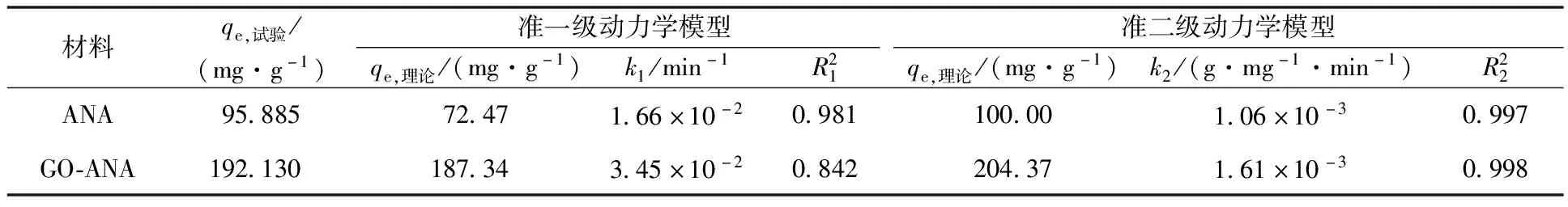
表2 ANA与GO-ANA吸附Cs+的动力学拟合参数

图11 ANA与GO-ANA吸附Cs+的准一级(a)和准二级(b)动力学拟合曲线
准一级动力学模型,
ln(qe-qt)=lnqe-k1t;
(2)
准二级动力学模型,
(3)
式中:qe—吸附平衡时的吸附量,mg/g;qt—吸附t时间时的吸附量,mg/g;k1—准一级动力学模型常数,min-1;k2—准二级动力学模型常数,g/(mg·min)。
2.3.2 吸附等温线
根据Langmuir与Freundlich等温吸附模型,见式(4)、(5),对溶液体积50 mL、pH=7、初始Cs+质量浓度100 mg/L条件下ANA与GO-ANA吸附Cs+的平衡数据进行拟合。得到的拟合曲线如图12所示,相关的等温拟合参数见表3。

表3 ANA与GO-ANA吸附Cs+的Langmuir和Freundlich等温拟合参数

图12 ANA与GO-ANA吸附Cs+的Langmuir(a)和Freundlich(b)等温吸附拟合曲线
Langmuir等温吸附模型,
(4)
Freundlich等温吸附模型,
(5)
式中:qe—吸附平衡时的吸附量,mg/g;ρe—吸附平衡时溶液中的Cs+质量浓度,mg/L;qm—单分子层饱和吸附量,mg/g;kF—Freundlich等温吸附常数,L/g;kL—Langmuir等温吸附常数,L/mg;n—Freundlich等温吸附强度相关常数。
由表3看出:Langmuir等温吸附模型能更好地描述ANA与GO-ANA对Cs+的吸附过程,2种材料对Cs+的吸附主要是单分子层吸附。GO-ANA吸附Cs+的Freundlich等温吸附强度相关常数n>1,表明GO-ANA对Cs+的吸附更容易。
根据拟合得到的线性相关方程,计算出ANA与GO-ANA对Cs+的理论最大吸附量qm分别为121.22 mg/g和221.85 mg/g。GO-ANA对Cs+的吸附能力更强,是因为其表面的含氧官能团更易与Cs+产生静电吸引,且比表面积更大,有更多暴露的活性位点,更易与Cs+结合。
2.3.3 吸附热力学
溶液体积50 mL、pH=7、初始Cs+质量浓度100 mg/L条件下ANA与GO-ANA吸附Cs+达平衡时的热力学拟合曲线如图13所示,相关参数见表4。kd为分配系数。
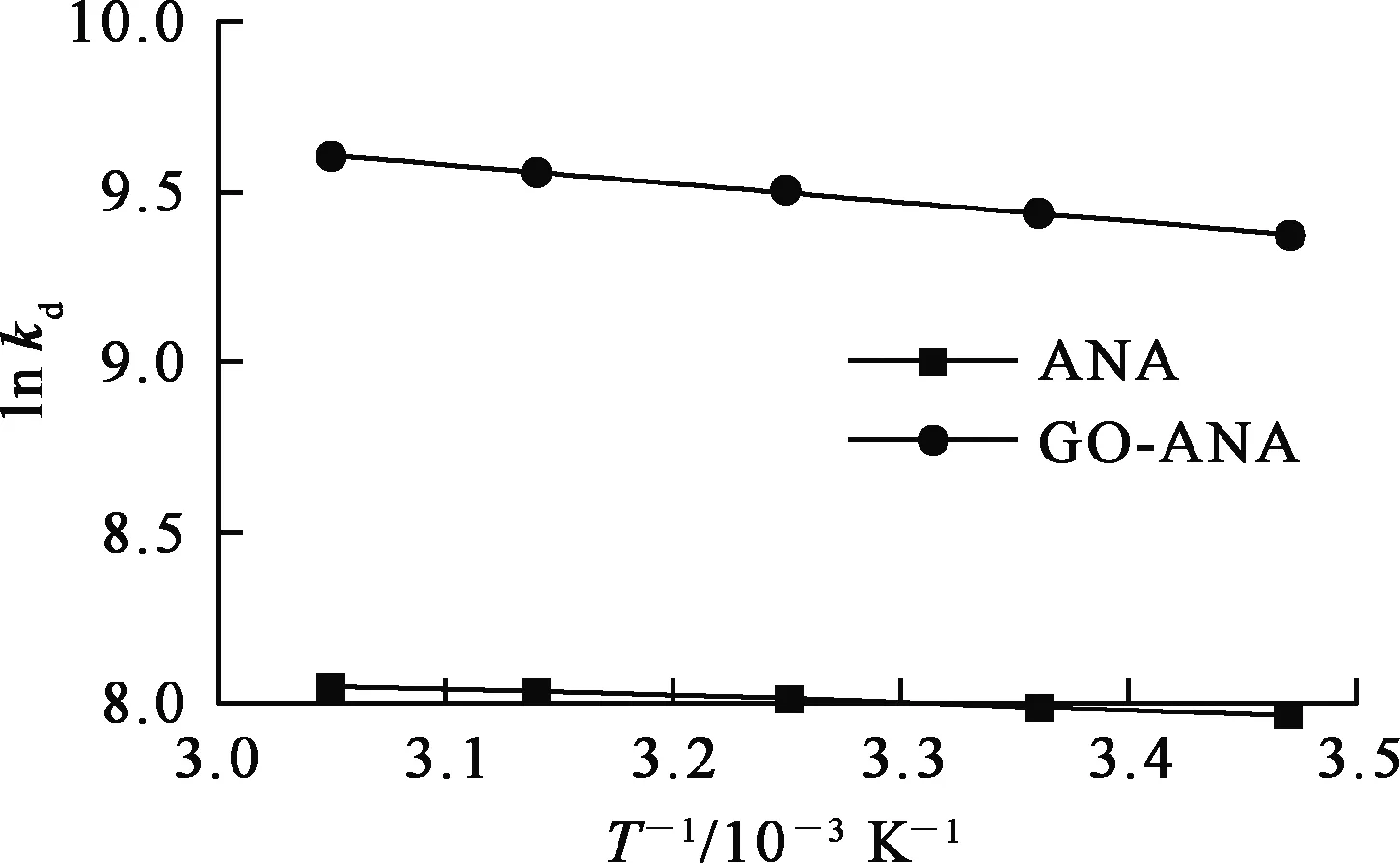
图13 ANA与GO-ANA吸附Cs+的热力学拟合曲线
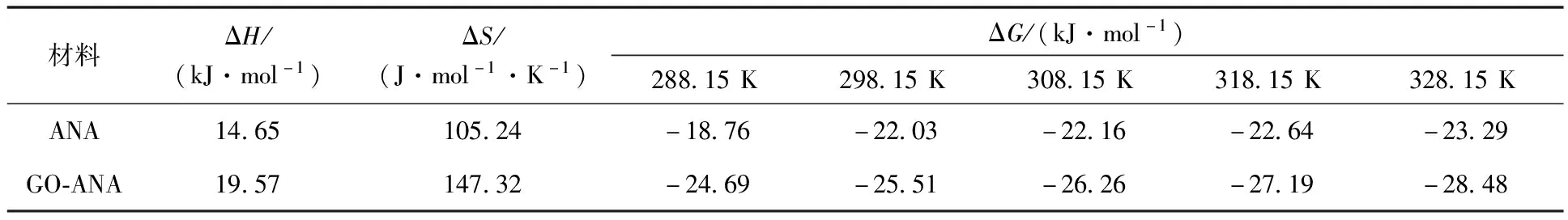
表4 ANA与GO-ANA吸附Cs+的热力学相关参数
由表4看出:ANA与GO-ANA吸附反应的ΔH均大于0,表明二者对Cs+的吸附过程均属于吸热过程;ΔS>0,说明吸附过程中熵增,吸附后溶液体系混乱度增大;而ΔG<0,表明二者吸附Cs+的行为是自发进行的。
2.3.4 吸附机制分析
GO-ANA吸附Cs+前、后的FT-IR光谱如图14所示。

图14 GO-ANA吸附Cs+前、后的FT-IR光谱
由图14看出:吸附前、后红外图谱变化不大,但GO-ANA吸附后总体透过率增大,少部分特征峰强度变强,部分特征峰发生偏移;当GO-ANA吸附Cs+后,在590 cm-1处的特征峰发生偏移且峰强度变强,表明GO-ANA吸附Cs+的过程中存在化学吸附,可能是Cs+与GO-ANA表面羟基等发生了配位反应。
用Zeta电位表征GO-ANA吸附Cs+前、后表面电荷的变化情况,可以进一步研究吸附可行性和作用机制,结果如图15所示。
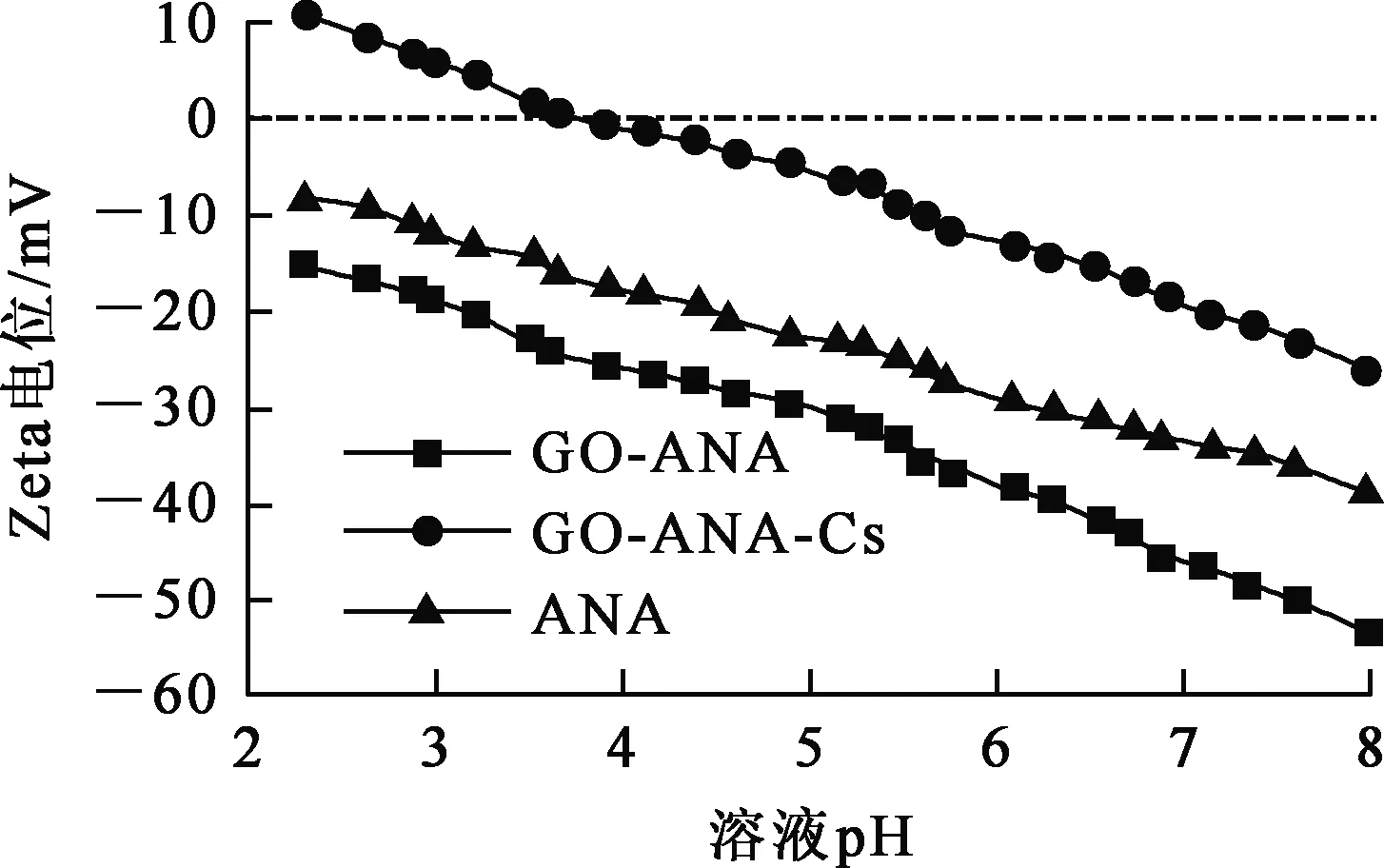
图15 GO-ANA吸附Cs+前、后的Zeta电位
由图15看出:溶液pH在2~8范围内,ANA与GO-ANA的表面均显现负电荷,并且GO-ANA的Zeta电位更低,这是复合后表面含氧基团增多所致;吸附Cs+后,GO-ANA表面的Zeta电位升高,是GO-ANA表面的部分负电荷被Cs+中和所致。这表明吸附过程为Cs+通过静电吸引作用于吸附剂表面,再与其表面羟基等发生配位反应来实现。
2.4 GO-ANA的重复使用性
对于吸附了Cs+的ANA与GO-ANA,用浓度为1 mol/L的NaCl溶液洗涤,然后再进行吸附。重复吸附—脱附5次,分别计算5次的吸附量、洗脱量及吸附率,结果如图16所示。

图16 GO-ANA的重复使用性
由图16看出:重复吸附5次,GO-ANA对Cs+的吸附量从182.95 mg/g降至132.68 mg/g,吸附率从92.73%降至74.29 %,有一定重复使用性。
3 结论
采用原位水热法制备ANA,ANA再与氧化石墨烯(GO)复合得到了复合材料(GO-ANA)。GO与ANA复合后,热稳定性和比表面积都有所增大,用于从溶液中吸附Cs+,适宜条件下有更好的吸附效果。吸附过程符合准二级动力学模型和Langmuir等温吸附模型,表明吸附过程为化学吸附,属于单分子层吸附,最大吸附量达221.85 mg/g,反应过程中吸热且可自发进行。重复试验结果表明,GO-ANA在吸附—脱附5次后,其对Cs+的吸附率仍高达74.29%,可多次循环利用。复合材料表面的含氧官能团易与Cs+产生静电吸引,且比表面积较大,有更多暴露的活性位点,更易与溶液中的Cs+相结合,具有较好的吸附效果,可用于从溶液中吸附去除放射性元素。
