非酒精性脂肪性肝病患者的肝组织差异蛋白的定量分析:基于iTRAQ技术
2021-10-14朱雅莉章述军李佳俊赵金秋黄文祥
朱雅莉,章述军,阳 成,薛 薇,张 佳,李佳俊,赵金秋,徐 静,黄文祥
重庆医科大学附属第一医院感染科,重庆400016
非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗(IR)和遗传易感密切相关的代谢应激性肝损伤,疾病谱包括非酒精性肝脂肪变、非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌(HCC)[1]。一旦从NAFLD发展为NASH,炎症会引起肝损伤,损失的肝细胞需要修复功能,而修复的过程则会导致肝纤维化,甚至肝硬化。基于此,NASH所致慢性肝衰竭是欧美肝移植的主要原因之一,同样是临床研究的关键环节[2]。目前,非酒精性脂肪性肝炎的发病机制尚未明确,全面分析其差异蛋白可能推动新的发病机制及治疗靶点。
蛋白质组学是高通量筛选和分析表达水平、蛋白质修饰以及蛋白质功能和蛋白质相互作用等过程的研究方式[3]。同位素标记相对和绝对定量(iTRAQ)是目前应用较广的多肽体外标记定量技术,具有精确性高、高通量、重复性好等优点[4]。
既往研究中用小鼠肝脏作为样本进行的肝脏蛋白质组学的研究众多[5-8],但高脂饮食造模小鼠的饮食结构、遗传背景与人体不同。而人体血液样本组织进行的血浆蛋白质组学技术确实发现了NAFLD发病机制的关键蛋白PIGR、RBP4、Lumican[9-11]等。但研究表明现有的基于血液发现的关键蛋白都不是高度准确的[12],且血浆中存在高丰度蛋白混杂,关键作用蛋白在血浆低丰度或不分泌等因素,用人肝脏组织是最为直接可靠的方式,而典型的人NASH组织标本难以获取,少数研究也是在药物干预下进行[13,14],无法对人类肝脏蛋白谱进行全面分析。因此在本研究中,将收集到的人肝脏组织通过病理活检分为NASH模型组和正常组,用iTRAQ蛋白标记筛选出差异蛋白,用生物信息学分析差异蛋白在其炎症发生过程中中发挥的作用。
1 资料和方法
1.1 临床资料
纳入标准:18周岁以上成人,汉族,腹部彩超提示脂肪肝存在和(或)肝脏超声影像和瞬时弹性成像提示脂肪衰减值大于240 dB/m;肝功提示ALT、GGT 等异常;病理发现肝腺泡3区大泡性或以大泡为主的混合性肝细胞脂肪变、伴或不伴有肝细胞气球样变、小叶内混合性炎症细胞浸润以及窦周纤维化,NAS>4分则可诊断NASH。排除标准有活动性病毒性肝炎,药物引起的肝病,全胃肠外营养,肝窦有症状的核变性和自身免疫性肝病或饮酒的肥胖患者(过去12月内每周饮用乙醇量;女性>70 g,男性>140 g);肝硬化及其他终末期疾病或恶性肿瘤以及其他可能有不适合检查的疾病的患者。该研究获重庆医科大学第一附属医院伦理委员会的批准,伦理许可证号为2020-385。
1.2 方法
1.2.1 标本处理 采集到的肝组织干冰运送至重庆市传染病重点实验室,组织分装成3部分,一部分用福尔马林浸泡制作病理切片,一部分组织用RNA later保存进行荧光定量PCR实验,余下组织液氮保存行蛋白组学分析。
1.2.2 样品蛋白质检 每样取30 μg 蛋白溶液加入适量loading buffer 混匀后95 ℃加热5 min,25 000g离心5 min,取上清点入12%SDS聚丙烯酰胺凝胶的点样孔中,120 V恒压电泳120 min;电泳结束后,考马斯亮蓝染色2 h,之后加入适量脱色液(40%乙醇10%乙酸)置于摇床脱色液3~5次,30 min/次。
1.2.3 蛋白酶解 取100 μg加入到1.5 mL离心管中;按Trypsin酶(μg):底物蛋白(μg)=1∶20加入酶液,涡旋振荡后,低速离心1 min,37 ℃孵育2 h;取出消化好的肽段液进行除盐操作;将除盐后得到的肽段液冷冻抽干。
1.2.4 肽段标记 根据样品数量,取出一定量iTRAQ标签试剂;待试剂恢复至室温后,每管试剂加入50 μL异丙醇,涡旋震荡后低速离心;用0.5 mol/L TEAB溶解肽段样品,并加入到对应iTRAQ标签试剂中。不同样品肽段选用不同的iTRAQ标签;室温静止2 h。
1.2.5 肽段分离 采用岛津LC-20AB液相系统,分离柱为5 μm 4.6×250 mm Gemini C18柱对样品进行液相分离。用流动相A(5%ACN pH9.8)复溶抽干的肽段样品并进样,以1mL/min 的流速梯度洗脱:5% 流动相B(95%ACN,pH9.8)10 min,5%~35%流动相B 40 min,35%~95%流动相B 1 min,流动相B持续3 min,5%流动相B平衡10 min。在214 nm波长下监测洗脱峰并每分钟收集一个组分,结合色谱洗脱峰图合并样品得到20个组分,然后冷冻抽干。
1.2.6 高效液相 将抽干的肽段样品用流动相A(2%ACN,0.1%FA)复溶,20 000g离心10 min后,取上清进样。通过Thermo 公司UltiMate 3000 UHPLC 进行分离。纳升液相分离末端直接连接质谱仪。
1.2.7 质谱检测 经过液相分离的肽段通过nanoESI源离子化后进入到串联质谱仪Q-Exactive HF X(Thermo Fisher)进行DDA(data-dependent acquisition)模式检测。主要参数设置:离子源电压设置为1.9 kV;一级质谱扫描范围350~1500 m/z;分辨率设置为60 000;二级质谱起始m/z固定为100;分辨率15 000。二级碎裂的母离子筛选条件为:电荷2+到6+,峰强度超过10 000的强度排在前20的母离子。离子碎裂模式为HCD,碎片离子在Orbitrap中进行检测。动态排除时间设定为30 s。AGC设置为:一级3E6,二级1E5。
1.3 生物信息学统计
原始质谱数据经过相应工具转换成mgf格式文件后,用蛋白质鉴定软件Mascot2.3.02比对相应数据库搜索鉴定。质控分析同时进行以判断本次数据是否合格。数据合格后经过一定的筛选阈值,得到最终可信的蛋白质鉴定结果。随后进行iTRAQ定量分析,从定量结果中筛选出显著差异蛋白。然后进行GO、Pathway、COG/KOG等功能注释和差异蛋白的GO、Pathway富集分析、COG/KOG功能注释、聚类分析,蛋白互作分析(PPI)、亚细胞定位分析。
1.4 荧光定量PCR
采用SYBR green Ⅱ预混液于荧光定量PCR 仪上进行测定。GAPDH 基因作为内对照。基因引物序列以“NCBInr Accession”为条目在PrimerBank上进行检索得到(表1)。

表1 PCR引物序列Tab.1 PCR primer sequence
1.5 统计学分析
应用IBM SPSS Statistics 25统计软件进行数据处理,计量资料采用均数±标准差表示,计数资料用例(百分数)表示,两组间比较采用独立样本t检验,采用Fisher精确性检验单个条目富集程度的显著性水平。以P<0.05为差异具有统计学意义。
2 结果
2.1 病理切片
共有22例样本进行病理检查,根据病理结果严格筛选具有典型病理表现的样本,其中NASH样本中可见明显脂滴、气球样变、炎症,NAS评分≥5。共筛选出正常对照样本3例及NASH样本3例(表2、图1)。
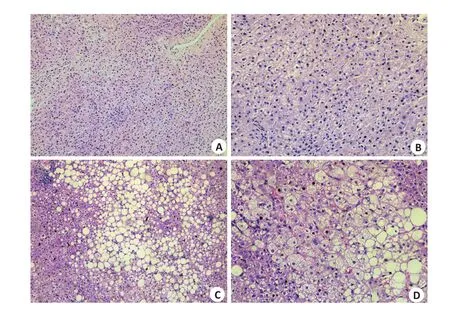
图1 人源肝脏组织病理切片Fig.1 Histopathological examination of the liver tissue specimens (HE staining).A:Control group(Original magnification:×100).B:Control group(×200).C:Case group(×100).D:Case group(×200).

表2 临床标本基本信息Tab.2 Basic information of clinical specimens
2.2 蛋白质样本质检
两组肝脏标本经裂解后获得蛋白质样本,Bradford定量法测定蛋白质浓度,蛋白总量c≥300 μg,蛋白总量满足3次或者3次以上实验需求的样品。取一定量蛋白质样本进行聚丙烯酰胺凝胶电泳显示胶图完整,重复性高,高丰度蛋白含量低,为一等标本(图2)。

图2 聚丙烯酰胺凝胶电泳检测结果Fig.2 Results of polyacrylamide gel electrophoresis.Lanes 1-3:NASH group;Lanes 4-6:Control group;Lane 7:Second-class control sample.
2.3 差异蛋白
按照单次实验的显著差异倍数(>1.2或<0.83)且P<0.05共筛选出648个差异蛋白,其中246个上调蛋白,402个下调蛋白(图3)。调整差异倍数Foldchange>2.0且Foldchange<0.5 和Q value/Pvalue<0.05 筛选出25个显著差异表达蛋白如表3所示。

图3 差异蛋白火山图Fig.3 Volcano plot of the differential proteins.The X-axis is the fold difference of the proteins (log2),and the Y-axis the corresponding-log10 (Q value).The red points are significantly up-regulated proteins,the green points are significantly down-regulated proteins,and the gray points are proteins that have no significant changes.
2.4 差异蛋白GO富集分析及KEGG通路富集分析
GO功能富集分析结果显示,差异表达蛋白主要参与小分子代谢(32.35%)、有机酸代谢(20.96%)、含氧酸代谢(20.59%)等生物学过程,在代谢途径(27.65%)、补体凝血级联(7.78%)、核糖体(7.78%)等KEGG通路上富集(图4)。

图4 差异蛋白的Pathway富集分析Fig.4 Pathway enrichment analysis of the differential proteins.
2.4 荧光定量PCR结果
荧光定量PCR对差异倍数(>2.0或<0.5)且P<0.05的25个显著差异表达蛋白进行筛选,共有6个蛋白与蛋白组学的结果趋势一致,包括5个下调蛋白,Jumonji 蛋白(JARID2)莱伯西林样蛋白(LCA5L)、突触素1(SYN1)及胶原α-1(XIII)链(COL13A1)、FYVE,Rho-GEF 和PH 结构域蛋白5(FGD5)、谷胱甘肽S-转移酶Mu 4(GSTM4),1个上调蛋白GSTM4。
3 讨论
NASH是非酒精性脂肪性肝病中的重要环节,而寻找NASH发病理机制的关键靶点一直是临床和科研尚未解决的问题。众多研究通过人体血液样本进行蛋白组学筛选差异蛋白,但血液中蛋白种类丰富,易受高丰度蛋白影响,而用小鼠肝脏或血液样本,会遇到高脂饮食造模小鼠饮食结构、遗传背景的不同造成组织差异性,其得到结果难免导致偏差。本研究根据病理检查NAS评分筛选入组标本,使其结果更可靠。
用iTRAQ技术标记人源肝脏蛋白,通过生物信息学技术分析,按照单次实验的显著差异倍数(>1.2 或<0.83)且P<0.05共筛选出648个差异蛋白,其中246个上调蛋白,402个下调蛋白,主要参与小分子代谢、有机酸代谢、含氧酸代谢等生物学过程,在代谢途径、补体凝血级联、核糖体等KEGG 通路上富集。从NAFL 到NASH过程中,肝脏受到炎症因子的刺激,从而引发肝脏损害,出现肝细胞坏死过程。肝脏炎症的诱因可能来自肝脏之外,如内毒素以及脂肪组织诱导巨噬细胞产生的C-C基型趋化因子2(CCL2)和TNF等。也可能来自器官内部,脂肪毒性、先天免疫反应、细胞死亡途径、线粒体功能障碍和内质网应激[15,16]。本次研究中GO富集分析中发现其在代谢过程中出现脂肪组织炎症、脂肪因子及胆汁酸刺激,是引起肝脏炎症反应的主要原因。编码补体C1q肿瘤坏死因子相关蛋白2(C1QTNF2)在本次发现中为显著上调的差异蛋白,与脂联素的作用极为相似,是一种在肝脏中具有代谢作用的分泌型脂肪细胞因子,还有研究表明C1QTNF2是芹菜素抗纤维化活性的潜在介体,在以星状细胞为靶点的抗纤维化药物中再次利用[17]。C1QTNF2抗纤维化作用得到证实,可以推测C1QTNF2在NASH中同时具备抗纤维化抗炎作用,这对NASH 的治疗靶点具有重要意义,而该蛋白在NASH中并无研究。另外,本次研究发现的胆盐活化脂肪酶(CEL)、溶质载体有机阴离子转运蛋白家族成员1B1(SLCO1B1)、酰基辅酶A合成酶(SLC27A5),磷脂酰胆碱转运蛋白(ABCB4)与胆汁酸代谢相关,既往研究表明BAs 通过farnesoid X 活化受体和G 蛋白偶联BA受体1(TGR5)对脂质和碳水化合物代谢具有重要的调节作用,如果失调,会导致糖和脂质稳态的改变,并促进炎症和纤维化,这些BAs同样为本次研究的显著差异蛋白,其发挥作用的方式值得进一步探索。
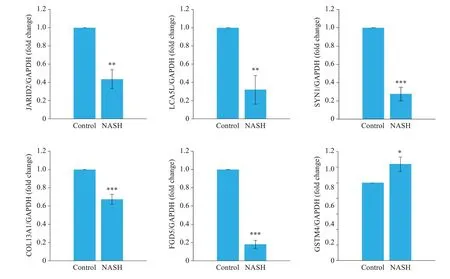
图5 差异蛋白qPCR结果Fig.5 qPCR results of the differential proteins.*P<0.05,**P<0.01,***P<0.001 vs control.
通过蛋白层面及基因层面共同筛选出显著差异表达蛋白有5个下调蛋白,Jumonji 蛋白(JARID2)、莱伯西林样蛋白(LCA5L)、突触素1(SYN1)及胶原α-1(XIII)链(COL13A1)、FYVE,RhoGEF和PH结构域蛋白5(FGD5),以及1个上调蛋白谷胱甘肽S-转移酶Mu 4(GSTM4)。
Jumonji 蛋白(JARID2)为组蛋白甲基转移酶复合物的调节剂,有研究表明H3K9me3和H3K4me3对肝细胞表观遗传学的调节可能参与肝脏脂肪变性和NAFLD的发病机制[18,19]。该研究在DNA微阵列和芯片上检查肝脏转录组图谱和三甲基化改变,发现肝脏脂肪积聚诱导过氧化物酶体增殖物激活受体α和肝脏脂肪分解网络基因H3K9me3 和H3K4me3 处于异常状态,使其mRNA表达较未处理的对照肝细胞降低,结果与本研究一致。JARID2作为显著下调蛋白,有可能参与NASH的炎症发生,值得进一步研究。莱伯西林样蛋白(LCA5L)相关研究很少,对其功能并不清楚。越来越多的研究表明高脂肪饮食诱导的肥胖会影响突触素1(SYN1)从而影响大脑的可塑性和认知功能[20,21]。在以突触素1(SYN1)-CRE驱动程序建立的一个在所有神经元中GHSR基因缺失的小鼠系[22]中发现,神经元GHSR缺失通过调节能量消耗来阻止了食物诱导的肥胖,由此可见突触素1与高脂饮食的摄入密切相关。胶原α-1(XIII)链(COL13A1)在一项全基因组关联研究[23]中发现COL13A1中的变异SNP与高甘油三酸酯相关,且墨西哥的研究[24]中同样得出COL13A1 rs1227756基因变异与混合血统的墨西哥成年人中NAFLD/ALT水平升高的风险显著相关。而该基因的作用在一项中国儿童的研究[25]中未发现,但在本次研究中标本来源均为成人,其研究结果可为COL13A1在成人非酒精性脂肪肝中的作用进行有力补充。FYVE,RhoGEF和PH域包含5(FGD5)是一种蛋白质编码基因,以往研究发现FGD5与心脏病变[26]和乳房疾病[27]密切相关,可在新血管的形成时进行血管修剪,有助于组织修复过程中的器官发育,以应对机械损伤、炎症和缺血[28]。NASH的发生也与炎性因子的释放诱导了炎症的许多信号级联反应有关[29],并且血管生成已被证明在慢性肝病的进展中起着重要作用[30],FGD5 在NASH 中的表达是正常组织的0.49倍,可推测FGD5也参与NASH发生的炎症反应。谷胱甘肽S-转移酶Mu 类为基因编码II 期代谢酶,GSTM基因中的遗传多态性与人群的疾病表型相关,有研究表明与高加索人NASH患者相比,非洲裔NASH患者GSTM4基因过度表达[31]。GSTM4在抗氧化和解毒方面有重要作用,与肝脏关系极大,并且在组织和血清中均能够被检测,是对疾病进行预后随访良好的生物标记物。
综上所述,本研究通过同位素标记相对和绝对定量的蛋白质组学研究筛选出648个显著差异蛋白,主要参与小分子代谢、有机酸代谢、含氧酸代谢等生物学过程,在代谢途径、补体凝血级联、核糖体等KEGG通路上富集,其中显著差异蛋白:JARID2、SYN1、COL13A1、FGD5、GSTM4可作为关键靶向蛋白。但是本研究样本量较少,仅对肝脏中所检测到的差异蛋白进行初步筛选,后续将扩大样本量在活检组织标本中进一步证实。
