超声影像特征Logistic回归模型对腮腺良恶性病变的预测价值*
2021-10-14陈开良黄利刘玉袁振亚吴文婷
陈开良, 黄利, 刘玉, 袁振亚, 吴文婷
(1.海南医学院第一附属医院 超声科, 海南 海口 570102; 2.海南医学院第一附属医院 乳腺胸部肿瘤外科, 海南 海口 570102; 3.海南医学院第一附属医院 病理科, 海南 海口 570102)
腮腺局灶性病变组织病理类型较多,大体分为良性与恶性。正确区分腮腺良恶性病变,对处理十分重要[1-2]。外科手术切除是腮腺病变的主要治疗手段, 术前对腮腺良恶性肿瘤的鉴别对临床治疗方案的选择至关重要。腮腺肿瘤位置表浅,影像学诊断对腮腺肿瘤的定位和定性有较高价值,其中彩色多普勒超声是诊断腮腺肿瘤的重要手段之一,但对良恶性鉴别诊断的效能还不够理想[3-4]。文献报道通过超声弹性成像和超声造影鉴别腮腺良、恶性肿瘤有很高的准确率,敏感性和特异性分别为80.0%与 91.8%,84.6%与96.0%[5-6]。然而,超声造影与弹性成像成本较高或耗时,而且还有相当一部分医院还未常规开展,因此,常规彩色多普勒超声影像仍然是基本的检查方法。本研究拟对腮腺局灶性病变的超声表现特征进行筛选,建立二分类Logistic回归模型,探索一种科学的方法用于腮腺病变评估,进一步提高彩色多普勒超声影像对腮腺良恶性病变的诊断水平。
1 资料与方法
1.1 资料
1.1.1对象 选取2015年1月—2020年11月行超声检查发现腮腺结节的患者231例(共231个病灶),男150例、女81例,年龄8~85岁、平均(48.83±15.54)岁,瘤体长径0.8~6.4cm、平均(2.67±1.06)cm,瘤体垂直径0.5~3.9 cm、平均(1.66±0.65)cm。
1.1.2仪器 采用仪器为美国GE公司的 LOGIQ E9、德国SIEMENS公司的 Acuson S2000、中国迈瑞公司DC-8彩色多普勒超声诊断仪,线阵探头频率3~12 MHz、5~12 MHz或6~15 MHz。
1.2 检查方法
检查时,患者取仰卧位、头部偏向健侧,将探头直接接触皮肤对腺体进行扫查,确定病灶位置后,通过纵、横、斜多切面观察并记录病灶的边界、形态、内部回声及其分布、液化、钙化、后方回声、血流分级及血流模式。由2名工作10年以上的超声医师通过盲法回顾性分析入选患者的超声影像资料,当意见不一致时,经2人讨论达成共识。超声影像特征诊断认定标准:病灶的边界分为清晰、不清晰,形态分规则(类圆形或椭圆形)、不规则(成角、分叶或毛刺);病灶内部回声参考Kim[7]等主张的回声进行分级,Ⅰ为极低回声(低于邻近颈前肌肉回声)、Ⅱ为低回声(高于颈前肌肉但低于腮腺病灶周围正常腺体回声)、Ⅲ为等回声、Ⅳ为高回声,回声分布分为均匀、不均匀,将病灶内的强回声定义为钙化、病灶内的无回声定义为液化,后方回声分增强及非增强(无改变或衰减);病灶内血流信号参考文献[8]进行分级(0级为未见血流信号,Ⅰ级为少量、星点状血流或1支血管,Ⅱ级为较丰富血流、短棒状或条状血流2~3支,Ⅲ级为丰富血流、可见4支或以上血管向病灶内延伸、或交织成网),0~Ⅰ级定为血流信号不丰富、Ⅱ~Ⅲ级定义为血流信号丰富;血流模式参考文献[9]分为边缘型、中央型、混合型及缺失型。
1.3 观察指标
231个病灶按照经病理结果分为良性组和恶性组,比较2组病灶的腮腺肿块超声特征(边界、形态、内部回声、回声分布、液化、钙化、后方回声、血流分级及血流模式);用有统计学差异的指标建立Logistic回归模型,绘制受试者工作特征(ROC)曲线,以ROC曲线下面积(AUC) 评估模型相关指标评价对腮腺病变良恶性预测价值。
1.4 统计学方法

2 结果
2.1 腮腺良恶性病变术后病理分型
231个腮腺局灶性病变术后组织病理结果显示,良性175个,恶性56个。见表2。

表2 231个腮腺局灶性病变良恶性病理分型
2.2 腮腺病灶的超声特征
本组56例恶性病变和175例良性病变的边界、形态、内部回声、回声分布、液化、钙化、后方回声等指标进行比较,差异均有统计学意义(P<0.05);两组的血流分级和血流模式比较,差异无统计学意义(P>0.05)。见表3。两组腮腺病灶的二维超声图见图1。
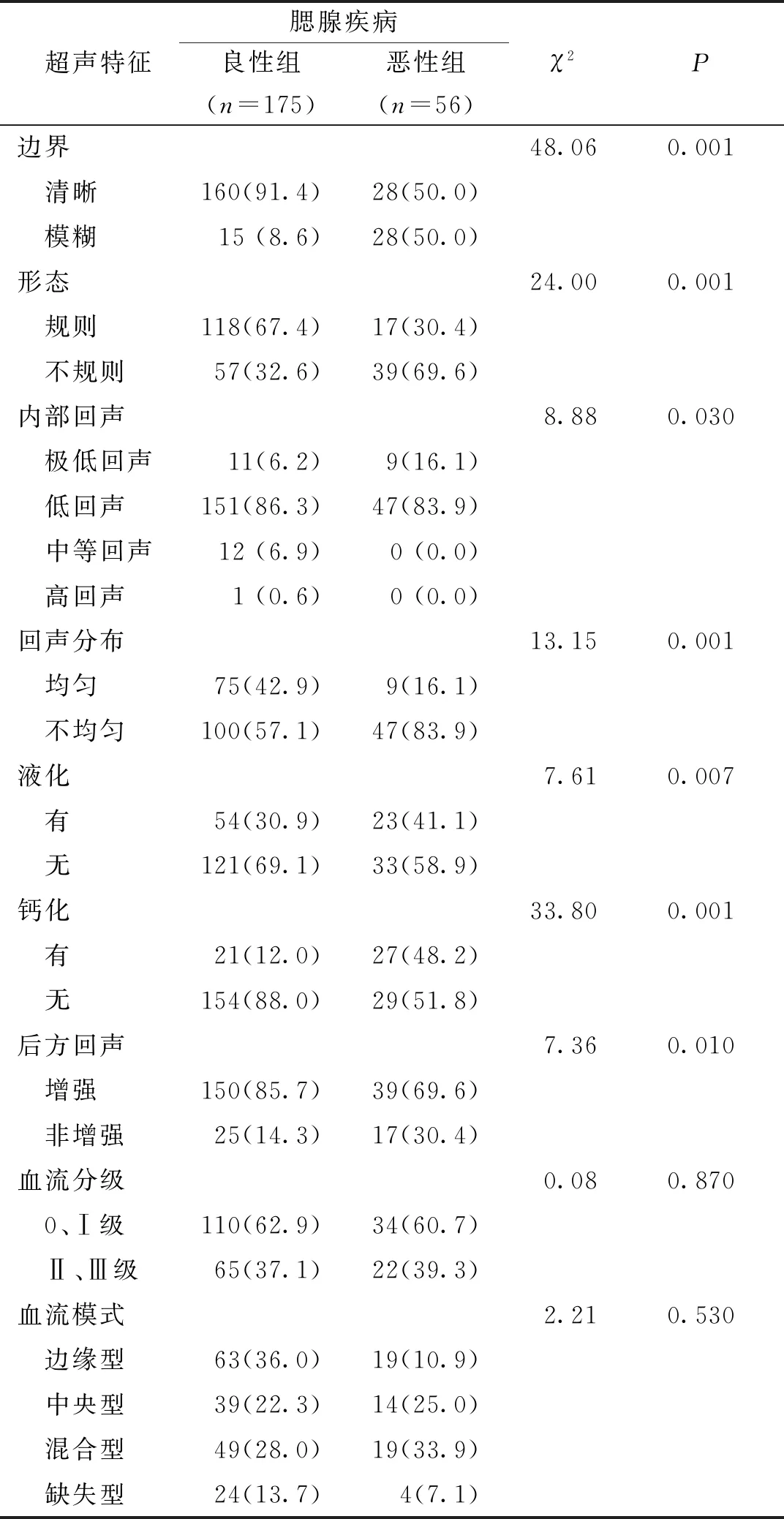
表3 两组肿块的超声特征指标比较[n(%)]
2.3 Logistic回归模型
以差异有统计学意义的自变量(边界、形态及钙化)进行二分类Logistic回归分析结果显示,几个变量P<0.05(表4),进一步构建的回归模型为Logit(P)=-2.784+1.959X1+1.166X2+1.937X6,P<0.001(表4)。模型中各自变量的OR值从高到低的排列顺序:边界(X1)>钙化(X6)>形态(X2)。利用该模型对上述231例病灶进行预测,如果回归值>0.5、预报为腮腺恶性病变,回归值≤0.5、预报为腮腺良性病变,则模型预测腮腺病变的敏感性为73.9%,特异性为88.1%,准确性为85.3%,阳性预测值为60.7%,阴性预测值为93.1%。
2.4 ROC曲线及AUC
以模型预测腮腺恶性病变的概率值绘制ROC曲线(图2),AUC为0.835、标准误为0.035、95%CI为0.767~0.903 ,P<0.05,提示以边界、形态和钙化三项超声特征建立的Logistic回归模型对预测腮腺恶性病变具有较高价值。
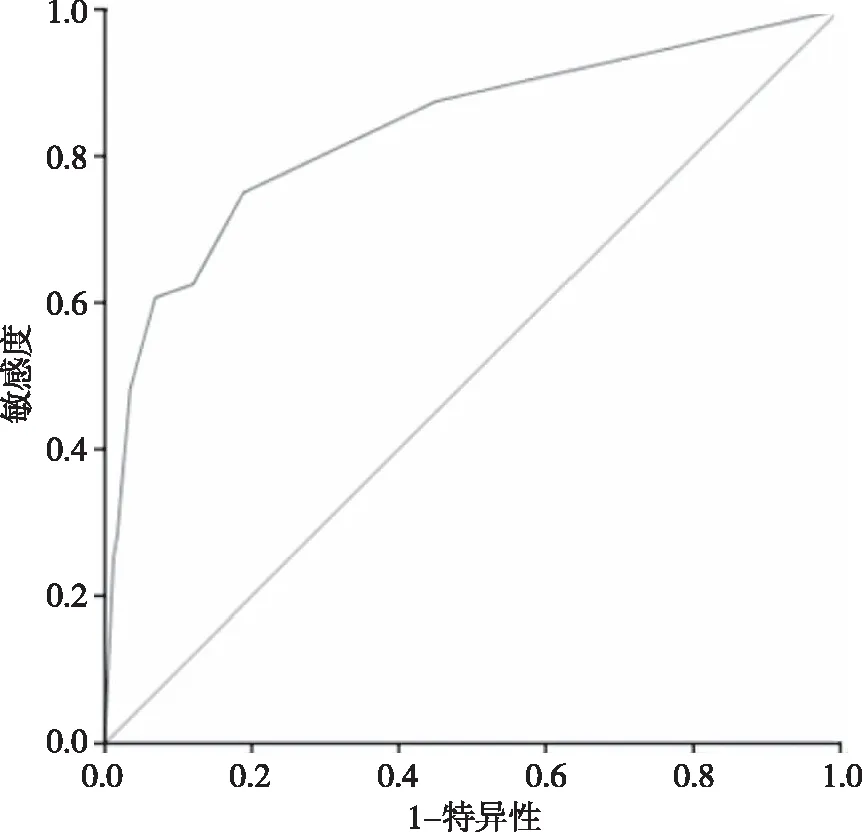
图2 对Logistic回归模型预测腮腺恶性病变的ROC曲线
3 讨论
腮腺良恶性病变的治疗需要根据具体情况而定。腮腺慢性炎症病变和良性肿瘤中较小者可以保守治疗和观察,不需要手术,较大者一般将瘤体及部分腺体切除即可;腮腺恶性肿瘤则常需进行根治术[10-12]。虽然腮腺病变位置表浅可以用手触及,但定性诊断还是困难。目前不主张术前行组织学穿刺活检术进行腮腺病变诊断[13-15],影像学评估是必然的选择。之前研究显示,彩色多普勒超声分辨率高、可重复性好、无辐射、无创,对腮腺良恶性病变鉴别诊断有较高价值[16-18],但也有研究持相反意见,认为腮腺良恶性病变的彩色多普勒超声表现复杂、多样,有较多重叠性,鉴别诊断价值有限[19-21]。
本研究通过二元Logistic回归分析,筛选出边界、形态及钙化3个特征自变量,其回归系数均>1,P<0.05,提示这3个特征变量在鉴别腮腺良恶性病变中最有价值,即边界不清,形态不规则(成角、分叶或毛刺)及钙化灶这3项超声特征,在一个腮腺病变出现越多,则病变恶性可能性越大。本研究中, 以模型预测腮腺恶性病变的概率值绘制ROC曲线,AUC为0.835,95%CI为0.767~0.903,表明使用该模型预测腮腺恶性病变的准确性较高,虽然还不够理想,但数学模型预测具有方便、快捷,能明显增加检查者鉴别腮腺良恶性病变的信心。
本研究通过Logistic回归模型得出3个超声特征自变量的OR值,从大到小排列顺序为边界(7.090)>钙化(6.936)>形态(3.211),提示边界不清在诊断腮腺恶性病变的超声特征中价值最高。此征象可能与大部分的恶性病变的生长方式相关,通常恶性病变呈浸润性生长,侵犯邻近正常组织,另外,与绝大部分腮腺良性病变存在包膜不同,腮腺恶性病变绝大多数并无包膜,这才导致瘤体与周围组织边界的不清。本研究结果中关于病变边界的诊断价值与王丽华等[22]研究报道结果一致。
从本研究的单因素分析结果来看,腮腺良性病变中出现钙化占10.7%(19/176),多为粗大斑片状强回声;而腮腺恶性病变中出现钙化占51.8%(29/56),多呈细小点状强回声斑。腮腺良、恶性病变钙化在形状上的差别,主要原因是前者为一种退化性钙化,后者则是肿瘤局部存在钙磷代谢异常的结果[10、15]。本回归模型各自变量的OR值排列中,显示诊断腮腺恶性肿瘤钙化是仅次于边界的第二敏感因素。本研究结果中关于肿瘤内钙化的诊断价值与Fenesan等[23]研究报道结果一致。
本回归模型提示,形态也是鉴别腮腺良、恶性病变的一个重要指标。在单因素分析中,腮腺良性病变中形态多规则,占67.6%(119/176),呈类圆形或椭圆形;而腮腺恶性病变中形态多不规则,占64.3%(36/56),呈分叶、成角或毛刺状。本研究发现与David等[24]报道的认为通过超声的形态不规则来判断腮腺病变良恶性有较高的准确性的结果一致。腮腺良、恶性病变在形态上的区别,可能与它们不同的生物学行为有关。腮腺恶性病变,多呈浸润性生长,分化失衡,侵犯其周围组织结构,致使其形态不规则;而腮腺良性病变呈膨胀性生长,形态往往规则,多表现为圆形或椭圆形。但王晓荣等[25]等也指出,多形性腺瘤很多时候形态不规则,呈分叶状,其原因是瘤体内局部密度不均,周围对其挤压不均衡造成的。
综上所述,本研究通过建立二元Logistic回归模型,得出边界、形态和钙化三项超声表现特征对腮腺病变良恶性诊断有较高价值。当腮腺病变的常规超声呈现边界不清,形态不规则及钙化时,应高度怀疑为恶性。应用腮腺超声特征Logistic回归模型分析腮腺病变以提高恶性病变的检出率具有更好的客观性和科学性。但本研究的不足之处在于,恶性病变样本量偏少,研究结果可能会产生偏移。因此,该研究仍需多中心、更大样本量进一步验证回归模型的预报能力和价值。
