TPK3基因敲除对酿酒酵母耐受性的影响
2021-10-13刘凯毅任剑星张晓晓董胜胜董健
刘凯毅,任剑星,张晓晓,董胜胜,董健
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
酿酒酵母(Saccharomyces cerevisiae)是一种单细胞的真核微生物,其形态大多为椭圆形、球形、腊肠形以及卵圆形。酿酒酵母常用于制作面包及啤酒、白酒葡萄酒等产品。近年来,在工业产业的不断发展的进程中,社会对可持续化绿色发展的要求随之不断增长,从而带动了生物燃料的发展,因此社会对生物乙醇的需求不断地上升。在酒精发酵生产的过程中,酿酒酵母发酵速度快,产酒精浓度高,因此,酿酒酵母作为一种工业生产微生物,在酒精发酵产业中具有广泛的应用[1]。在酿酒酵母发酵生产乙醇的过程当中,由于发酵过程的动态变化,酿酒酵母暴露于多种胁迫因子中,例如高温、乙醇、渗透压、乙酸等,在胁迫环境中其生长代谢受到抑制[2]。在酿酒酵母中,第二信使环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和蛋白激酶 A(protein kinase A,PKA)在代谢调控、应激抗性和细胞周期调控中起着重大的作用[3-7]。蛋白Gpa2和Ras2可以调控由CYR1编码的腺苷酸环化酶(adenylate cyclase,AC),从而催化 cAMP 的合成[8]。蛋白激酶A(PKA)为Ras-cAMP信号通路的下游主要靶标[9],cAMP含量的增加,导致PKA的调节亚基与催化亚基解离,使得PKA催化亚基参与其下游转录因子的磷酸化过程,引起一系列的胞内反应。PKA会对其下游效应物产生磷酸化作用,通过这种磷酸化作用,对细胞生长代谢及其应激反应进行调控[10-11]。PKA的下游效应物主要有 Rap1、Hsf1、Adr1、Msn2/Msn4、Ssn2 等转录因子[12-13]。现有研究表明,在酿酒酵母处于胁迫环境当中,通过信号转导产生应答机制,以此对外界胁迫环境产生一定耐受性能。酿酒酵母蛋白激酶A(PKA)可反向调控其耐受性[14-19],蛋白激酶A(PKA)是一种异源四聚体蛋白,在结构组成上,它包括由BCY1基因编码的两个调控亚基和由TPK1、TPK2、TPK3编码的催化亚基[20]。因此在理论上通过弱化PKA活性,来提高酿酒酵母的耐受性。
本试验利用基因工程手段重组菌株,即通过基因工程手段改造菌种,敲除编码酿酒酵母蛋白激酶A催化亚基的TPK3基因,实现PKA活性的弱化,以此改善酿酒酵母对外界环境胁迫因子的耐受性能。
1 材料与方法
1.1 试验菌株、试剂、仪器
1.1.1 菌种
AY12a:天津科技大学生物工程学院现代酿造技术研究室;AY12a-2:本研究中AY12a的TPK3基因敲除菌株。
1.1.2 试剂
葡萄糖、氯化钠(分析纯):天津索罗门生物科技有限公司;蛋白胨、酵母浸粉(生化试剂):北京华威锐科化工有限公司;冰乙酸(分析纯):上海阿拉丁生化科技股份有限公司;乙醇(分析纯):天津联星化工有限公司;乙酸钾(生化试剂):北京伊诺凯科技有限公司;rTaq DNA聚合酶(生化试剂):TaKaRa公司。
1.1.3 仪器
HS-1300-V型超净台:苏州安泰空气技术有限公司;AB204-S型分析天平:梅特勒-托利多仪器上海公司;TgL-16C台式离心机:上海安亭科技仪器厂;BX43型生物显微镜:日本OLYMPUS会社;PowerPacTM型电泳仪、PCT-200聚合酶链式反应基因扩增仪:美国BIO-RAD公司;UVmini-1240紫外分光光度计:岛津仪器(苏州)有限公司;Bioscreen C全自动生长曲线分析仪:芬兰Oy Growth Curves Ab公司;IS-RDS3恒温摇床:上海制成仪器制品有限公司。
1.1.4 主要培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:20 g/L 葡萄糖、20 g/L 蛋白胨、10 g/L酵母浸粉,加入蒸馏水定容,可加入20 g/L的琼脂粉配制为固体YPD培养基,高压灭菌锅115℃灭菌20 min。
SD培养基:20 g/L葡萄糖、6.7 g/L无氨基酵母氮源、1.3 g/L尿嘧啶,加入蒸馏水定容,可加入20 g/L的琼脂粉配制为固体YPD培养基,高压灭菌锅115℃灭菌20 min。
耐乙醇培养基:20g/L葡萄糖、20 g/L蛋白胨、10 g/L酵母浸粉、20 g/L琼脂粉,蒸馏水配制,pH值自然,115℃灭菌20 min,将其冷却至35℃~40℃后加入10%的乙醇。
耐盐培养基:80 g/L氯化钠、20 g/L蛋白胨、20 g/L葡萄糖、10 g/L酵母浸粉、20 g/L琼脂粉,加入蒸馏水定容,高压灭菌锅115℃灭菌20 min。
耐乙酸培养基:20g/L葡萄糖、20 g/L蛋白胨、10 g/L酵母浸粉、20g/L琼脂粉,加入蒸馏水定容,高压灭菌锅115℃灭菌20 min。将其冷却至35℃~40℃加入0.4%的乙酸。
1.2 方法
1.2.1 菌株的构建
1.2.1.1 引物合成与设计
本试验引物设计根据NCBI和Primer5.0,通过查询NCBI得到TPK3基因组序列,再利用Primer5.0软件设计出所需要的引物。具体引物序列见表1。

表1 试验过程中使用的引物Table 1 Primers used in the experiment
1.2.1.2 目的片段的扩增
将出发菌株AY12a的基因组为模板,使用引物对TPK3-U-F/TPK3-U-R和TPK3-D-F/TPK3-D-R,扩增TPK3(U)和 TPK3(D)上下同源臂,以及 TPK3-KanMX片段。从NCBI数据库中查询单端基因片段分别为626、686、1 645 bp。
1.2.1.3 突变株的获得
通过 LiAc 转化法[18,21]将目的片段 TPK3(U)、TPK3(D)、TPK3-KanMX导入酿酒酵母AY12a后,提取转化子基因组为模板,并以出发菌株AY12a基因组为阴性对照,利用验证引物Y-TPK3-U-F/Y-TPK3-U-R和Y-TPK3-D-F/Y-TPK3-D-R对转化子通过聚合酶链式反应(polymerase chain reaction,PCR)验证。具体操作示意图见图1。
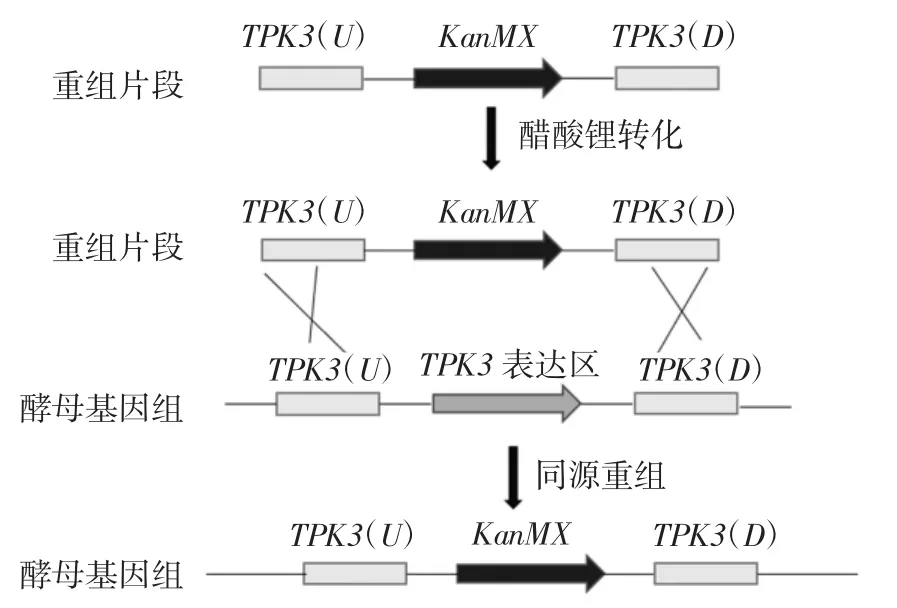
图1 敲除TPK3基因的构建过程Fig.1 The construction process of knockout TPK3 gene
1.2.2 酿酒酵母细胞生长性能测定
本试验通过生长曲线测定仪测量OD600值,以此确定酿酒酵母生长曲线,步骤如下所示。
1)取适量菌体接种至新鲜YPD液体培养基中,30℃、180 r/min于恒温摇床中活化培养12 h。
2) 将活化后的菌液按照 0、2、4、6、8 μL 的梯度用移液枪按梯度打到100孔板里,并用YPD培养基补至200 μL。
3)将加有菌液的100孔板放置于生长曲线测定仪中,设置温度为30℃,测定频率为每30 min一次,总测定时间为24 h。
4)测定完成后,分析详细数据,将横坐标定为时间,纵坐标定为OD600值,以此作酵母生长曲线图。
1.2.3 酿酒酵母细胞耐受性的测定
通过点板试验测量酵母的耐受性[22]。首先将所测菌株的初始OD600调至一致,保证菌株初始浓度的一致性,然后将菌液以不同浓度梯度点板,每个梯度点2 μL的菌液到耐受性平板上,30℃培养1 d~2 d,观察菌株生长情况,将出发菌株作参照对比组,对比判断突变菌株对胁迫因子的耐受程度,以此分析突变菌株的相关耐受性。
1)耐热击性:将菌株于55℃下水浴处理4 min,将2 μL的热击处理菌液按不同浓度梯度吸取并点到YPD平板,30℃培养2 d~3 d,观察平板上菌落生长情况,并以此分析菌株对高温胁迫因子耐受性的变化。
2)耐乙醇性:将2 μL的菌液按不同浓度梯度吸取,并将其点到含有10%乙醇的耐乙醇培养基的平板上,30℃培养2 d~3 d,观察平板上菌落生长情况,并以此分析菌株对乙醇胁迫因子耐受性的变化。
3)耐盐性:将2 μL的菌液按不同浓度梯度吸取,并将其点到含有8%NaCl的耐盐培养基的平板上,30℃培养2 d~3 d,观察平板上菌落生长情况,并以此分析菌株对高渗高盐胁迫因子耐受性的变化。
4)耐乙酸性:将2 μL的菌液按不同浓度梯度吸取,并将其点到含有0.4%乙酸的耐盐培养基的平板上,30℃培养2 d~3 d,观察平板上菌落生长情况,并以此分析菌株对乙酸胁迫因子耐受性的变化。
1.2.4 乙醇、葡萄糖含量测定
试验选择示差液相色谱仪测定酵母发酵完成后乙醇的产生量及葡萄糖的剩余量[23],具体测定条件如下。
样品预处理:发酵结束后,将发酵液在12 000 r/min条件下离心2 min,取上清液过膜加到液相小瓶。
色谱条件:使用Bio-Red的Aminex HPX-87H色谱柱,并将柱温调至为60℃,进样10 μL,流动相为0.6 mL/min过滤超声的5 mmol/L的稀硫酸。
1.2.5 液体发酵工艺
为测定改造菌的发酵性能,采用液体发酵工艺,其主要操作步骤如下。
1.2.5.1 制备玉米水解液
取1 kg的玉米粒,加入3 L预热到60℃~70℃的水,静置20 min,糊化玉米粒,并使玉米颗粒充分吸水膨胀利于液化,加入0.6 mL液化酶(α-淀粉酶2×105U/mL),于85℃~90℃的水浴锅中液化1.5 h,其间每30 min搅拌一次,从而提高液化效率,待液化结束后,静置至55℃~60℃,再加入2 mL糖化酶(200 U/mL),进行糖化20 h,同样进行搅拌。待玉米颗粒充分糖化结束后,将其过滤,分离玉米渣获取玉米水解液,分装,105℃高压灭菌锅灭菌20 min,冷却至25℃左右,密封保存使用。
1.2.5.2 准备种子培养基
一级种子培养基:在糖度为8°Bé玉米水解液中加入0.5%的酵母浸粉,并于试管中分装6 mL,然后利用高压灭菌锅105℃灭菌20 min,冷却至25℃左右,接种菌体,30℃培养箱静置培养24 h。
二级种子培养基:在糖度为12°Bé玉米水解液中加入0.5%的酵母浸粉,并于三角瓶分装54 mL,然后利用高压灭菌锅105℃灭菌20 min,降至25℃左右,然后培育24 h的一级种子液全部加入准备好的分装三角瓶中,30℃培养箱静置培养16 h。
1.2.5.3 液体发酵
将玉米水解液的糖度调到20°Bé,于每个三角瓶分装135 mL,于105℃下高压灭菌20 min,降至25℃左右,将15 mL二级种子液接到其中,同时加入1 mL的营养盐,30℃培养箱静置发酵,每隔12 h称重1次,记录CO2失重量,当12 h的CO2失重量稳定在0.1 g左右时,将三角瓶转移出培养箱,结束发酵过程。
2 结果与分析
2.1 获得并验证目的片段
将出发菌株AY12a的基因组作为目的基因片段的扩增模板,使用引物对TPK3-U-F/TPK3-U-R和TPK3-D-F/TPK3-D-R,扩增 TPK3(U)和 TPK3(D)上下同源臂,以及TPK3-KanMX片段。3段片段的长度分别为626、686、1 645 bp。利用琼脂糖凝胶电泳检验片段的长度检验图见图2。

图2 转化所需片段Fig.2 The transformation of the fragments
2.2 突变株获得的验证
通过 LiAc转化法将目的片段 TPK3(U)、TPK3(D)、TPK3-KanMX导入酿酒酵母AY12a后,提取转化子基因组为模板,并以出发菌株AY12a基因组为对照,利用验证引物Y-TPK3-U-F/Y-TPK3-U-R和YTPK3-D-F/Y-TPK3-D-R对转化子通过PCR反应验证。将PCR获得的产物通过琼脂糖凝胶电泳验证,验证图见图3。

图3 转化子的验证Fig.3 The verification of transformants
由图3显示结果可知,条带长度与NCBI数据库一致,即完成重组菌株AY12a-2的构建。
2.3 突变株AY12a-2与出发菌株AY12a生长性能的比较
为检验突变株AY12a-2与出发菌株AY12a生长性能,采用1.2.2的方法,利用生长曲线测定仪,得到两株菌株的生长曲线图见图4。

图4 菌株的生长曲线Fig.4 Growth curve of strains
由图4可知,在30℃的培养条件下为突变株AY12a-2与出发菌株AY12a的生长曲线接近一致,在第4小时达到对数中期,到12 h达到稳定期,两株菌株在YPD中的生长性能接近相同,因此可进行下一步耐受性以及发酵性能的对比验证。
2.4 突变株AY12a-2与出发菌株AY12a耐受性的比较
为比较突变株AY12a-2与出发菌株AY12a耐受性,本试验按照方法1.2.3检测了55℃高温、10%高乙醇、8%高盐、0.4%高乙酸这4种环境胁迫因子对菌株生长的影响,从而对突变株的相关耐受性进行分析,结果见图5。

图5 菌株的耐受性Fig.5 Stress tolerance of strains
由图5可知,在没有添加任何胁迫因子的YPD中,突变株AY12a-2与出发菌株AY12a的菌落情况基本保持一致,表明在点板试验前这两株菌的初始浓度一致。经历55℃热击4min后,两株菌株在YPD的生长有明显区别,出发菌株在稀释梯度(10-3)已经受到明显抑制,与此同时重组菌株生长依旧良好,说明突变菌株耐热击性明显优于出发菌株。在10%的乙醇耐性培养基上,突变菌株与出发菌株皆受到不同程度的影响,单突变菌株的菌落大小明显大于出发菌株,由此可得突变菌株的耐乙醇性能略微提升。在0.4%的乙酸耐性培养基上,出发菌株在稀释梯度(10-3)已经受到明显抑制,与此同时重组菌株生长依旧良好,说明突变菌株耐乙酸性明显优于出发菌株。在8%NaCl的耐盐培养基上,出发菌株明显受到抑制,而突变菌株没有明显变化,说明8%NaCl对突变菌株没有产生胁迫作用。这些结果也印证了通过弱化PKA活性,来提高酿酒酵母的耐受性这一观点。
2.5 突变株AY12a-2与出发菌株AY12a的液体发酵
为对比检验突变菌株与出发菌株的发酵性能,本试验采用1.2.5的发酵方法模拟白酒液态发酵,并按照方法1.2.4对发酵结果进行分析,结果见表2。

表2 亲本菌株和改造菌株的发酵性能比较Table 2 Comparison of fermentation performance of original strain and transformation strain
由表2可知,发酵过程结束后,同等发酵时间内,突变菌株在发酵结束后剩余葡萄糖量较出发菌株葡萄糖剩余量少,CO2失重量有所增加,与此同时乙醇的产生量也对应提高了17.8%。说明突变菌株对葡萄糖的利用率有所提高。这表明在动态发酵过程中突变菌株对胁迫环境的耐受性优于出发菌株的耐受性,也从侧面表明了突变菌株的耐受性能得到一定提升,并与耐受性试验结果相符合。
3 结论
本试验将AY12a作为出发菌株,利用长引物桥出发,敲除与PKA活性相关基因TPK3,从而获得突变菌株AY12a-2,并对突变菌株及出发菌株进行生长性能,耐受性,以及发酵性能的测定,期望通过敲除TPK3基因,从而提高酿酒酵母的耐受性。结果表明,30℃的培养条件下,两株菌株生长性能基本一致。突变菌株的耐热击性能、耐乙酸性能及耐盐性明显优于出发菌株。同时发酵数据表明,同等发酵时间内,突变菌株的葡萄糖消耗量增加及CO2的失重量提升34%,乙醇产量增长了17.8%。总体来看,本试验当中突变菌株的耐受性以及发酵性能都相对有所提升,为工业酵母菌株耐受性的提高提供思路。
