原发性肝癌质子调强与光子螺旋断层放射治疗计划质量评估
2021-10-13方春锋田飞燕白中红徐寿平
侯 俊 方春锋 田飞燕 杨 文 白中红 杨 昊 曹 林 徐寿平
癌症已成为严重危害人类健康的重大疾病之一,其中肝癌居于2018年全球癌症死因第4位[1]。在国内原发性肝癌作为我国发病率较高的恶性肿瘤之一,单2015年新发肝癌患者就达46.6万例,死亡近42.2万例,超过世界原发性肝癌发病总例数的一半[2]。
螺旋断层放射治疗(helical tomotherapy,HT)作为一种新兴的类CT调强放射治疗技术,射线源发出的锥形束首先通过准直器形成扇形束,然后通过64对二进制气动光栅进行射束调制。安装在环形机架内可以连续旋转的小型加速器使得其可以在相当大范围角度及强度下的射线调制成为可能,从而在众多肿瘤放射治疗中显示出较明显的剂量学优势[3-4]。另一方面作为1种非传统光子的粒子外照射放射治疗模式,质子疗法(proton therapy,PT)因其在肝癌治疗中显著的剂量学优势,也逐渐成为临床应用的热点。质子束在人体组织内展现出1种有别于光子的特殊剂量分布-布拉格峰,使其质子束流在到达肿瘤前方部位时剂量远低于光子,而到达肿瘤深度时迅速集中释放大量能量,而使肿瘤后方剂量几乎为零,很好地保护了肿瘤后方的正常肝组织。同时来自欧美和日本的系统性回顾和前瞻性研究分析也表明PT治疗原发性肝癌具有良好的疗效和较低的毒副作用[5-8]。因此本文旨在研究原发性肝癌质子调强放疗(intensity modulated proton therapy,IMPT)与光子HT计划的剂量学差异,为临床合理使用光子与质子技术治疗肝癌提供基础性物理参考。
1 资料与方法
1.1 临床病例选择与定位方法
随机性回顾分析中心2020年以来螺旋断层治疗的原发性肝癌患者12例,其肝癌诊断及分期明确[9]。病理为原发性肝细胞肝癌,单病灶,直径4~8 cm,体积40~240 cc,局限在肝内,Ⅰa期6例,Ⅰb期6例,其位置为肝左内叶Ⅳ段4例,肝右前叶3例,肝左外叶5例,平均年龄48岁。腹压一体板联合真空负压垫定位,仰卧位并双手上举握手柄,依据患者的具体情况调节腹压弓压迫深度。行东芝(Aquilion TSX-201A)定位CT扫描,层厚3 mm,扫描范围为第5胸椎下缘至第4腰椎下缘。
1.2 靶区定义及处方剂量
将患者定位CT图像经网络以医学数字成像及通信(Digital imaging and communication of medicine,DICOM)格式传输至RayStation Ver 7.0(RaySearch Laboratories,Stockholm,瑞典)计划系统工作站进行勾画。靶区勾画:由同一位专业放疗医生参照ICRU 50与ICRU 62号报告完成靶区及危及器官的勾画工作。大体肿瘤体积(gross target volume,GTV)包括肉眼或影像学可见的大体肿瘤(尽可能结合多模态影像),临床靶区(clinical target volume,CTV)为基于GTV外放5 mm边界形成。光子计划的处方剂量及质子计划相对生物效应(relative biological effectiveness,RBE)等效,剂量均为GTV 74 Gy/20次,CTV 60 Gy/20次。
1.3 计划设计与评估指标
质子计划:使用RayStation计划系统进行IMPT计划的设计及优化,依据具体肿瘤部位进行2野照射,最终剂量计算采用蒙特卡洛(monte carlo,MC)算法。
光子计划:使用TomoHDTMVer 5.1.6.1 计划系统(Accuray公司,美国)进行HT计划的设计及优化,参数统一设置为铅门2.5 cm,调制因子2.6,螺距0.287,最终剂量计算采用筒串卷积(collapsed cone convolution,CCC)算法。
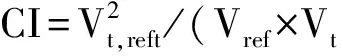
1.4 统计学方法
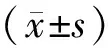
2 结果
2.1 靶区剂量参数比较
IMPT与HT计划的剂量分布均能满足靶区处方剂量要求,其中GTV的D1 、D99、Dmean、HI方面,IMPT计划均要优于HT计划且差异皆具有统计学意义(P<0.05)。至于GTV与CTV在CI的指标比较上,两组计划其剂量学差异皆已无统计学意义,即GTV(t=2.056,P=0.079),CTV(t=0.237,P=0.820),详见表1。图1显示了其中1例肝癌患者IMPT和HT计划的剂量分布。

表1 两组计划靶区剂量参数比较
2.2 危及器官剂量参数比较
两组计划均能满足对正常肝组织的剂量限制要求[10]。IMPT计划在各参数均值比较上皆优于HT计划,且除V50(t=-1.292,P=0.237) 与V60(t=-0.453,P=0.664)外,其余参数差异皆具有统计学意义(P<0.05),见表2。在空腔型危及器官的剂量限制方面,同样的两组计划也皆可满足各剂量限制要求[10]。通过比较分析各危及器官的最大量及平均量水平,几乎在所有空腔型危及器官的保护上,IMPT计划皆优于HT计划,且其差异具有统计学意义(P<0.05),见表3。关于实质型脏器肾脏的比较,参考V5、V10、V20及Dmean等指标,可知IMPT计划几乎不受剂量照射其平均剂量皆在0.1 Gy以下,而对于HT计划而言其左肾均值为0.71 Gy,右肾均值为0.68 Gy,皆远高于IMPT计划所受剂量,且差异具有统计学意义(P<0.05)。

表2 两组计划正常肝组织Liver-GTV剂量参数比较

表3 两组计划危及器官剂量参数比较
注:GTV为大体靶区;CTV为临床靶区;D1为1%体积受照剂量;D99为99%体积受照剂量;Dmean为GTV平均受照剂量;HI为均匀性指数;CI为适形性指数。
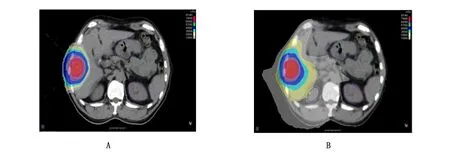
A为IMPT计划,B为HT计划。
3 讨论
对于肝癌的治疗目前多采用包括手术、介入、靶向、基因、生物及放射治疗等在内的多种治疗手段。早期患者多采用手术治疗,中晚期患者由于失去手术最佳时机,则较多采用手术外其他治疗手段,而放射治疗就是其中重要的治疗方法之一。目前应用于肝癌外照射治疗的常规光子技术主要有三维适形放疗(three dimensional conformal radiotherapy,3DCRT)、调强适形放疗(intensity modulated radiotherapy,IMRT)、容积旋转调强放疗(volumetric modulated arc therapy,VMAT)、螺旋断层放疗、体部立体定向放疗(stereotactic body radiotherapy,SBRT)等。HT技术除了360°范围内共计51个射野弧方向可执行多叶光栅调制及强度优化外,其特有的类似CT切片式束流照射,相较于其它技术皆提升了其调制能力[3-4]。时建芳等[11]通过30例原发性肝癌研究表明,螺旋断层放疗与三维适形放疗对计划靶区(planned target volume,PTV)剂量分布没有显著差异,但HT 的适形度与剂量均匀性要优于3DCRT且正常肝组织的平均照射剂量要低于3DCRT。王兴等[12]通过研究表明,VMAT 与 IMRT 放疗计划均可满足肝癌患者放射治疗要求,但是前者辐射剂量热点控制效果较好、适形指数更佳、部分危及器官剂量更低、治疗时间短、机器跳数少,临床应用的效果和安全性更佳。赵倩倩等[13]对16例患者进行比较分析得到在肝癌的放射治疗中,IMRT和HT组的靶区剂量分布的适形性和均匀性均优于3DCRT组,与IMRT相比,HT可以在保证靶区剂量分布适形性和均匀性的前提下更好地保护正常肝组织,可以使更多的患者接受较高剂量的处方照射。 综上表明,作为一种新兴的放射治疗手段,HT相较于其它技术在保证靶区剂量覆盖的同时,其在正常肝的保护上还是具有一定的优势。
本研究由于GTV处方剂量较高且位于CTV靶区内,因此仅对GTV的均匀性做出比较,结果显示IMPT计划GTV的靶区均匀性远优于HT计划(t=-12.804,P=0.000)。对于IMPT计划而言,其得益于质子束的笔形束扫描方式(pencil beam scanning,PBS)。笔形束扫描技术通过对质子束位置和质子数量的控制,形成质子束调强治疗,即横向强度调制与IMRT类似,通过改变能量实现纵向深度调制[14]。因此相较于单散射、双散射及均匀扫描等常规质子被动散射技术,PBS可实现真正意义上的3D剂量绘制,其调制能力在一定程度上要优于HT技术。但是在适形度的比较上,两种治疗技术对GTV与CTV都没有统计学差异。分析原因,可能是由于IMPT笔形束扫描方式束斑半影过大,导致在一定程度上劣化了肿瘤边界的剂量跌落梯度所致。
由于肝脏易受呼吸影响运动幅度较大,因此需在临床上加以特别关注。目前临床上已有门控、实时追踪、呼吸控制、四维CT及腹部加压等多种技术以尽可能降低呼吸运动对肝癌放疗的影响。当然在实际光子治疗过程中,往往还需要外扩计划靶区PTV,一般包括 CTV及治疗过程中器官生理运动及日常摆位误差等导致的照射范围的扩大,以此确保CTV 得到既定处方照射量。另一方面如果盲目外扩PTV,将会增加周围正常肝脏组织照射剂量,导致放疗并发症的发生。因此各放疗中心应根据具体情况分析各种影响因素,制定出符合本单位标准的PTV外扩范围[10,15-18]。对于质子放疗,虽然质子束在到达肿瘤深度时迅速集中释放大量能量,而使肿瘤后方剂量几乎为零,很好地保护了肿瘤后方的正常肝组织。但是质子束进入人体后的具体射程却是不确定的,这种不确定度可以来源于原始CT定位时HU值的不准确性或是束流路径上组织电子密度的变化(呼吸运动等因素引起的)等多方面[19]。再加上呼吸运动对于肝脏肿瘤位置的影响,进一步加剧了质子束射程问题的复杂性。因此对于肝脏质子放疗会更加注重患者呼吸运动的管理。利用呼吸肺活量控制技术实施治疗过程中的肿瘤实时运动管理。该设备在初始CT定位时,采集患者的呼吸肺活量模型,然后在治疗过程中与IBA通用束流触发接口相整合,据此依据呼吸幅度对束流状态进行综合管理[14]。同时会利用重复扫描技术及在计划优化过程中设置射程不确定度值等方式以增加治疗计划的鲁棒性并以此代替PTV的使用[20-22]。基于本文研究目的是根据两组计划的剂量学差异评估质子与光子治疗计划的优劣,因此为了评估需要,有必要进行统一变量即舍去光子PTV及质子鲁棒性因素以GTV及CTV为基础进行计划设计与最终剂量评估。尽管利用PBS技术治疗肝脏肿瘤越来越多地得到了应用,但是目前为止绝大数治疗肝癌的结果还是来自被动散射技术。虽然PBS技术提供了更为优越的剂量分布,但它似乎更容易受到组织电子密度变化所带来的影响,因此本质上其稳健性不如被动散射技术。尽管如此,只要采取积极有效的运动管理以及更为稳健的质子鲁棒性计划还是可以取得较理想的治疗效果[23-24]。最近德国的一项研究表明基于4D优化的PBS治疗计划取得了优于被动散射技术所带来的危及器官的保护效用[24]。
对于肝癌的放射治疗,一般认为正常未受照射的肝脏剂量是放射治疗是否成功实施的关键因素。其最严重的辐射并发症就是放射诱导性肝病(radiation induced liver disease,RILD),一旦发生,超过70%的病人会死于这种致命的并发症。放射诱导性肝损伤发生后,剩下的正常肝组织被刺激而增生,进而代偿受损伤的肝功能。这就要求未受照射的健康肝体积应尽可能大,且正常肝脏的剂量尽可能降低。由于亚洲肝细胞肝癌患者常伴有肝硬化,且目前临床上很难预测不同程度肝硬化的肝脏在接受不同剂量照射后的代偿增生能力。因此在肝癌放疗中,应优先考虑如何尽可能降低正常肝组织的辐射剂量,使未受照射的健康肝组织尽可能大,且采取保持一部分健康肝脏不受照射的治疗策略。据既往文献报道,正常肝脏平均剂量,即全肝体积减去GTV是1个非常重要的评价指标[25-29]。在本研究中从正常肝组织Liver-GTV来看,在所有评价指标上,IMPT计划皆优于HT计划,且除V50(t=-1.292,P=0.237),V60 (t=-0.453,P=0.664) 外,其余参数皆具有统计学差异。相较于HT技术,IMPT在正常肝组织平均剂量上降低将近30%,降低幅度还是相当明显的。除了常见的肝硬化外,伴随肝细胞肝癌患者的一般还有脾功能亢进,进而导致患者胃肠道静脉扩张和凝血功能较差,胃肠道的放射耐受剂量是要低于RTOG推荐标准的。因此在RTOG基础之上近可能降低胃肠道辐射受量,将会在相当程度上减少放射性诱发胃肠道出血概率的发生。本研究中所选病例虽然肿瘤部位距胃肠道较远,但不可否认的是IMPT无论在胃、大肠、小肠还是十二指肠的保护上都远远胜于HT计划,极大程度上降低了胃肠道出血发生的可能性。对于脊髓与肾脏来讲同样如此,在本研究中IMPT计划脊髓与肾脏几乎不受额外剂量的照射。
当然在生物学方面,对于普遍的质子治疗RBE会随着射线射入人体深度的增加而变大,变化的RBE就会影响射束实际射程的大小。临床上使用1.1这个固定值算出来的射程实际上会或大或小于实际射程,由于RBE的不确定性,业界依然担心其潜在的晚期反应[30-32]。尤其对于肝癌来讲, Chen等研究已经表明,如果忽略RBE的变化,而以1.1为标准值,那么很可能会显著低估NTCP而轻微高估TCP,最终导致质子的治疗率可能低于预期值,且可变RBE也会增加不同分割方案中NTCP的差异性[32]。因此医生在选择质子治疗方案时,一定要慎重评估并适当考虑到其RBE的变异性。
两种不同的外照射技术对于肝癌治疗来讲均能满足临床剂量要求,但与HT相比IMPT计划明显降低了危及器官的受量,尤其是正常肝组织,具有较为明显的剂量学优势,对于降低二次肿瘤发生风险意义重大。伴随着呼吸运动管理技术的进一步成熟以及更多计划鲁棒性功能的使用,相信质子放疗会越来越多的应用。对于临床上质子治疗所可能带来的更多潜在优势,相信随着国内质子临床的进一步开展应用及更多的临床研究数据将会有越来越多的结果呈现出来。
