胸腔镜下肺段切除术对肺癌患者影响分析#
2021-10-12陈国标周建平杜巍叶志彬卢星照
陈国标 周建平 杜巍 叶志彬 卢星照
(东莞市人民医院心胸外科,广东 东莞 523000)
随着环境污染的加重以及不良生活习惯的影响,肺癌的发病率具有逐年上升的趋势,已成为我国发病率最高的恶性肿瘤[1]。针对肺癌患者,手术切除肿瘤组织是临床对该病的主要治疗手段。随着胸腔镜技术的发展,其为肺癌手术治疗提供了新的思路。胸腔镜手术可有效降低手术对患者产生的创伤,术后患者恢复周期相对较短,已在临床得到广泛的应用。胸腔镜下可进行肺段或肺叶切除术,肺叶切除术是指将患者肿瘤侧肺叶整体切除,其具有肿瘤切除彻底等优势,但因为手术需要切除患者较大的肺组织,对患者的创伤相对较大,术后患者残余肺功能以及恢复情况均较差[2]。肺段切除术是指将肿瘤生长肺段进行切除,其肿瘤清除情况与肺叶切除术相比差异并不明显,该种手术方法具有肺组织切除少、对患者创伤小等优势,术后患者残余肺功能较为理想。现阶段,胸腔镜下肺叶切除术以及肺段切除术临床均有所应用,但对于两种术式临床应用效果的报道相对较少。基于此,本研究详细分析了两种术式的实际应用效果,现将实验结果报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年12月,在我院接受胸腔镜手术治疗的肺癌患者85例为本实验研究对象,采用计算机随机分组的方式,将其分为对照组(n=42)以及实验组(n=43)。纳入标准:临床资料完整,诊断明确,有组织病理学检查支持诊断患者;肿瘤位于肺外周1/3,距离切缘>2cm,且直径≤2 cm、C/T>0.5患者;患者知情同意。排除标准:多发肺原位癌或合并其他恶性肿瘤患者;其他部位肿瘤肺部转移患者;存在肺内转移或远处转移患者;既往有胸部手术或放化疗史患者;肺功能严重不全患者;存在手术禁忌症患者;随访期内失联患者。对照组纳入患者男女比例为28∶14;患者年龄介于51~78岁之间,均值为68.32±7.45岁;肿瘤直径介于0.7~2.0 cm之间,均值为1.48±0.35 cm。实验组纳入患者男女比例为30∶13;患者年龄介于48~79岁之间,均值为67.89±7.13岁;肿瘤直径介于0.5~2.0 cm之间,均值为1.51±0.36 cm。两组患者一般资料差异不具备统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核。
1.2 方法
对照组患者接受胸腔镜下肺叶切除术,健侧卧位,健侧单肺通气全麻后,手术方法选择为双孔操作法,操作孔和观察孔分别选择为腋前线3~4肋间和7~8肋间,切口长度控制在20~25 mm以及10~15 mm之间,同时观察孔具有副操作孔的作用,胸腔镜置入。对肿瘤位置进行明确,游离肺叶血管以及气管等组织,采用胸腔镜切割缝合器对病灶肺叶进行切除处理,止血完全后,防止引流装置,关闭胸腔,术毕。实验组患者接受胸腔镜下肺段切除术,体位、麻醉方式、手术方法等同对照组。
对肿瘤位置进行明确,鼓肺确定病变肺段,对相应肺段组织进行解剖分离,暴露肺段气管、血管等,夹闭、结扎相关气管、血管等,使用胸腔镜切割缝合器对肺段进行切除,止血完全后,防止引流装置,关闭胸腔,术毕。在切除目标肺段时,为保证肿瘤组织清除彻底,应使切除边缘间隔肿瘤至少1.5~2 cm, 必要时可扩大切除范围,以切除边缘为阴性最佳。
1.3 观察指标
1.3.1 手术效果
对两组患者手术耗时、出血量、引流量、引流时长、住院时间等一般手术情况进行统计和比较。
1.3.2 术后并发症
对患者术后发生肺部感染、漏气、积液等手术相关并发症发生情况进行统计和比较,并发症统计时间为术后1周。
1.3.3 肺功能检测
在患者接受手术治疗前以及术后1周,对患者肺功能情况进行检测,检测指标包括:用力肺活量(Forced vital capacity,FVC)、第1秒用力呼气容积(Forced expiratory volume in one second,FEV1)、每分钟最大通气量(Maximal voluntary ventilation,MVV)。
1.3.4 肿瘤标志物检测
在患者接受手术治疗前以及半年后,对患者肿瘤标志物水平进行检测,检测项目包括:肿瘤坏死因子(Tumor necrosis factor,TNF)、细胞角蛋白21-1(Cytokeratins21-1,CYFRA21-1)、癌胚抗原(Carcinoembryonic antigen,CEA)。
1.3.5 癌症预后比较
对患者进行为期1年的随访,以了解患者肺癌复发率以及患者死亡率。
1.4 统计学方法
利用统计学软件SPSS 29.0软件处理,计量资料以及计数资料分别采用(±SD、n(%)进行表示,分别进行t检验以及χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 手术情况
虽然实验组手术耗时明显高于对照组(P<0.05);但术中出血量、引流量、引流时长以及住院时间等方面,均明显低于对照组(P<0.05)。见表1。
表1 两组患者一般手术情况比较(±SD)

表1 两组患者一般手术情况比较(±SD)
注:与对照组相比,*P<0.05。
组别 n 手术耗时(min) 出血量(mL) 引流量(mL) 引流时长(d) 住院时间(d) 对照组 42 153.48±10.36 183.74±27.05 527.85±73.45 5.72±1.68 8.95±1.36 实验组 43 164.37±10.42* 140.39±21.64* 452.81±63.14* 4.09±1.32* 6.23±1.24*
2.2 术后并发症
实验组患者手术相关并发症发生率明显低于对照组(P<0.05)。见表2。

表2 两组患者术后并发症比较(n(%))
2.3 手术前后患者肺功能
术前,肺功能比较无明显差异(P>0.05);手术1周后,实验组患者术后肺功能相关指标均明显高于对照组(P<0.05)。见表3。
表3 手术前后患者肺功能比较(±SD,mL)

表3 手术前后患者肺功能比较(±SD,mL)
注:与对照组相比,*P<0.05。
组别 n 时间 FVC FEV1 MVV 对照组 42 手术前 110.38±14.54 102.78±12.45 93.32±12.52 手术后 84.38±10.25 87.26±9.85 80.38±14.63 实验组 43 手术前 109.79±12.52 101.96±9.98 92.64±12.34 手术后 99.57±12.26* 98.36±11.25* 84.76±13.58*
2.4 手术前后肿瘤标志物水平
术前两组患者肿瘤标志物水平比较,无显著差异(P>0.05);术后随访半年,两组患者肿瘤标志物水平均有所下降,与术前比较差异显著(P<0.05),但手术后两组患者肿瘤标志物水平比较无显著差异(P>0.05)。详细比较见表4。
表4 手术前后肿瘤标志物水平比较(±SD,ng·mL-1)
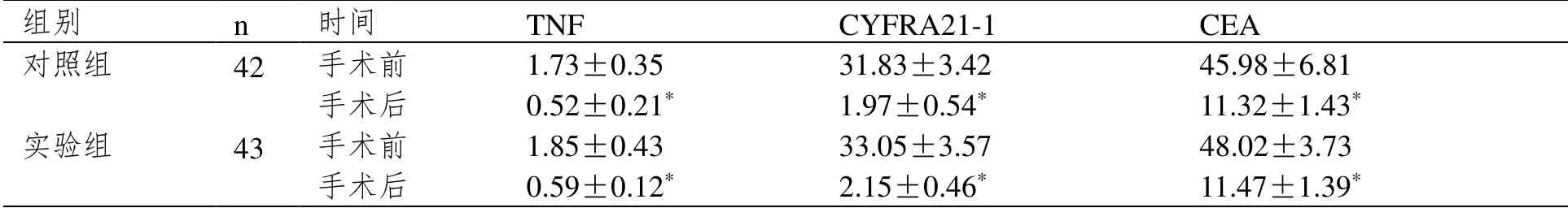
表4 手术前后肿瘤标志物水平比较(±SD,ng·mL-1)
注:与治疗前比较,*P<0.05。
组别 n 时间 TNF CYFRA21-1 CEA 对照组 42 手术前 1.73±0.35 31.83±3.42 45.98±6.81 手术后 0.52±0.21* 1.97±0.54* 11.32±1.43* 实验组 43 手术前 1.85±0.43 33.05±3.57 48.02±3.73 手术后 0.59±0.12* 2.15±0.46* 11.47±1.39*
2.5 肺癌预后
对两组患者进行为期1年的随访,对照组患者肿瘤复发率以及死亡率分别为19.05%(8/42)、11.90%(5/42),与实验组16.28%(7/43)、11.63%(5/43)比较无明显差异(P>0.05)。
3 讨论
肺癌为发病率以及病死率最高的恶性肿瘤之一。手术为临床治疗早期肺癌的首选方法,腔镜手术由于其手术切口较小、对患者胸壁组织的损伤较小,患者术后疼痛感轻且恢复周期短,已在肺癌的手术治疗中得到广泛的应用[4]。目前应用较多的术式为:肺段切除以及肺叶切除术联合系统淋巴结清扫[5]。但该术式仍存在一定的局限性,其术后并发症的发生率仍居高不下,严重限制其术后身体机能的恢复[6-7]。本研究分析了胸腔镜下肺叶切除术与肺段切除术在肺癌患者治疗中的作用。结果显示:肺段切除的实验组患者手术耗时显著长于肺叶切除的对照组。可能是因为肺段内血管、气管组成较为复杂,且存在较大的变异性,所以在手术过程中应充分对血管、气管等组织进行暴露,必要时可通过支气管等对变异血管进行明确,因而对术者的解剖知识以及手术技能的要求较高,进而所需要的手术时间也有所延长。这与王建平等研究结果一致[8]。在术中出血量、引流量、引流时间以及住院时间,及术后并发症等方面,实验组明显少于对照组;术后两组患者肺功能相关指标均有所下降,但实验组患者FVC、FEV1、MVV均高于对照组。这些指标可体现手术措施对患者组织的损伤程度以及患者恢复情况。
肺叶切除术为一种具有局限性的切除手术,在保证完全清除病灶的基础上,最大程度地保留了患者健康肺组织,因而对患者的损伤较小,出血量、引流量以及引流时间等均得到有效地降低;由于最大程度地保留了患者肺组织的完整性,因而对其肺功能的损伤较小,同时可有效地降低并发症的发生率,对促进患者身体机能的恢复以及缩短住院时间等均具有促进作用[9-10]。在肿瘤标志物以及预后方面比较,两组无显著差异,提示胸腔镜下肺段切除术与肺叶切除术治疗肺癌效果并无区别。
综上所述,胸腔镜下肺段切除术在肺癌患者治疗中应用可行性较高,其具有创伤小、恢复快等优势,对延长患者生存时间以及提高生活质量等均具有积极作用。但该术式对术者解剖知识掌握以及手术技能掌握的要求较高,应得到临床足够的重视,以为患者提供理想的治疗。
