经导管封堵心肌梗死后室间隔穿孔的研究进展
2021-10-12袁景昊李一谷新顺
袁景昊 李一 谷新顺
心肌梗死后室间隔穿孔(post-myocardial infarction ventricular septal rupture,PMIVSR)是心肌梗死的并发症之一,其穿孔部位发生于坏死组织内。据统计,对于溶栓前的患者,PMIVSR的发生率为1%~5%,而在心肌梗死后的早期再灌注治疗时期,PMIVSR的发生率约为0.2%[1]。PMIVSR的发生率虽然较低,但死亡率极高,需要及时修补穿孔。目前,除经典的手术修补方式以外,经导管封堵也是一种可选的方式。
1 PMIVSR的临床特征
PMIVSR的发生时间具有双峰的特征,其发病高峰分别为心肌梗死后16~24 h和3~5 d。临床上常表现为急性心肌梗死患者突然出现血流动力学的急剧恶化,并出现新的粗糙全收缩期杂音、急性心力衰竭、肺水肿、心原性休克。超声心动图显示出新的室间隔破裂。彩色多普勒超声可显示左向右分流。三维超声心动图可以显示出穿孔的位置、形状、大小等。肺动脉导管可显示患者右心室血氧饱和度升高,并确定肺动脉毛细血管楔压及肺动脉压升高。
与先天性室间隔穿孔不同,PMIVSR不是离散的空洞,而是经常为分散的多个不规则缺损[2]。PMIVSR分为两种[3]:一种常见于冠状动脉左前降支闭塞,为室间隔心尖部及前部穿孔,这种穿孔在同一水平上打开了右心室;另一种常见于右冠状动脉闭塞引起的基底部梗死,常为复杂的、长的、浆膜状的穿孔,可开始于室间隔底部,并在更接近顶部的位置进入右心室,这种心肌梗死多为透壁性梗死,心室间隔损伤较大,室壁更为脆弱。
研究显示,发生PMIVSR的患者,保守治疗30 d生存率低于8%,1年生存率低于3%[4]。GUSTO-1研究[1]的PMIVSR患者中,PMIVSR发生的高危因素为老年、左前降支闭塞、女性,出现急性PMIVSR的患者可能存在突然的、严重的缺血,其血管更有可能出现完全闭塞或存在多支血管病变,左心室功能更差。在溶栓患者中,虽然PMIVSR发生率减低,但诊断室间隔穿孔的时间仅为1 d,而既往未再灌注治疗的患者诊断时间为心肌梗死后3 d[1],这表明,室间隔区域的再灌注降低了PMIVSR发生率,但再灌注可能导致坏死心肌炎症过程加速,坏死组织的吸收加快,使坏死区域软化变薄,使得PMIVSR的发生时间更为提前。
2 PMIVSR外科手术修补的劣势
外科手术是目前指南推荐的PMIVSR治疗方式[5],通常为左心室切开术或经梗死游离壁切开行室间隔穿孔修复,目前多推荐平行于冠状动脉罪犯血管处梗死的心肌位置切开。多项研究显示,经外科手术或经导管修补治疗后,患者30 d生存率为30%~60%[1,6]。但由于组织仍有坏死,穿孔心肌的缝合可能无效,外科手术干预的预后常不如预期。对于外科手术患者,术后残余分流风险高达10%~37%,其中11%的残余分流需要进一步外科手术,PMIVSR复发出现在5%~20%的手术修复患者中[7]。2019年,日本成人心血管外科数据库报道,外科手术修复复发PMIVSR的患者死亡率高达15.6%~40.6%[8]。外科手术对室间隔上部、前部出现的PMIVSR较为适合,因为其结构较为简单。但室间隔下部、后部出现的穿孔很难通过左心室切开术进行修复。Komeda等[9]于1990年曾对比室间隔上部及下部出现PMIVSR的患者经左心室壁入径进行穿孔修复,其中,上部穿孔的PMIVSR患者死亡率仅有10%,而下部穿孔患者的死亡率与手术无关。
左心室切开术还可能导致已受损的左心室功能恶化,在手术期间,出血和致命性心律失常使得预后难以评估。近年来,Asai等[10]也提出了经右心室入径修复PMIVSR。由于心室切开损伤心室壁,经心房入径也在成为值得考虑的一种修复入径。2013年,Sharma等[11]曾对比了经心室和经心房入径进行修复的结果,发现基底部PMIVSR相关的修复手术术后死亡率高达25%,其中经心室入径术后出血与心力衰竭是死亡的重要原因。但是由于PMIVSR相对较少,目前并没有充足的证据来比较不同入径的优劣。
急性期PMIVSR(3~14 d)的患者死亡率远高于亚急性期(14~30 d)[12]。Prêtre等[13]认为,由于梗死区心肌组织柔软而脆弱,当穿孔周围组织存在瘢痕和心肌纤维化区域时,预后会较好。Arnaoutakis等[14]的研究也证实,7 d内实施外科手术的术后死亡率为54.1%,而7 d后实施外科手术的术后死亡率为18.4%。因此,对于接受PMIVSR修复术的患者,外科医师常倾向于待初步愈合和瘢痕组织形成后再进行手术。由于手术时机的选择不同,手术患者的死亡率波动在20%~87%[15-16],其中部分异质性原因就是高危患者在手术前因并发症死亡,这导致等待时间越长,低危患者比例越高。
3 经导管封堵PMIVSR
1988年,Lock等[17]提出了经导管修复PMIVSR的方法,并作为急性期PMIVSR手术的替代治疗或手术后残余分流的修复手段。Maltais等[18]对早期经导管封堵和早期外科手术封闭PMIVSR的患者进行了比较,两种疗法死亡率相当。并指出,PMIVSR直径>15 mm的患者更应该选择外科手术修复,因为这些患者经导管封堵PMIVSR中可能会残余室间隔穿孔或经历设备相关栓塞;较小的穿孔行经导管修复治疗更有优势。
3. 1 经导管封堵PMIVSR的术前准备
影像学评估是封堵术前必须进行的准备。在干预前,应利用二维及三维超声心动图充分确定穿孔的尺寸和形状。当穿孔区域超声不能确定时,应当使用心脏磁共振成像或心室声学造影。由于穿孔区多较为复杂,单次的图像评估可能不准确,因此,术前可多次检查。经导管封堵PMIVSR的主要禁忌证为[16,19]:(1)PMIVSR直径>25 mm;(2)穿孔基底部边缘接近二尖瓣或主动脉瓣口;(3)穿孔顶部缺少有效的边缘。
急诊治疗、主动脉内球囊反搏(intra-aortic balloon pump,IABP)和体外膜肺氧合为围术期提供了支持。一项病例系列报道中,PMIVSR患者采用了经皮心室辅助装置+体外膜肺氧合以稳定血流动力学,从而成功修复穿孔[20-21]。对于确诊PMIVSR的患者,需尽早使用IABP以减轻后负荷,改善血流动力学。据报道,IABP的最大获益时间为PMIVSR发生后的第1个24 h[22]。PMIVSR早期避免休克和多脏器功能衰竭,处理重点应为改善患者的血流动力学,尽量维持患者心功能以推迟外科修补手术或经导管封堵室间隔穿孔的时间[16,23]。封堵时间和策略的选择与患者的预后关系紧密。在急性PMIVSR期间,应首先考虑进行外科手术关闭;对于不能外科手术关闭的患者,经皮封堵可作为治疗方法;对于有残余分流的患者,应进行追踪,中期应针对残余分流减少充血负荷,以便推迟关闭[24]。
早期的血管重建降低了PMIVSR的发生率和穿孔区域的大小,部分恢复了血流动力学的稳定性,利于使用外科手术或经导管进行穿孔修补[16]。因此,除非患者无法等待,通常在经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)后再行经导管封堵治疗。对PCI术后患者,需至少暂停双联抗血小板治疗2 d后再进行经导管封堵[19]。经导管封堵术前应使用EuroScore危险评分评估患者的手术风险,也可以大致预估住院费用,其分值越高,手术风险和费用就越高,也可结合其他评分,综合比较不同操作的风险。
3. 2 经导管封堵PMIVSR的封堵器选择
目前,各种封堵器均有用于PMIVSR的经验,其优势各不相同。由于以往的室间隔封堵器尺寸通常较小,房间隔缺损封堵器(atrial septal defect occluder,ASDo)曾被尝试用于PMIVSR的封堵,其优势在于大小较普通的室间隔封堵器大,但两心室压力梯度远高于心房,ASDo封堵效果常不佳,对于急性期患者减少分流的效果不理想。室间隔肌部封堵器(muscular ventricular septal defect,mVSDo)更能适应心室高压的环境。目前,Amplatzer的梗死后室间隔缺损封堵器(post-infraction mVSDo,PimVSDo)被广泛使用。其圆盘面积更大,结构更为紧实,更能适应PMIVSR面积更大、压力梯度更高的特点。
封堵器尺寸选择:急性期时,因为穿孔边界柔软而易碎,PMIVSR的封堵器的腰部尺寸应至少比穿孔区直径大6~8 mm[15]。慢性期PMIVSR封堵器的大小可适当放宽,其腰部大小只需比穿孔区直径稍大。封堵入径:经颈静脉入径优于经股静脉入径。对于多发性穿孔,可先封堵大的穿孔口以稳定患者的血流动力学,争取二次封堵的机会。术中,实时3D超声心动图可能对介入治疗具有指导和监测作用[25]。
目前,经导管封堵PMIVSR的设备并不完善,当前的导管设备尺寸较小,常不能完全覆盖穿孔区,对于穿孔区边缘的心肌来说也不够柔软,若二次手术易损伤穿孔区或使之扩大。国外有研究利用3D打印技术设计出不同形状和尺寸的封堵装置,可以提高封堵的效果[26]。目前,并没有一款专门用于PMIVSR的经导管封堵设备,这也限制了此项技术的应用。
3. 3 封堵的程序
术前静脉注射普通肝素100 U/k g。首先使用Seldinger法,行股动脉以及股静脉或颈内静脉插管。若经股动脉插管,指引导丝经主动脉瓣,通过室间隔穿孔进入右心室和肺动脉,通过静脉引入第2条抓捕导丝连接到已至肺动脉中的指引导丝,之后回收抓捕导丝,形成一条动脉-静脉轨道。然后将输送导管由循环的静脉侧经室间隔穿孔送至左心室,在超声心动图或X线下确认其已到达正确的位置后,收回指引导丝,将封堵伞放置在装载鞘管内,送至并通过穿孔处,首先打开远端的圆盘部,并将其往回拉,将封堵器远端的盘固定在左心室一侧,回拉鞘管,近端盘即可打开。之后以超声心动图、左心室造影或X线确认封堵器处于正确位置即可将其释放。术后可予以抗栓、改善心功能等对症治疗。
3. 4 封堵的时机选择
急性期进行外科手术或经导管封堵的PMIVSR患者术后30 d死亡率可高达20%~87%[7]。慢性期,即心肌梗死2周后,行外科手术或经导管封堵的PMIVSR患者的平均30 d死亡率为23%,完全封堵成功率也较高[4,27]。据澳大利亚胸外科医师学会国家数据库报道,心肌梗死后7 d内接受外科经胸修补室间隔穿孔手术的患者手术死亡率为54.1%,而延迟外科手术至7 d后的患者死亡率为18.4%。但这可能与选择偏倚有关,即手术医师常倾向于延迟PMIVSR外科修补手术以等待瘢痕形成,而许多患者等不到外科手术就要面临死亡,对于急需手术干预的患者,等待期间发生的并发症也容易使其纳入外科手术的排除标准。因此,对于生命体征稳定的患者,可以选择延迟外科手术修复,以改善坏死心肌区域的整体状况。对于生命体征不稳定的患者,可行经导管治疗,或先行外科手术治疗改善分流状况,二期行经导管或外科手术治疗修复。
3. 5 预后
急性或亚急性患者外科手术或经导管治疗死亡率的异质性很大程度是由于手术时机、心原性休克、室间隔穿孔复发、下部室间隔穿孔和上部心肌梗死合并二尖瓣反流造成的。对于不同的治疗方式,由于缺乏大型临床试验数据支撑,目前尚无法区分优劣。目前的研究大多追踪至术后30 d,心原性休克对患者的存活起到了重要作用。Egbe等[27]和Thiele等[28]报道,急性期PMIVSR出现心原性休克的患者,其30 d生存率较低。此外,白细胞计数在一定程度上反映了心脏炎症的过程,高白细胞计数提示了梗死区炎症和愈合的不完全性,其短期生存率较低[25]。总体来说,急性期PMIVSR经导管封堵治疗的患者30 d死亡率为42%~100%,慢性期PMIVSR患者30 d死亡率为20%~40%[7,19,23]。同时存在心原性休克、心力衰竭、心律失常、多脏器功能衰竭等并发症的患者死亡率更高,预后更差。
自经导管封堵PMIVSR首次报道以来,目前仅有不到400例PMIVSR的病例报道及10余个小的病例系列,详见表1。由于缺少较大规模的经导管封堵PMIVSR与外科手术修补的随机对照研究,目前的指南仍推荐优先选择经外科手术修补PMIVSR[5],但当患者处于以下条件之一可以考虑行经导管封堵PMIVSR:(1)患者拒绝外科手术治疗或存在外科手术禁忌证;(2)外科手术后残余分流的封堵;(3)穿孔直径<15 mm。此外,某些急性期患者手术耐受性较差也可考虑经导管封堵PMIVSR。回顾这些关于经导管封堵PMIVSR的研究特点:一是样本量相对较小;二是多为回顾性研究,选择偏倚可能对结果起了一定的作用;三是封堵时间对死亡率的影响也没有充分评价。目前,虽针对PMIVSR形成了一定的认识,但大型的多中心随机对照试验也是不可缺少的,需要进一步组织实施。
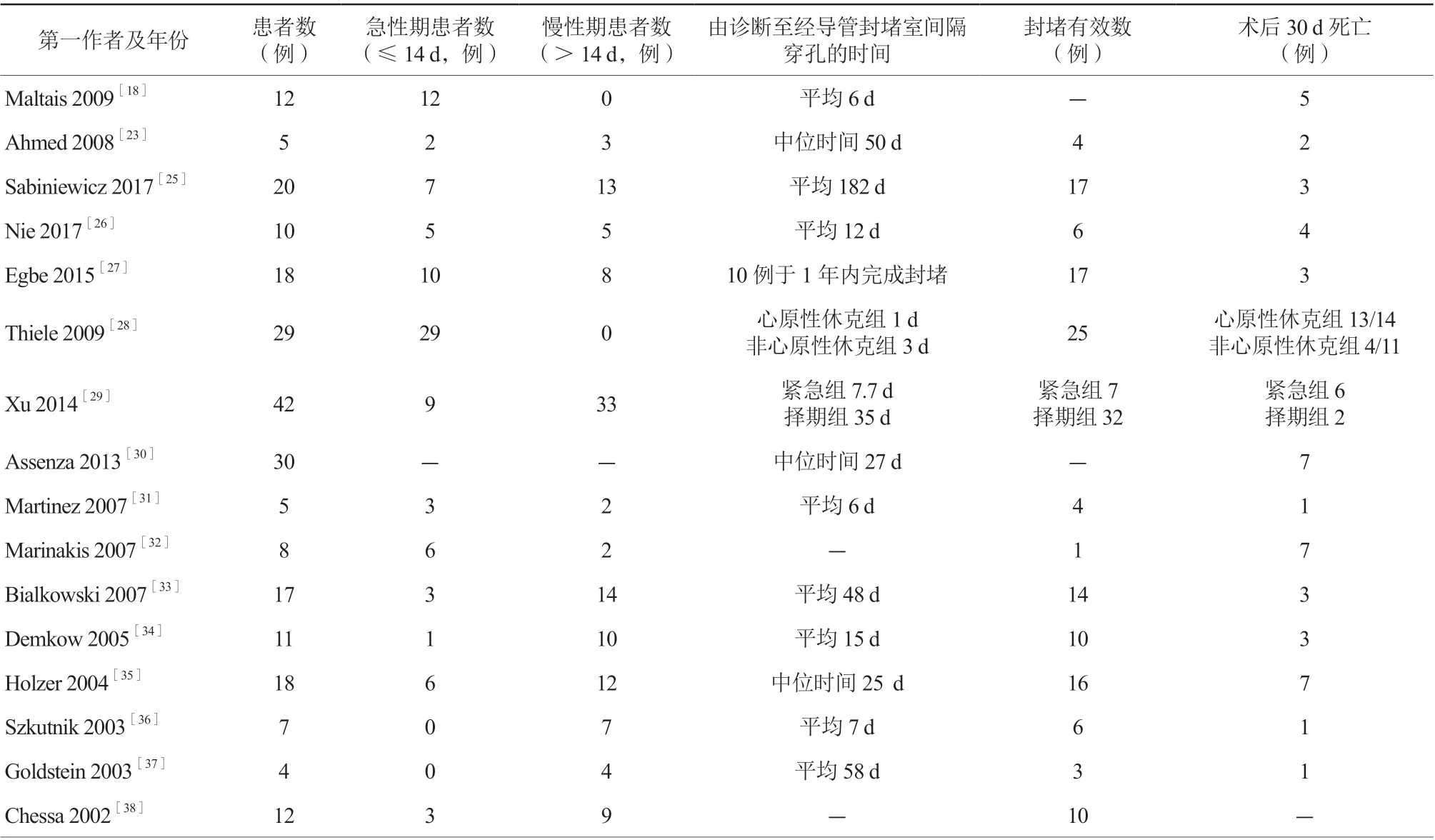
表1 2002—2018年患者数>4例的经导管封堵PMIVSR的报道基本信息
利益冲突所有作者均声明不存在利益冲突
