腹膜后脂肪肉瘤12例临床诊疗分析
2021-10-12朱学华刘泽南夏海缀马潞林
朱学华,刘泽南,夏海缀,陆 敏,卢 剑,马潞林
(北京大学第三医院:1.泌尿外科;2.病理科,北京 100191)
腹膜后脂肪肉瘤(retroperitoneal liposarcoma,RPLS)是指起源于腹膜后非特定脏器的一类恶性肿瘤,约占腹膜后软组织肿瘤的50%[1]。2013年WHO将脂肪肉瘤分为高分化脂肪肉瘤(well differentiated liposarcoma,WDLPS)、去分化脂肪肉瘤(dedifferentiated liposarcoma,DDLPS)、黏液型脂肪肉瘤(myxoid liposarcoma,MYLPS)、多形性脂肪肉瘤(pleomorphic liposarcoma,PLLPS)、混合型脂肪肉瘤(mixed liposarcoma,MXLPS)5种类型[2]。法国癌症中心联合会(French Federation of Cancer Centers,FNCLCC)根据肿瘤组织学分化(1~3分)、核分裂像(1~3分)及坏死(1~2分)提出组织学分级,由3个参数相加后的得分表示,1级(G1)总分为2~3分,2级(G2)为4~5分,3级(G3)为6~8分[3]。由于腹膜后解剖位置深在,空间大,腹膜后脂肪肉瘤起病隐匿,无特异性临床症状。肿瘤较大压迫或侵犯周围脏器如肾脏、胃肠道、腰大肌及腹膜后神经血管组织时会出现腰痛、腹胀、纳差、下肢沉重及麻木等非特异性症状,早期诊断困难[4]。本研究回顾性分析2010年1月到2020年9月我院泌尿外科收治的12例行手术治疗且术后病理明确诊断的RPLS患者的临床病理资料,报告如下。
1 资料与方法
1.1 一般资料12例患者中,男女各6例;患者中位年龄67.5(29~72)岁;初发者7例;首次复发者5例次,二次复发者2例次。初发与复发患者临床病理资料比较见表1(由于样本量小,初发与复发患者在各比较项中均未见显著差异)。临床表现:体检发现者5例次,伴有临床症状者或体征者9例次,包括腰腹部疼痛5例次、触及腹部肿物2例及下肢水肿2例。具体见表1。
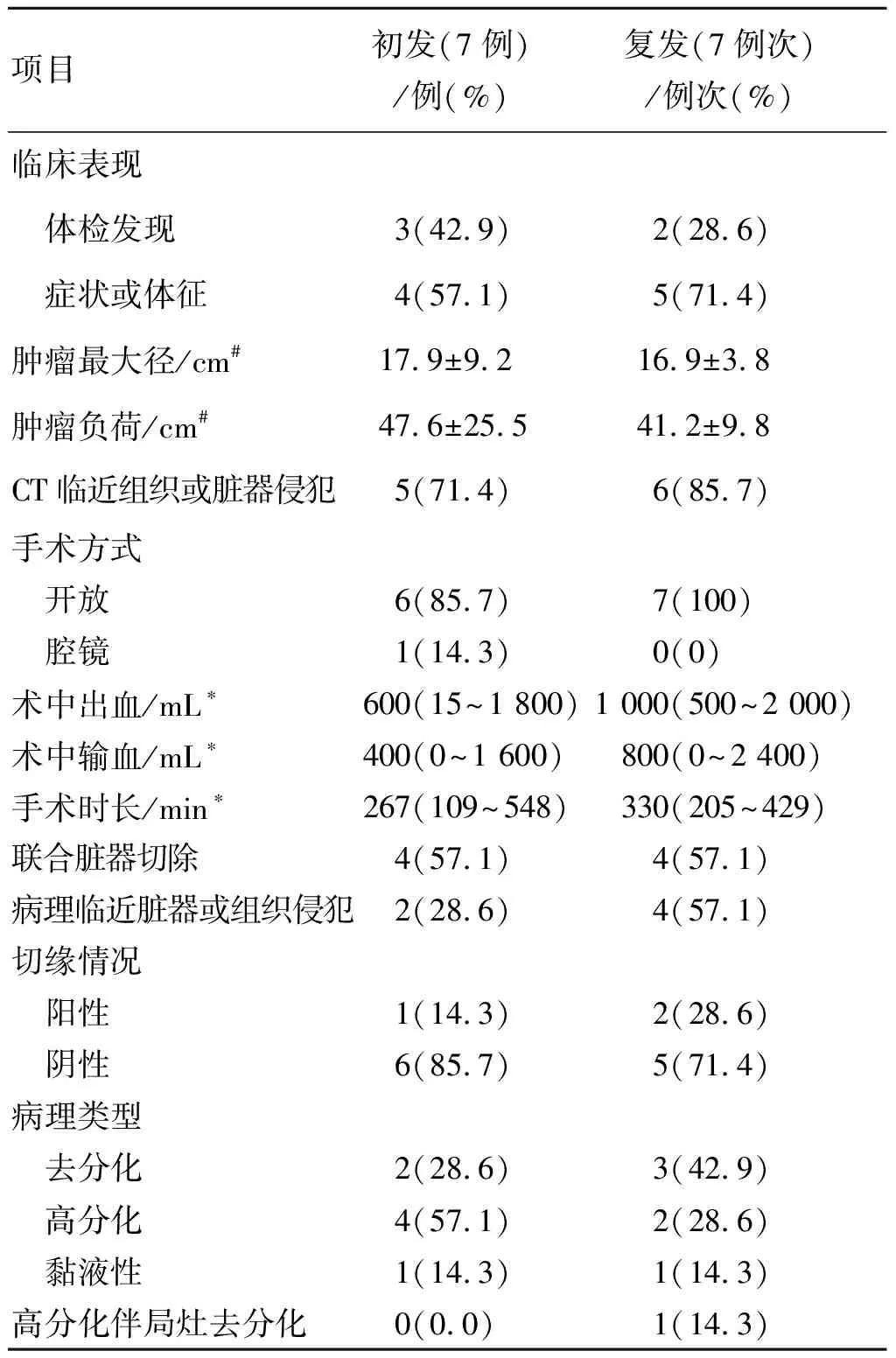
表1 初发与复发患者临床病理资料比较
1.2 纳入及排除标准纳入标准:①术前完善腹盆腔增强CT检查;②于我院行手术治疗且术后病理证实为RPLS。排除标准:①术后病理为腹膜后其他类型肿瘤,如脂肪瘤、肾脏来源脂肪肉瘤;②因手术禁忌、远处转移等因素而未行手术治疗者;③临床资料不完整者。
1.3 诊断方法所有患者术前均完善腹盆腔增强CT以评估肿瘤的性质、位置、大小、数量、肿瘤与周围脏器或组织如肾脏、胃肠道、大血管的关系,显示肿瘤血流情况及有无其他脏器远处转移,以指导治疗策略及手术方案的制定。1例患者行腹盆腔MR检查进一步评估肿瘤与腹主动脉、下腔静脉的关系。肿瘤直径(17.5±6.8)cm,肿瘤负荷(44.4±18.9)cm(肿瘤负荷为长、宽、高三径之和)。术前CT考虑伴有临近脏器/组织受累者11例次,其中肾脏受累者7例次,肾上腺受累者2例次,腰大肌受累者3例次,胃肠道受累者2例次,脾脏及胰腺受累者1例次,下腔静脉、肠系膜上动脉及左肾静脉受累者1例次。
2 结 果
2.1 治疗情况对于术前CT怀疑有临近脏器或组织侵犯者均谨慎探查肿瘤边界,明确有无相应脏器或组织受累,明确有脏器或组织受侵者,经谨慎评估手术风险后行联合脏器切除以最大限度完整切除肿瘤。联合脏器切除8例,均含肾脏切除;另含肾上腺切除3例,左半结肠切除1例,下腔静脉壁切除修补1例。中位手术时间316(109~548)min,中位出血量600(15~2 000)mL,术中中位输血量800(0~2 400)mL,中位住院时间12.5(8~24)d。术后病理示DDLPS 5例、WDLPS 6例次、MYLPS 2例、WDLPS伴局部去分化纤维肉瘤1例(图1~3)。

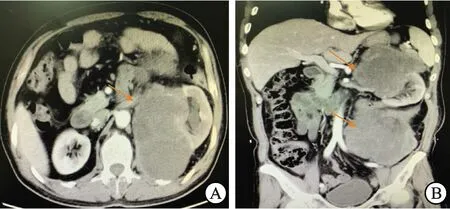
A:腹盆腔增强CT横断位显示左肾及左肾周占位(箭头处),强化明显;B:腹盆腔增强CT冠状位显示左肾及左肾周占位(箭头处),密度不均,形态不规则,增强后实性成分明显强化。术后病理:去分化脂肪肉瘤。
2.2 预后情况通过门诊及电话随访的方式,了解患者术后恢复、辅助治疗、肿瘤复发及生存情况。中位随访时间15.5(2~127)月,其中术后复发者11例次,死亡4例,均因肿瘤复发而去世,手术距复发中位间隔时间8(2~24)月。术后于外院再次手术者1例,该患者初次诊断时间为2014年6月,行手术切除肿瘤,随访3年后发现肿瘤复发,于2017年6月于我院行第2次手术。术后于外院定期复查,2019年3月发现肿瘤第2次复发于外院行第3次手术治疗,2019年5月肿瘤第3次复发行第4次手术治疗,并于2周后去世。术后辅助治疗1例,该患者于2019年12月因第2次复发于我院行手术治疗,2020年5月发现肿瘤第3次复发,综合评估后未行手术,现口服靶向药物治疗(具体不详)。
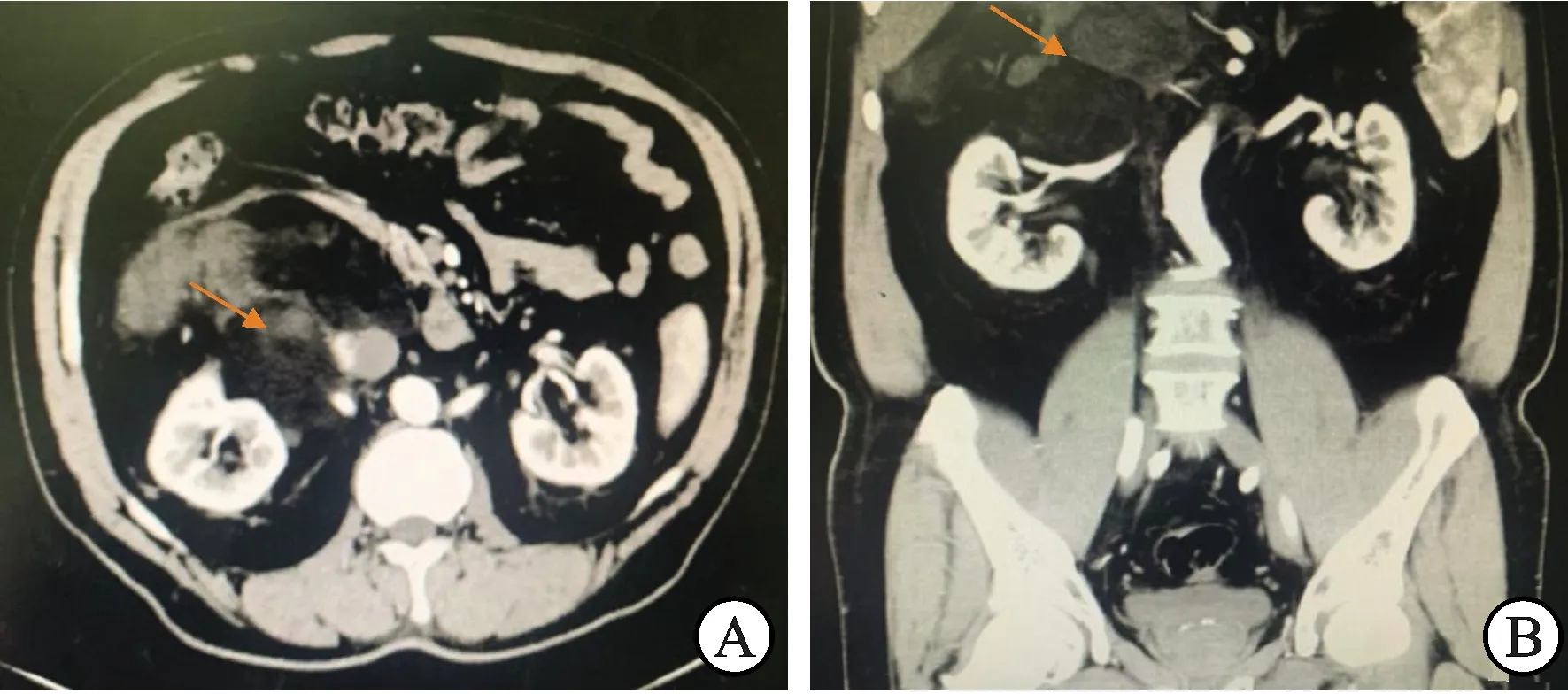
A:腹盆腔增强CT横断位显示左肾及肾周巨大占位(箭头处),密度不均,形态不规则;B:腹盆腔增强CT冠状位显示左肾周及下腹部团块影(箭头处),密度不均,可见少许脂肪密度,增强扫描病变不均匀强化。术后病理:黏液性脂肪肉瘤。
A:腹盆腔增强CT横断位显示右肾周占位(箭头处),内见大量脂肪密度,无明显强化;B:腹盆腔增强CT冠状位显示右肾周不规则混杂密度肿块影(箭头处),内部可见大片状脂肪密度影,多发纤细分隔、结节及不规则软组织密度影,实性成分增强扫描可见延迟强化。术后病理:高分化脂肪肉瘤。
3 讨 论
腹膜后肉瘤(retroperitoneal sarcoma,RPS)临床罕见,约占成人所有恶性肿瘤的0.1%。脂肪肉瘤最常见于四肢,其次是腹膜后。RPLS是PRS最常见的类型,约占RPS的50%[2]。PRLS起病隐匿,诊断及治疗困难。本文回顾性分析近10年间于我科行手术治疗且术后病理证实的12例RPLS患者的临床资料,检索相关文献,回顾总结RPLS的临床病理特征及诊疗策略。
RPLS早期无临床症状及体征,患者多因体检或肿瘤巨大出现腰腹部疼痛、肿块、胃肠道梗阻、下肢水肿及疼痛等非特异性症状而就诊[4]。影像学检查对诊断RPLS至关重要。B超是发现RPLS简单快捷的检查方法,本研究中无症状的5例次患者均为行B超体检时发现腹膜后占位而就诊。腹盆腔增强CT是辅助诊断的重要检查方法,其作用主要体现在以下3个方面:①评估肿瘤的来源、数目、位置、大小、血供、与周围临近脏器及血管的关系、有无其他脏器转移等;②与腹膜后其他软组织肿瘤进行鉴别,如脂肪瘤、髓样脂肪瘤和肾血管平滑肌脂肪瘤等;③预测脂肪肉瘤的具体病理类型,尤其对高分化及去分化脂肪肉瘤具有较高的预测准确性[5]。RPLS的CT影像学表现与肿瘤大小、亚型及分化程度有关,其特点表现为腹膜后含脂肪密度的混杂密度肿块,形态呈类圆形、椭圆形或不规则形,肿块直径通常>5 cm,界限清或不清,瘤内可见钙化,可伴有临近脏器,如肾脏、肾上腺、腰大肌、肠道等受侵征象[6]。MR对于RPLS的评估更为精准,尤其是当CT检查发现肿瘤与邻近血管如腹主动脉、下腔静脉关系密切时,MR可准确评估有无血管受侵,对手术方案的制定与实施具有重要价值。
穿刺活检是明确诊断的重要方法,其主要目的在于为不可切除、已有远处转移或明显手术禁忌患者的辅助治疗提供病理依据。目前推荐的穿刺方式为B超或CT引导下粗针(14~16 G)靶向穿刺活检,对肿瘤实性成分进行靶向穿刺可提高穿刺阳性率及诊断准确性。TIROTTA等[7]的研究共纳入121例腹膜后肿瘤的患者,所有患者均行B超或CT引导下穿刺,其中67%的患者可实现肿瘤实性成分的靶向穿刺。该研究发现穿刺活检与术后病理的一致率可达83%。术前穿刺可准确诊断DDLPS,灵敏度74%,特异度100%;对于WDLPS的诊断准确性较低,为58%(22/38),另外16例被误诊为DDLPS。但总体而言,B超或CT引导下粗针(14~16 G)靶向穿刺活检较传统细针穿刺活检诊断准确性明显提高。
手术是治疗原发及复发性RPLS最重要的治疗手段[8]。本研究中有1例患者9年前于外院行RPLS切除术,近期发现复发,由此可见手术可能使患者长期生存。初次手术应尽可能完整切除病灶,做到R0或R1切除。因RPLS易侵犯邻近脏器,如肾脏、肾上腺、结肠等,故多数情况下需行联合脏器切除术。但即便如此,RPLS的复发率仍然很高。手术方案需结合患者一般情况及术前影像学检查而制定,更广泛的切除策略包括联合脏器切除是否能够改善患者生存预后尚有争议[9]。多数研究推荐更广泛的手术切除,包括联合肾脏、肾上腺、结肠、小肠、腰大肌等脏器切除,尤其是对初发患者,这有利于提高局部控制率,降低术后复发率,可能延长患者肿瘤特异性生存期[10]。对于复发性RPLS,完整的手术切除仍是首选。若无法实现完整切除,姑息性手术切除可用于控制局部症状。
肾脏是腹膜后脂肪肉瘤行联合脏器切除时最常切除的器官。在本研究纳入的12例患者中,其中7例次切除了肾脏,6例次经术后病理证实存在肾脏受侵。RHU等[11]的研究发现对于术前明确有肾脏侵犯或与肾脏关系密切、疑有肾脏侵犯的RPLS,联合切除肾脏可提高患者无复发生存率,但对总生存率无影响。是否切除肾脏应充分考虑患者年龄、对侧肾功能情况、脂肪肉瘤类型等。ARGADJENDRA等[12]的个案报道认为对WDLPS仅侵犯肾周筋膜的年轻患者,在完整切除肾周筋膜的前提下,可考虑保留肾脏。
由于缺乏其他有效的治疗措施(放疗、化疗),手术仍是治疗复发性RPLS的主要手段,但手术指征、时机及切除范围尚无定论。本研究中有1例患者于2015年1月因RPLS行手术治疗,后于2016年5月因首次复发于我院行手术切除肿瘤+肾脏+部分下腔静脉壁,术后病理为WDLPS伴局部去分化纤维肉瘤。IKOMA等[13]的回顾性研究认为对于复发性腹膜后WDLPS,过早(<6个月)的手术干预并不能使患者有生存获益。另外,对于复发患者,联合脏器切除更应谨慎,除非术前影像学明确或高度怀疑有临近脏器侵犯,否则应避免联合脏器切除。但复发肿瘤边界及与周围脏器的关系常显示不清,术前进行精确的影像学评估有时是非常困难的。在IKOMA等[13]的研究中,共有32例术前影像学检查高度怀疑存在临近脏器侵犯的复发性RPLS患者,术后仅有3例经病理证实确有受侵。目前多数研究认为,完整的手术切除可能会延长复发患者的肿瘤特异性生存期,对于不可切除的复发肿瘤,姑息性切除虽不能改善生存,但可缓解症状[14]。对于生长速度>0.9 cm/月的复发肿瘤,完整的手术切除可能也无法延长患者生存期[15]。我国《腹膜后脂肪肉瘤诊断和治疗专家共识(2016)》复发性RPLS的手术指征为肿瘤>10 cm或出现脏器压迫影响功能[16]。
本研究中12例患者均未行围术期放化疗。总体而言,RPLS对化疗的反应差。阿霉素是化疗的一线首选药物,目前主要用于不可切除或已有远处转移的RPLS患者控制肿瘤进展,但无法改善患者生存预后。美国食品药品监督管理局已批准艾日布林用于治疗既往接受过蒽环类药物(如阿霉素)方案且不可切除或转移性的脂肪肉瘤患者,随着更多临床试验的开展,艾日布林在治疗脂肪肉瘤中的地位可能会逐渐提高[17]。其他化疗药物如吉西他滨、多西他赛、曲贝替定及CDK4抑制剂帕博西尼可作为二线及三线治疗选择,但各种药物的最佳适应人群及有效性仍需进一步研究评价[18-19]。放疗是RPLS可选择的治疗方式,但总体反应率低,疗效不佳。HAAS等[20]的多中心回顾性研究共纳入607例RPLS患者,研究显示围术期放疗并不能提高局部控制率、降低远处转移风险及改善患者总生存。另外,已有研究证实术前新辅助放疗并不能改善患者无进展生存期,反而会增加放疗相关并发症的发生,因此不推荐术前新辅助放疗治疗RPLS[21]。
RPLS最明确的预后影响因素包括病理亚型、组织学分级及肿瘤是否完整切除[22]。DDLPS和PLLPS侵袭性强,易复发转移,预后差。研究显示DDLPS 5年复发率高达80%,WDLPS 5年复发率50%[15]。另外,FNCLCC组织学分级越高,局部复发率越高。相较于初发患者,复发患者的预后更差[23]。主要原因考虑与以下两点有关:①部分复发肿瘤发生去分化改变,肿瘤侵袭性增强。本研究中有1例患者既往病理为高分化脂肪肉瘤,二次手术病理中出现去分化成分。②二次手术解剖层次不清,完整切除肿瘤难度增大。RPLS复发通常发生于术后6个月~2年内。本研究中共有11例次患者术后出现复发,均发生于术后2年内,因复发而死亡者4例。高复发率的主要原因考虑与手术患者中复发及DDLPS患者多、肿瘤侵袭性强有关,二次或三次手术时肿瘤完整切除的难度明显增大。
术后应结合患者一般状况及治疗情况,采取严密的随访方案。一般于彻底手术切除后第1个月进行基线检查,前3年内每3个月随访2次,3年以上者每6个月随访2次。具体随访内容应根据患者一般情况及治疗情况而定,包括病史、体格检查、血常规、生化、腹盆腔B超、CT或MR,必要时还可行胸部CT、骨扫描或PET-CT。
综上,RPLS起病隐匿,早期无任何临床症状,晚期症状无特异性。B超、腹盆腔CT和MR是发现和辅助诊断RPLS的重要方法。B超或CT引导下粗针靶向穿刺是明确诊断的重要方法,但目前主要应用于不可切除、已有远处转移或明显手术禁忌患者的辅助治疗提供病理依据。完整的手术切除是初发及复发RPLS患者唯一可能获得治愈的治疗方式,辅助放疗及化疗效果差,靶向治疗具有一定的应用前景。影响RPLS复发的因素包括病理亚型、组织学分级及手术能否完整切除肿瘤。RPLS易复发,应根据患者一般情况及具体治疗情况制定严密的随访方案。
