机器人辅助根治性膀胱切除加体内尿流改道术的临床应用
2021-10-12谢尚训张士伟冯宝富赵子涵张古田李笑弓甘卫东郭宏骞
谢尚训,张士伟,冯宝富,赵子涵,张古田,李笑弓,甘卫东,杨 荣,郭宏骞
(南京大学医学院附属鼓楼医院泌尿外科,江苏南京 210008)
根治性膀胱切除(radical cystectomy,RC)加尿流改道术仍旧被认为是肌层浸润性膀胱癌和高危非肌层浸润性膀胱癌的标准治疗方式[1]。该手术以往采用传统开放入路,常伴随着较高的并发症发生率[2]。近年来,机器人手术系统的出现大大提高了膀胱癌根治手术的质量,同时也进一步降低了手术的创伤[3]。然而,大多数外科医生在进行机器人辅助腹腔镜根治性膀胱切除术(robot-assisted radical cystectomy,RARC)时提倡采用机器人入路和开腹入路相结合,即利用机器人进行膀胱切除和淋巴结清扫,而在体外构建回肠膀胱或原位新膀胱[4]。随着手术经验的增加和手术器械的进步,体内尿流改道术(intracorporeal urinary diversion,ICUD)开始越来越多地应用于临床[5],其潜在的好处,如减少体液丢失、减少术中失血量、较小的切口、更快的肠道功能恢复和更少的吻合口狭窄,有助于患者术后快速康复。本文对62例在南京鼓楼医院接受机器人辅助腹腔镜根治性膀胱切除加体内尿流改道术(RARC+ICUD)的患者的临床资料进行回顾性分析,探讨该术式的可行性、安全性及短期瘤控效果。
1 资料与方法
1.1 临床资料2016年12月到2019年12月南京大学医学院附属鼓楼医院共有62例患者接受了RARC+ICUD,其中男性52例,女性10例;年龄46~81岁,平均(65.51±8.57)岁。在尿流改道方式方面,42例行回肠膀胱术,20例行原位新膀胱术。术前新辅助化疗3例,其中2例行回肠膀胱术,1例行原位新膀胱术;术后辅助化疗14例,其中12例行回肠膀胱术,2例行原位新膀胱术。患者术前均行血常规、胸部计算机断层扫描(computed tomography,CT)、心电图及肝肾功能检查。所有患者术前均行经尿道膀胱肿瘤电切术,病理确诊为肌层浸润性尿路上皮癌或高危非肌层浸润性尿路上皮癌。
1.2 手术步骤患者采用全身麻醉,取35°~45°头低脚高体位,留置导尿管。麻醉成功后,常规消毒铺单,采用6孔入路法。脐上为扶镜臂孔,第1、2机械臂分别于平脐右、左侧各8~10 cm。第3机械臂于脐孔左侧,距第2机械臂孔8 cm。第1辅助孔距第1机械臂孔右侧8 cm。第2辅助孔位于扶镜臂孔与第1机械臂孔连线中点垂直线上,距第1机械臂孔8 cm。
游离输尿管至近输尿管入膀胱处,近膀胱壁处结扎输尿管然后离断。将膀胱底部向上牵拉显露膀胱直肠陷凹(或直肠子宫陷凹),横行切开腹膜,游离显露输精管及精囊,横行切开Denonvilliers筋膜,沿前列腺背面一直分离至前列腺尖部。打开膀胱侧壁腹膜,显露并离断膀胱及前列腺侧血管蒂。分离进入膀胱前间隙直至前列腺尖部,显露背深静脉复合体(dorsal vein complex,DVC),“8”字缝合结扎DVC。剪断尿道前壁及后壁,完整切除膀胱、前列腺及双侧精囊和部分输精管。女性患者则在先后游离膀胱侧壁、子宫后壁、膀胱前壁后,完整切除膀胱、子宫及附件,将标本放入标本袋后,经阴道取出。接着行双侧盆腔淋巴结清扫术,本队列患者的扩大淋巴结清扫范围包括:髂外、髂内、闭孔、髂总和骶前淋巴结,标准淋巴结清扫范围则不包括髂总和骶前淋巴结。清扫右侧髂总淋巴结时避免损伤右侧髂总静脉和腔静脉,清扫骶前淋巴结时注意左侧髂总静脉,清扫闭孔淋巴结时注意保护闭孔神经。
体内回肠膀胱术(图1):选取距回盲部20 cm处量取约15 cm回肠段,以腔内直线切割器于所取回肠的近、远端分别离断肠管和系膜。远、近回肠断端采用侧侧吻合的方式重新建立连接:选择对系膜缘利用切割闭合器建立连接,远端开口封闭。可吸收缝线连续关闭肠系膜。在回肠膀胱的近端切开回肠肠壁,将输尿管黏膜与肠黏膜行端侧吻合(Bricker法)。回肠膀胱于右下腹处切开引出,做回肠膀胱乳头造口。
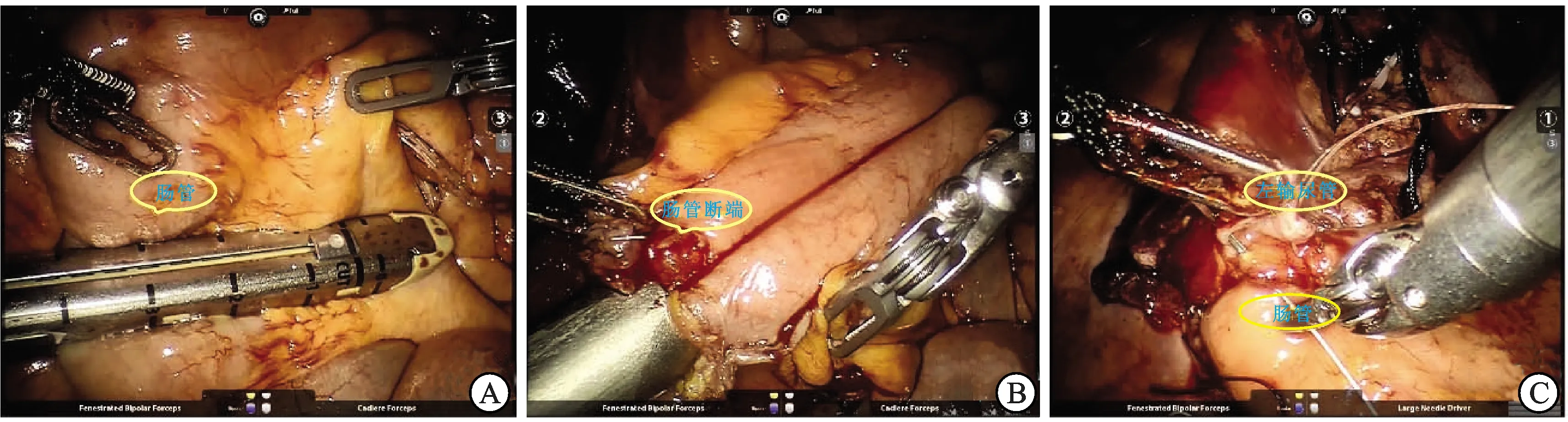
A:直线切割器切断肠管和系膜;B:直线切割器行侧侧吻合肠管恢复肠道连续性;C:缝合输尿管和回肠膀胱黏膜。
体内原位新膀胱术(图2):选取距回盲部20 cm处带血供的肠管55 cm回肠,腔内直线切割器将回肠近、远端的肠管和系膜钳夹离断,并将两断端侧侧吻合。将肠管远端约20 cm处的后壁开口与尿道后壁完成新膀胱尿道的后壁吻合,接下来将新膀胱尿道吻合口上下游各20 cm的肠管用电刀剖开,在腔镜下制作完成原位新膀胱(改良Studer法)。新膀胱尿道的吻合是新膀胱构建过程中的难点,可以通过体位改变、将肠管后壁和尿道后壁做减张缝合等方式减少吻合张力。保留前列腺尖部和加用倒刺线可进一步有助于吻合成功。留置导尿管,将150 mL生理盐水注入新膀胱,检测密闭性。在近端回肠新膀胱顶部将两侧输尿管黏膜与肠黏膜行端侧吻合。于新膀胱前壁开口造瘘,留置F20蕈状管,以便术后冲洗新膀胱。
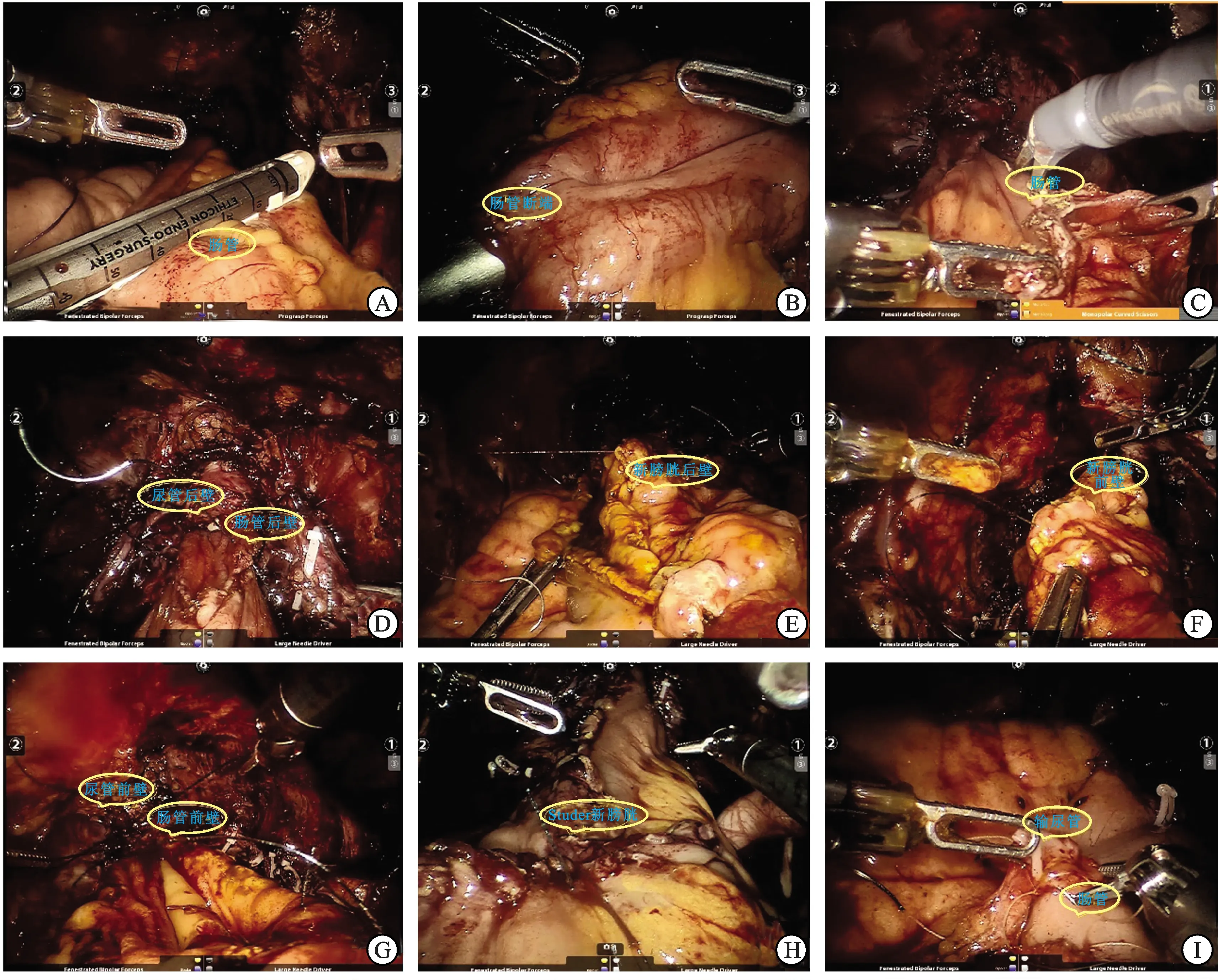
A:直线切割器切断肠管和系膜;B:直线切割器行侧侧吻合肠管恢复肠道连续性;C:电刀切开肠管;D:新膀胱尿道吻合;E:新膀胱后壁缝合;F:新膀胱前壁缝合;G:新膀胱尿道吻合;H:Studer新膀胱缝合完成后;I:输尿管新膀胱吻合。
1.3 术中观察指标及术后随访方法在术中,新膀胱注入生理盐水观察新膀胱尿道吻合口和新膀胱输尿管吻合口是否出现“漏尿”,如果出现“漏尿”,可以适当多缝合几针。此外,注意观察肠管吻合口有无出血点,必要时电凝止血。
RARC术后无需等待通气,即刻拔除胃管;术后第1天即下床活动;适当使用镇痛类药物,尽量避免使用阿片类药物;保持盆腔引流通畅:术后约3~7 d拔除。对于行回肠膀胱术的患者,每2天清洁造口及周围皮肤,并更换造口底盘和造口袋,出院后则每1周更换1次,术后4周拔除双J管。对于行原位新膀胱术的患者,使用250 mL生理盐水每天2次冲洗新膀胱,保持尿液引流通畅;术后3周拔除导尿管和双J管,4周拔除膀胱造瘘管。
RARC术后1年内每3个月随访1次,第2年每6个月随访1次,往后每年随访1次。随访内容包括体格检查、血常规、肝肾功能、电解质、胸部CT、腹部和盆腔CT检查(是否行增强CT扫描视患者肾功能而定),接受原位新膀胱术的患者行尿流动力学检查评估新膀胱的尿控。根据Clavien-Dindo分级系统将术后90 d内发生的并发症分为低级别并发症(GradeⅠ~Ⅱ)和高级别并发症(Grade Ⅲ~Ⅴ)[6]。
2 结 果
2.1 围手术期结果62例手术均成功完成,均未中转开放。回肠膀胱术与原位新膀胱术的手术时间分别为405~560(482.50±77.50)min、490~550(520.00±58.17)min;术中估计失血量分别为400~1 200(800.00±400.00)mL、400~600(500.00±211.48)mL;术中输血分别为9例、3例;术后通气时间分别为1~3(2.00±1.00)d、2~3(2.50±0.62)d;术后通便时间分别为2~6(4.00±2.00)d、4~5(4.50±1.40)d;术后住院时间分别为13~32(22.50±9.50)d、9~25(17.00±8.73)d。接受回肠膀胱术的患者术后90 d内共有20例(47.62%)出现不同级别并发症,最常见的并发症为尿路感染,其次是肠梗阻,其中有4例(9.53%)出现高级别并发症。接受原位新膀胱术的患者术后90 d内共有6例(30.0%)出现不同级别并发症,最常见的并发症为尿路感染,其中有0例出现高级别并发症。2种尿流改道方式的患者围手术期均未出现死亡病例,详见表1。
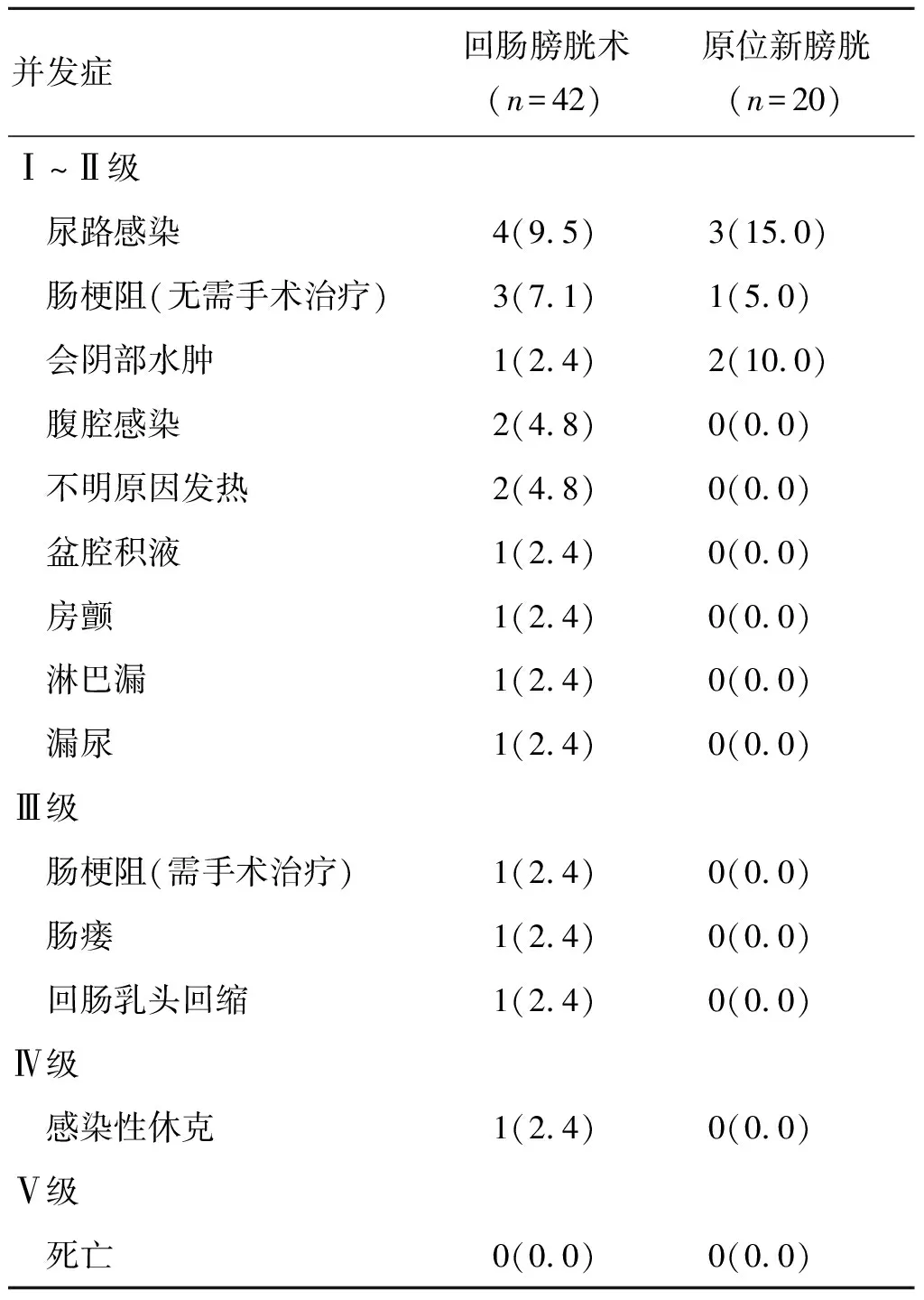
表1 参考Clavien-Dindo分级系统并发症统计 [例(%)]
2.2 病理结果术后病理报告提示高级别尿路上皮癌46例、原位癌2例、高级别尿路上皮癌伴原位癌14例。Tis期6例,Ta期3例,T1期22例,T2期17例,T3期12例,T4期2例;淋巴结转移7例,脉管侵犯8例,神经侵犯8例,切缘阳性0例。清扫淋巴结数量5~32(17.24±6.25)个,接受回肠膀胱术的患者有6例进行了标准淋巴结清扫,36例进行了扩大淋巴结清扫;接受原位新膀胱术的患者有2例进行了标准淋巴结清扫,18例进行了扩大淋巴结清扫。
2.3 随访结果术后随访6~44(17.31±8.22)个月,接受回肠膀胱术的患者有2例肺转移、1例盆腔转移、1例腹腔转移、1例腹膜后淋巴结转移,死亡3例。接受原位新膀胱术的患者有1例同时出现了肺转移、肝转移和腹壁转移,该例患者死亡。
3 讨 论
RC是肌层浸润性膀胱癌和高危非肌层浸润性膀胱癌的标准治疗方式。RC包括膀胱切除术、盆腔淋巴结清扫术以及尿流改道术3个部分,是一项技术较为复杂的手术。由于这一手术涉及泌尿道和消化道2个系统,切除范围广,手术创伤较大,因此并发症较多。一项随机对照研究结果显示,开放RC总的术后并发症发生率为67%,严重并发症发生率高达22%;最常见的术后并发症为尿路感染和肠梗阻,此外还有结肠炎、败血症、急性肾功能衰竭等[7]。研究显示,RC术后并发症较高可能主要与尿流改道术有关[8]。
近年来,得益于达芬奇机器人手术系统优秀的可视化功能和灵活的机械臂,RARC逐渐得到了推广和应用。PAREKH等[7]的3期临床对照试验显示,RARC在肿瘤控制方面效果与开放RC相一致,且在减少术中出血量、缩短住院时间方面具有优势。同时,其在术后性功能恢复和尿控方面也显示出了较大的优势[9-10]。随着腔内器械的不断发展,基于机器人手术的完全ICUD逐渐应用于临床,2003年,BEECKEN等[11]报道了世界上首例RARC+ICUD。随后,有相当多的ICUD相关的回顾性报道相继发表。SIM等[12]报道了101例患者行RARC+ICUD术(73例原位新膀胱术,28例回肠膀胱术)的相关数据,平均手术时间402 min,平均术中估计出血量345 mL,平均住院时间17.1 d。HUSSEIN等[13]报道了1 094例患者接受RARC+ICUD(231例原位新膀胱术,863例回肠膀胱术)的数据,中位手术时间为357 min,中位术中估计出血量300 mL,中位住院时间9 d。本研究的手术时间及术中估计出血量较上述2项研究更高,而术后住院时间与SIM等的研究相当,但高于HUSSEIN等[13]的研究,这些数据的差异可能与样本量较小及初始学习曲线有关。TAN等[14]的RARC+ICUD研究(均为回肠膀胱术)中,与前30例相比,后29例的中位手术时间显著减少(300vs.360 min,P=0.004),我们相信随着手术经验的增加,必将进一步缩短手术时间和减少术中出血量。
与体外尿流改道术(extracorporeal urinary diversion,ECUD)相比,RARC+ICUD被认为可以进一步降低手术并发症发生率[14-16]。最近的一项比较开放RC、RARC+ECUD与RARC+ICUD的大样本研究显示,RARC+ICUD组较其他两组术中出血量更少、住院时间更短,肠梗阻发生率和严重并发症发生率亦更低[17]。本研究结果与上述研究中的RARC+ICUD组术后90 d总并发症发生率和术后住院时间相当,而严重并发症发生率则较之更低。由此可见,RARC确实降低了RC手术并发症的发生率,有利于患者术后的恢复。我们相信随着手术量的增加,必将进一步凸显其微创优势。
在尿流改道方面,ICUD相较体外尿流改道术理论上的优势包括:首先,体内尿流改道可避免肠道的暴露,减少因体温过低和脱水导致的体液丢失,从而减少术后全身炎症反应,促进肠道的恢复[18]。本队列患者术后较早通气[(1.77±0.71)d]和通便[(3.79±1.66)d],仅5例患者术后发生肠梗阻,其中1例需要手术干预;本研究显示ICUD术后肠道功能恢复较为迅速。此外,ICUD可一定程度地减少输尿管游离的长度,从而降低了由于输尿管远端缺血造成狭窄的风险[19]。本中心的原位新膀胱术采用改良的Studer膀胱,保留了近端10 cm左右的肠管用于输尿管吻合,可以减少输尿管与新膀胱吻合的张力以及有一定的抗反流作用。此外,至末次随访,本队列所有患者均未出现血肌酐上升,提示暂未出现由输尿管狭窄引起的肾积水或肾功能不全,但长期的风险仍需进一步的随访明确。
淋巴结清扫范围和数量是膀胱癌瘤控的重要参数之一。已有随机对照试验显示,与标准淋巴结清扫组相比,扩大淋巴结清扫组获得淋巴结数量更多(中位数31个vs.19个),围术期主要并发症发生率与之没有差异,且有着较好的5年无复发生存率(64.6%vs.59.2%),中位总生存时间获益18.4个月[20]。由于机器人手术的3D视野和灵活操作,因此被认为更有利于进行淋巴结清扫手术[21]。一项比较开放RC和RARC的对照研究显示,在相似的清扫范围下,RARC可获取比开放RC更多的淋巴结(平均22个vs.17个)[22]。然而,PAREKH等[7]的研究表明RARC和开放RC之间的淋巴结清扫数量无显著差异(平均23.3个vs.25.7个)。这可能是由样本数量不同、不同医生扩大淋巴结清扫的选择偏倚等原因造成的。本研究扩大淋巴结清扫占87.10%,淋巴结数量(17.24±6.25)个,这与既往研究相比存在一定差异。我们分析考虑原因可能是:在清扫范围相似的情况下,淋巴结数量可能还与病理取材有关。
总之,机器人辅助根治性膀胱切除加ICUD为膀胱癌患者提供了一种围手术期安全性高、短期疗效明确的微创手术治疗选择。然而,本研究仍有一定的局限性,对于2种尿流改道方式之间肿瘤复发模式的差异,我们尚不能十分明确,下一步我们将延长随访时间以及扩大手术量,以期将来描述二者的差异。此外,对于该术式的长期效果和瘤控评估,有赖于长期的随访和大型的前瞻性研究。
