“增己降乳”组合菌制剂在浓香型白酒中的应用研究
2021-10-11何宏魁曹润洁周庆伍李安军汤有宏张光耀
何宏魁,曹润洁,周庆伍,李安军,汤有宏,张光耀
(1.安徽瑞思威尔科技有限公司,安徽亳州 236820;2.安徽省固态发酵工程技术研究中心,安徽亳州 236820;3.安徽古井贡酒股份有限公司,安徽亳州 236820)
窖泥是中国所有涉及到使用窖池固态发酵的白酒酿造的基础,是一个扩大化了的适合白酒发酵功能菌代谢、生长繁殖的广义培养基。白酒界素有“千年窖池万年糟,酒好全凭窖池老”的说法,其根本原因在于窖池中窖泥的微生物活性及其群落组成结构的差异性[1],窖泥微生物的重要作用不言而喻。己酸乙酯[2-3]是中国各大香型白酒中重要的风味物质之一,更是浓香型白酒的主体香味成分,对白酒酒体的风格有着重要的作用,己酸是合成己酸乙酯的重要前体物质[4],己酸菌是一类能够产生己酸的菌,多数以梭菌属为主[5]。窖泥中己酸菌活菌数的测定一直是白酒生产过程中发酵容器窖池中窖泥的重要理化指标之一,多被认为是发酵过程最终形成的白酒产质量的一项重要影响因素。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品
老窖池新鲜窖泥、新鲜酒醅。
1.1.2 营养液的配制
取新鲜的窖泥和新鲜的酒醅按照1∶1 溶于1000 mL ddH2O,使用粉碎机打碎,12000 r/min 离心10 min,收集上清液,即为营养液。
1.1.3 培养基的配制
瘤胃球菌属培养基:CuCl2·2H2O、AlCl3、Na2MoO4·2H2O 分别称取0.1 g,制成10 mL 溶液,标记为0.01 g/ mL;Pyridoxine 吡哆醇/维生素B6、Biotin 生物素、p-aminobenzoic acid 对氨基苯甲酸、lipoic acid 硫辛酸、Riboflavin 核黄素/维生素B2、维生素B12、叶酸分别称取0.1 g,制成10 mL 溶液,并将上述配制完成的溶液置于4 ℃保存。
Clostridium 梭菌属培养基:酵母提取物0.6 g,蛋白胨2 g,葡糖糖1 g,氯化钠1 g,牛肉膏2 g,可溶性淀粉0.2 g,半胱氨酸盐酸盐0.1 g,乙酸钠0.6 g。制成200 mL 溶液,并将上述配制完成的溶液置于4 ℃保存。
1.1.4 仪器设备
安捷伦GC7890气相色谱仪。
1.2 实验方法
1.2.1 混菌制剂的制备
分别将各个梯度菌悬液铺在上述步骤中的培养基上,37 ℃厌氧培养3~5 d,得到的优势菌菌落作为混菌制剂种子分别进行扩大培养后按照一定比例进行菌苔混合制作混菌制剂。
1.2.2 混菌制剂混合菌液实验室培养
在500 mL 的营养液中,添加酵母提取物1.5 g,蛋白胨5 g,葡萄糖2.5 g,氯化钠3.0 g,牛肉膏2.5 g,可溶性淀粉1.0 g,半胱氨酸盐酸盐0.25 g,乙酸钠1.5 g,刃天青钠盐2.0 g。把纯培养备份的优势厌氧菌(菌落大小直径为2.5~3 mm)按照一定的菌落个数比例混合在一起制成混合菌液,对照组则不加混合菌,最终pH 值调至7.0,灭菌除氧,厌氧罐中培养7 d。
1.2.3 混菌制剂应用前后发酵出池酒醅微生物群落结构解析
选取3 个车间9 个窖池用于测试,其中老窖池(约50 年窖龄)(A01),两个实验组窖池(A0102、A0104)、不加混菌制剂的对照组(A0106);新窖池(3-5 年窖龄)(C02、C05),其中一个车间两个实验组窖池(C0201、C0203)、不加混菌制剂的对照组(C0209),另一车间两个实验组窖池(C0512、C0514)、不加混菌制剂的对照组(C0510)。混菌制剂投放前取每个窖池池底窖泥及底层酒醅,混菌制剂投放窖池底部经一个轮次的发酵后再次取相应窖池的池底窖泥及酒醅作为高通量测序的样品,高通量测序方法采用细菌16S(V3—V4 区)扩增子测序[6],扩增引物[7-8](GTACTCCTACGGGAGGCAGCA、GTGGACTACHVGGGTWTCTAAT),样品由北京奥维森生物科技公司进行测序。
1.2.4 酒样色谱分析方法
气相色谱检测[9]在安捷伦GC7890 气相色谱仪上进行。
上样柱载气是氮气,纯度≥99.999%,流速为1.0 mL/min,在25 ℃下检测其压力值为15p.s.i.(磅/平方英寸)。用于样品分析的色谱柱为:CP-WAX 50 CB(50 m×0.25 mm×0.2 μm)毛细管柱。进样量为1µL,进样口温度:230 ℃;进样方式:分流进样,分流比60∶1。
色谱柱温度变化为:35 ℃保持3 min,然后以5 ℃/min程序升温至100 ℃,不保持,再以10 ℃/min升温至195 ℃,保持18 min。注射器和检测器的温度为210~240 ℃[10]。
2 结果与分析
2.1 功能菌种筛选及鉴定
提取各个菌落的基因组,扩增16S 全长rDNA并测序通过NCBI 比对,得到优势菌株鉴定结果见表1,在本研究中的厌氧培养条件下,生长的厌氧菌落主要包括Clostridium tyrobutyricum酪丁酸梭菌、Ruminococcaceae bacteriumCPB6反刍球菌细菌CPB6、Lactobacillus acidipiscis乳酸杆菌、Lactobacillussp.乳杆菌(本研究中编号为GJG1)、Lachno-spiraceae bacteriumBTY6 木犀科细菌BTY6、Clostridium beijerinckii拜氏梭菌(本研究中编号为GJG2)等优势菌种。这些经过分子鉴定的优势厌氧菌都可以进一步纯培养并通过菌苔生长实现扩大培养。

表1 本研究中所鉴定的菌种
2.2 混菌制剂在窖池中的初步应用
将反刍球菌细菌CPB6、酪丁酸梭菌、乳杆菌GJG1、乳酸杆菌、木犀科细菌BTY6 以及拜氏梭菌GJG2 按照一定的菌落个数比例混合于培养基中获得混菌悬液。将所得混菌悬液铺板培养获得混菌菌苔(厌氧培养的温度37 ℃时间96 h),取池底新鲜窖泥,将混菌制剂与之混合均匀,采用一定的方式制作成混菌制剂,将制作好的混菌制剂均匀投放在窖池底部,入池完毕后封窖随窖池进行发酵。
2.3 混菌制剂实验室发酵情况
混合菌液发酵实验产酸结果如表2所示。
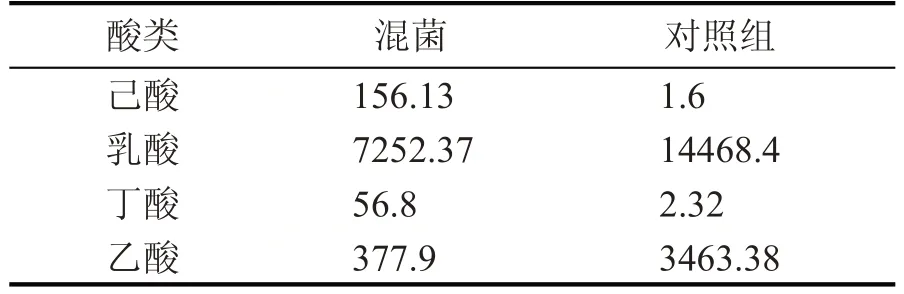
表2 混合菌液发酵实验产酸情况 (mg/L)
由表2 可知,混合菌液具有显著消耗乙酸、乳酸和产己酸、丁酸的能力,其中,对照组产乳酸是混合菌液的2 倍,对照组产乙酸是混合菌液的接近10倍,混合菌液产己酸是对照组的接近100倍。
2.4 混菌制剂应用前后发酵出池酒醅微生物群落结构对比分析
表3 是测试窖池窖泥及酒醅加混菌制剂前及发酵一轮次后样本的OTU 数、Chao1 指数[11]。以实验组C0201、C0203,对照组(不添加混菌制剂)C0209 窖泥及酒醅样本为例,其OTU 数目显示,经加过混菌制剂的实验组酒醅PC0201-1、PC0203-1和窖泥NC0201-1、NC0203-1 的OTU 数目均比对照组增幅较大,数据结果表明,混菌制剂的加入使得测试窖池微生物丰富度指数及数量得到显著提升,其他6个窖池也表现出相似的规律。
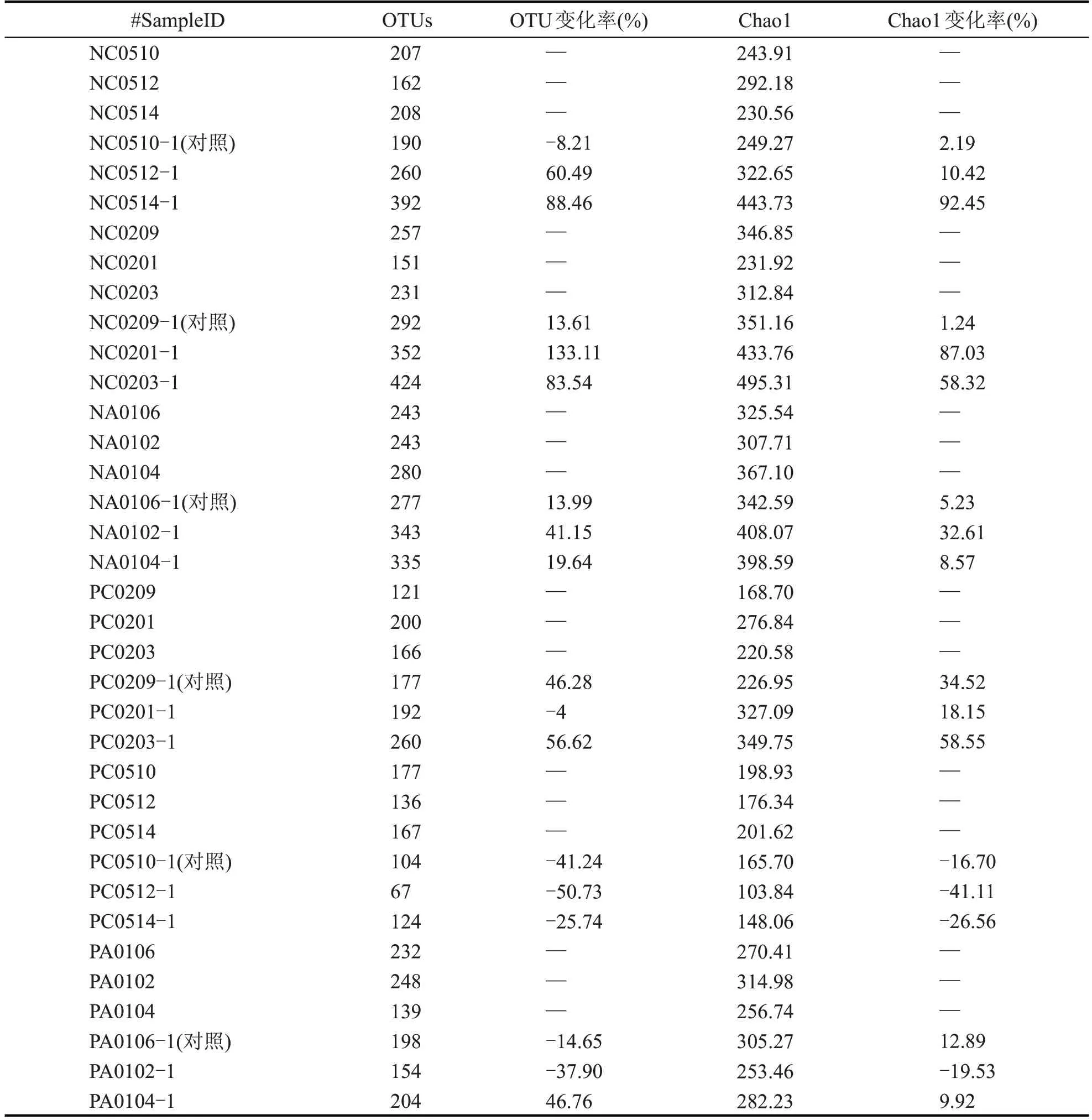
表3 测试窖池窖泥及酒醅加混菌制剂前及发酵一轮次后样本的OTU数、Chao1指数
图1为测试窖池C02窖泥加混菌制剂前及发酵一轮次后样本细菌属水平分布。由图1 可知,不加菌的对照组发酵结束后窖泥中Lactobacillus乳酸杆菌含量增幅较大,经一轮发酵后Lactobacillus含量相对占比由6.79%升到54.74%,远高于发酵前的含量,而加菌的实验组的Lactobacillus乳酸杆菌含量在发酵结束后不仅没有升高,且明显低于发酵前,物种丰富度较之对照组高,尤其对新窖池C0201,其窖泥第一轮次发酵前Lactobacillus含量相对占比90.91%,添加混菌制剂发酵结束后相对占比2.93%。图2的测试窖池C05窖泥加混菌制剂前及发酵一轮次后样本细菌属水平分布显示实验组乳酸杆菌含量相对对照组降低显著的是窖池C0514-1,由第一轮次发酵前Lactobacillus含量相对占比78.33%,添加混菌制剂发酵结束后相对占比36.66%。图3 的测试窖池A01 车间窖泥加混菌制剂前及发酵一轮次后样本细菌属水平分布显示代谢产物能够形成己酸乙酯的前体物质己酸的细菌Caproiciproducens实验组增加的比例最大,发酵前后Caproiciproducens含量相对平均占比由7.59%提升到24.38%。图4、图5 优势菌Ruminococcaceae、Clostridium、Syntrophomonas、Aminobacterium均有不同程度的增高,尤其对新窖池C02 车间表现更为显著,其中C0201 窖池经一轮次发酵消耗后,Ruminococcaceae 含量由发酵前的3.5%提高到12.06%,而对照组窖池C0209 经一轮次发酵消耗后,Ruminococcaceae 含量由发酵前的50.9%降低到9.17%。

图1 测试窖池C02窖泥加混菌制剂前及发酵一轮次后样本细菌属水平分布
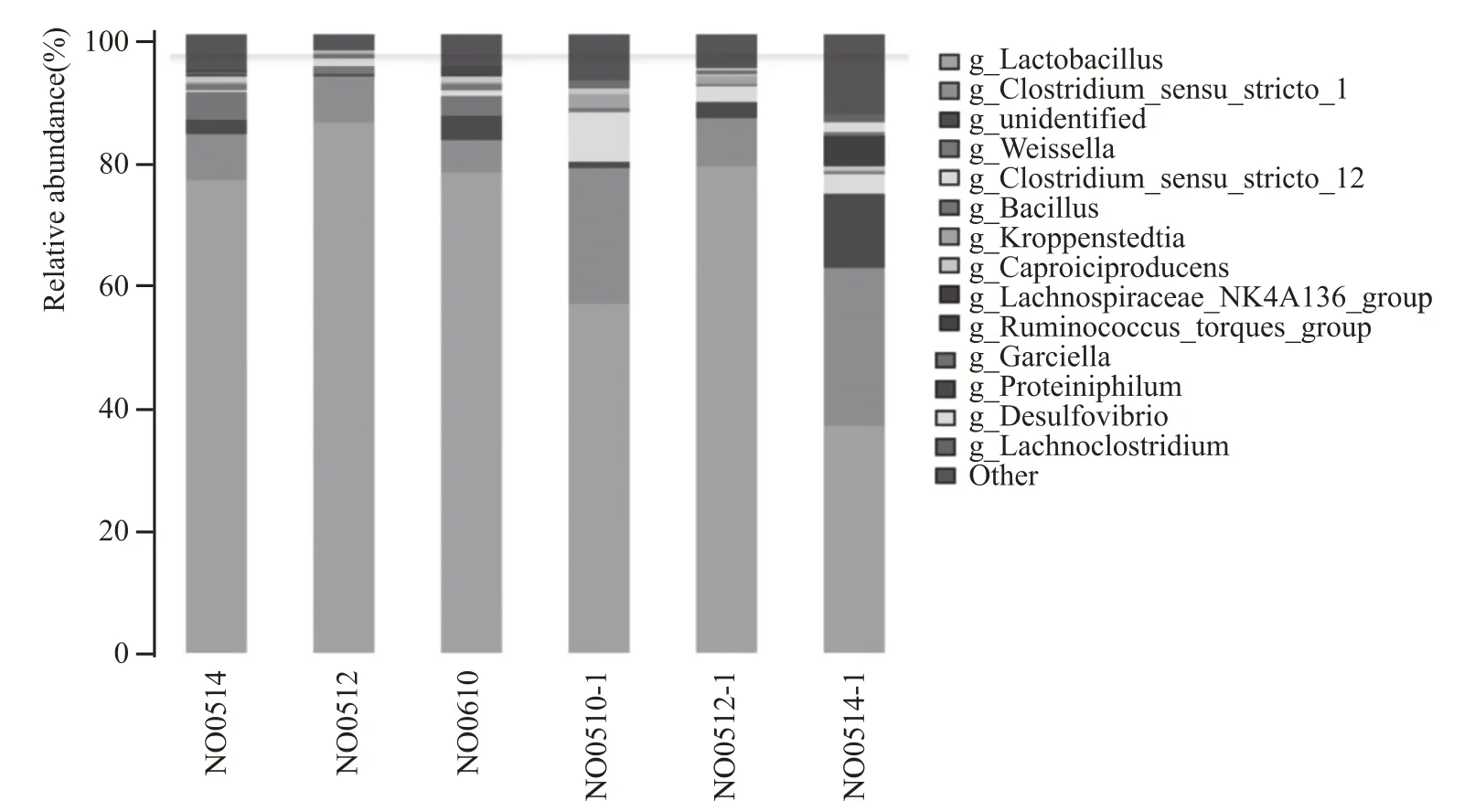
图2 测试窖池C05窖泥加混菌制剂前及发酵一轮次后样本细菌属水平分布

图3 测试窖池A01车间窖泥加混菌制剂前及发酵一轮次后样本细菌属水平分布

图4 测试窖池加菌后科水平分布含量前8的微生物
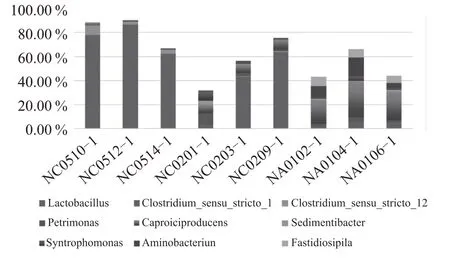
图5 测试窖池加菌后属水平分布含量前8的微生物
2.5 混菌制剂应用后出池酒醅风味物质对比分析
由表4 可知,加混菌制剂发酵结束后实验组和对照组出池酒醅的风味物质含量中,己酸乙酯含量增加量较多,实验组酒醅中己酸乙酯含量提高3 倍左右,同时乳酸乙酯含量比对照组低,而对照组酒醅中发酵前后变化不大。此外,己酸含量增加量较多,在酒体风格影响作用较大的呈香物质的总量上,实验组比对照组是显著提升的。
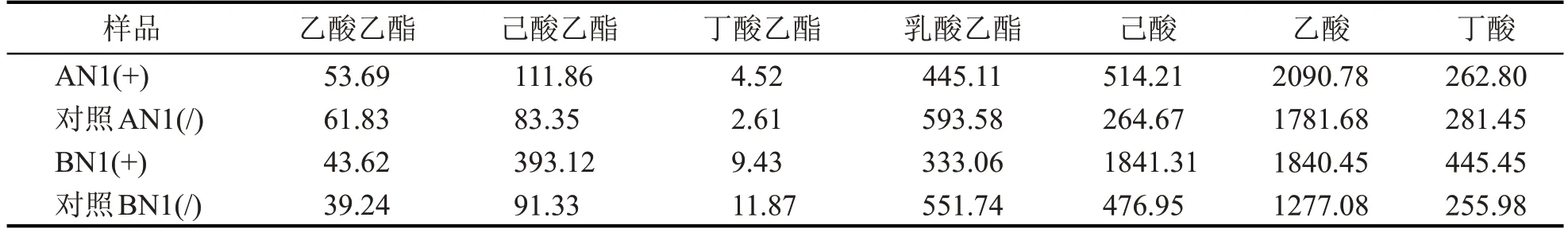
表4 加混菌制剂发酵结束后出池酒醅的风味物质含量对比分析 (mg/L)
2.6 混菌制剂应用后出池酒醅和窖泥理化分析
由表5可知,加混菌制剂发酵一轮后,A车间发酵后出池酒醅实验组淀粉含量比例8.32%,对照组10.35%,B 车间经发酵一轮后,实验组淀粉含量比例比对照组含量低,表明实验组中淀粉被相关微生物分解得更充分,发酵更为充分,酒醅发酵程度提高。
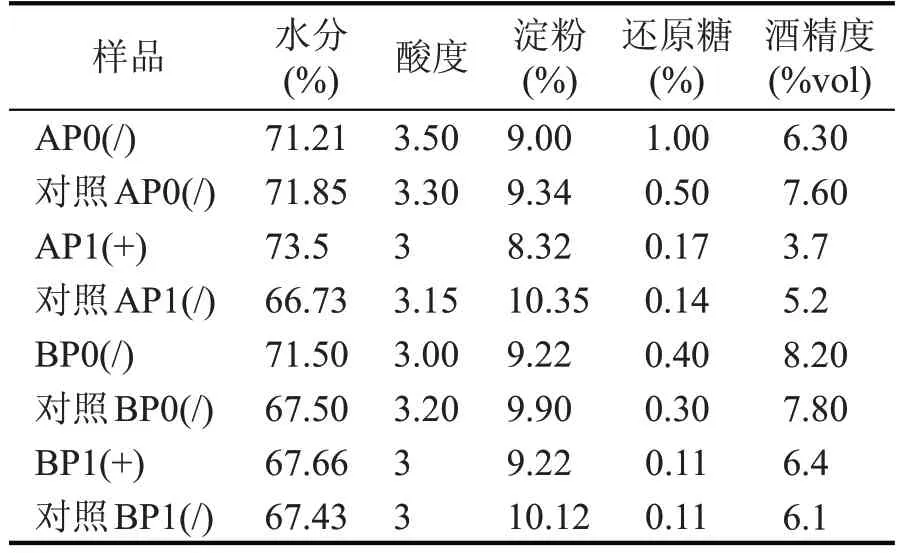
表5 混菌制剂应用后发酵前后出池酒醅理化指标对比分析
由表6 可知,加混菌制剂发酵一轮后,池底窖泥的pH 值有所改善提升,两个车间实验中,发酵结束后,己酸菌活菌数实验组和对照组都有所增加,实验组的增幅比对照组的增幅更大。表明加了“混菌制剂”的实验组窖泥己酸菌活菌数高于对照组。
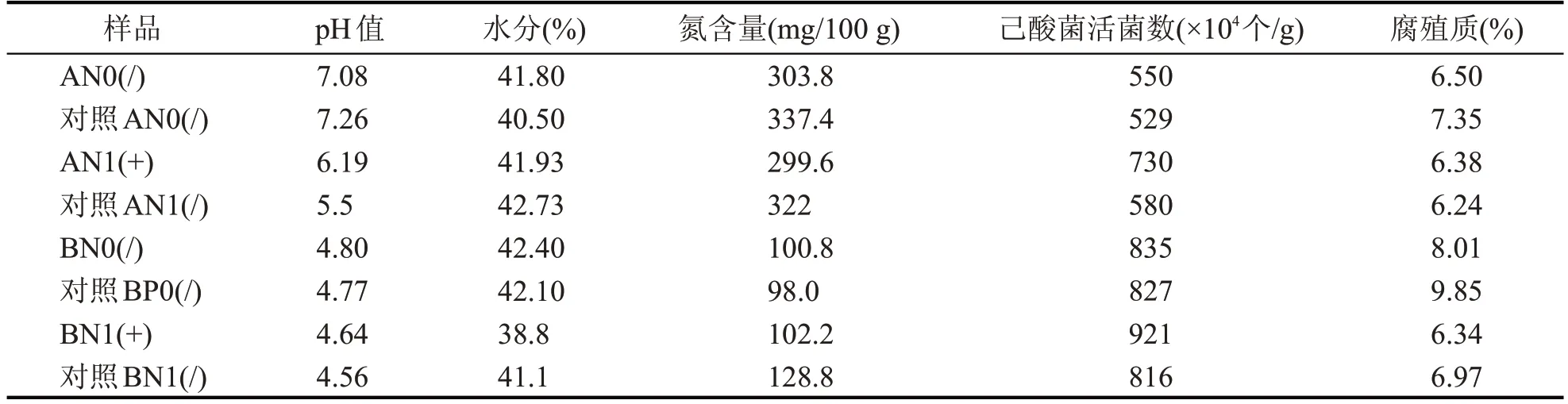
表6 加混菌制剂发酵前后窖泥理化指标对比分析
2.7 混菌制剂应用前后酒样香味成分对比分析
由表7 可知,横向对比,实验组和对照组(不加菌)的窖池发酵一个周期后,酒样中四大酯(己酸乙酯、乙酸乙酯、乳酸乙酯、丁酸乙酯)含量呈增加的趋势,其中浓香型的主体香己酸乙酯含量实验组比对照组多,横向对比,实验组和对照组表现出呈酸类物质也略有升高,实验组比对照组己酸含量高,乙酸、丁酸含量接近。纵向对比,每个窖池加菌前后的含量比较,酯含量尤其是实验组己酸乙酯含量增幅相对对照组较大,乳酸乙酯增幅相对己酸乙酯的增幅小,酸类含量增幅与对照组相比差别不大。

表7 加混菌制剂测试前后基酒酒样风味物质含量对比分析 (mg/L)
3 结论
混菌制剂实验室发酵,发现混合菌液具有显著消耗乙酸、乳酸和产己酸、丁酸的能力,其中,对照组产乳酸是混合菌液的2 倍,对照组产乙酸是混合菌液的接近10 倍,混合菌液产己酸是对照组的接近100倍,混合菌液产丁酸是对照组的23倍。
混菌制剂应用前后发酵出池酒醅微生物群落结构高通量测序结果及酒样色谱数据表明,加入使得测试窖池微生物丰富度指数及数量得到显著提升。在一定程度上测试前后,乳酸杆菌含量实验组降低效果显著,产己酸等菌含量显著增多,加菌测试起到“增己降乳”的作用,对己酸乙酯含量低的新窖池(如C02 车间)效果更显著,提高基酒酒样中风味物质总含量,提高浓香型主体香己酸乙酯含量。
窖池加混菌制剂发酵后,出池酒醅实验组比对照组残余淀粉含量比例小,表明实验组中淀粉被相关微生物分解得更充分,发酵更为充分,酒醅发酵程度提高,改善窖泥pH 值,提高窖泥中己酸菌活跃度。酒醅发酵后的风味物质总含量提高,且己酸、己酸乙酯含量增多,乳酸乙酯含量减少。
综上结果表明,混菌制剂的加入能够使得己酸菌活跃程度提高,提高浓香型白酒固态发酵过程中的己酸乙酯含量,同时降低乳酸乙酯含量,且呈香物质的总量高、出池酒醅淀粉残余量小,发酵更充分。
