营养不良患者再喂养综合征的临床实践体会
2021-10-10黄丽霞李丽婷张蓝朗叶华
黄丽霞,李丽婷,张蓝朗,叶华
再喂养综合征(refeeding syndrome,RFS)是一种代谢疾病,其特征是营养不良患者在开始营养治疗后从分解代谢状态转变为合成代谢状态时出现的严重的电解质紊乱[1,2]。临床的表现形式从轻度症状和体征到发生严重的可影响到生命体征的并发症[3]。RFS会影响多个器官的功能,导致心律失常、心力衰竭和肾衰竭等损害[5,6]。目前对其诱发因素、发病原因了解不足,没有诊断RFS的金标准,临床病程、病理变化、预后及死亡率在很大程度上仍没有一个清晰的定论,也缺乏系统观察RFS的大样本的随机对照研究。本文章的目标是根据先前发表的诊断共识标准,回顾性研究RFS患者的临床特征和处理情况。
1 材料与方法
1.1 研究对象
采用回顾性研究方法。收集2020年4月至2021年3月在我院住院患者的临床资料(包括临床病历和护理记录)。入组标准:①营养风险筛查总分(NRS 2002)≥3分;②入院前没有接受肠内营养大于1周;③入院后接受肠内或肠外营养>3天,住院时间超过7天;④临床资料完整,如完整出入院检查、实验室检查资料、术后1月的随访资料。排除标准:入院时已经接受营养支持、因神经性厌食症、急性胰腺炎、急性肝功能衰竭、无法口服营养或有营养支持禁忌症患者、小儿患者。总共67例患者符合纳入标准,根据出院时临床结果以及文献报告诊断建议,将患者分为RFS组(24例)和非RFS组(43),两组的人口资料见表1。
1.2 RFS的诊断标准
根据基于最近RFS共识标准的定义以及参阅文献[6,7]。根据实验室参数(低磷血症、低钾血症、低镁血症)或临床参数(外周水肿)的新发生或恶化情况对纳入的患者最终诊断RFS。①下列满足≥1项主要标准:磷酸盐<0.32 mmol/L、镁<0.5 mmol/L、钾<2.5 mmol/L;②下列满足≥2项标准:磷酸盐<0.81 mmol/L、镁<0.74 mmol/L、钾<3.6 mmol/L、外周水肿;③在①或②基础上,患者出现如外周水肿、心动过速、呼吸急促、感染、肾功能障碍、神志改变等临床症状。
1.3 入院后营养治疗
患者入院后尽快开始营养支持。根据遵循国际指南的共识协议[6],患者接受了个性化的营养支持,注册营养师在入院时为每位患者定义个性化的营养目标,每日蛋白质摄入量设定为1.2~1.5 g/kg以适应急性疾病期间增加的蛋白质分解,伴有急性肾功能障碍者为0.8 g/kg。对于未能达到75%的每日热量和蛋白质目标由增加对肠内管饲或肠外营养支持。在整个住院期间,根据每位患者的每日食物记录,每24~48小时重新评估营养摄入。出院时给予患者饮食咨询,或在门诊接受口服营养补充剂的指导。
1.4 研究方法
①记录患者入院期间的疾病变化、临床诊治过程和实验室数据和住院时间,比较RFS组和非RFS组间的差异;②记录并发症发生情况以及RFS组和非RFS组间的比较,如医院感染、呼吸衰竭、心血管事件或肺栓塞、急性肾功能衰竭、胃肠道事件;③出院后30天对所有患者进行了随访,了解患者出院后再入院、短期(即30天内)死亡率。
使用STATA 12.1(STATA Corp,College Station,TX,USA)进行统计分析,使用描述性统计数据采用均数±标准差(±s)来描述研究人群,分类变量表示用百分比(数字),连续变量表示为中位数(四分位距(IQR)),两组间比较使用t检验或检验,P<0.05表示两组间差异有统计学意义。
2 结果
2.1 两组患者一般情况
纳入研究的67例患者中,确诊RFS为24例,未确诊或非RFS的患者43例,均为年龄较大的患者。表1显示了两组患者的基线特征,两组患者在年龄、BMI及分层、体重减少、营养不良构成、入院前1周的食物摄入和疾病构成方面没有统计学意义的差异。在疾病构成方面,约1/3(32.6%和33.3%)大多为癌症放化疗相关的营养不良及体重降低;约1/4患者(23.3%和25.0%)为感染性疾病,包括手术出院后由于内源性感染入院、外科疾病相关感染;神经系统疾病均为脑血管意外后的长期卧床患者;肺部疾病主要为COPD或长期肺功能障碍;2例肾病均为肾衰长期透析患者。

表1 患者基线资料
2.2 两组的营养支持
两组的营养支持方式相似,各有1例患者接受完全肠外营养;约50%患者采用正常进食+口服营养剂,约40%肠外营养+口服营养剂,见表2。

表2 两组患者入院后营养支持
2.3 两组临床和实验室结果变化比较
表3 显示了两组电解质紊乱、血清蛋白水平和相关主要临床表现。RFS组患者的磷酸盐水平、血清镁、血K+、白蛋白显著低于非RFS组患者(P<0.05)。此外,RFS组患者伴发外周水肿例数明显高于非RFS组患者(P<0.05);患者发生心动过速、呼吸急促例数的差别没有统计学意义(P>0.05)。在治疗过程中,RFS组患者总Na补充的量明显高于非RFS组患者(P<0.05),但补充磷酸盐、镁及钙的量,两组间差异没有统计学意义(P>0.05)。
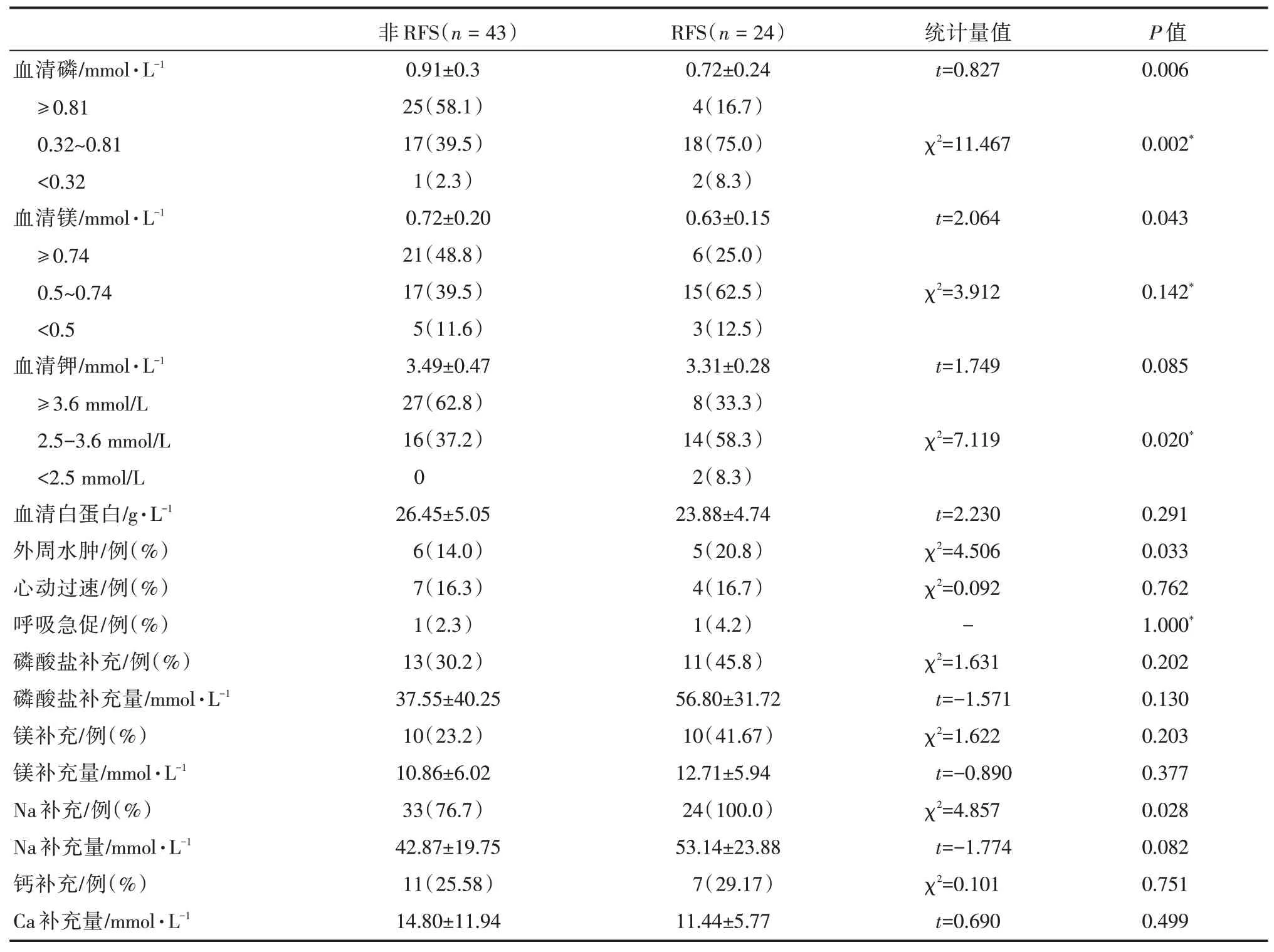
表3 两组患者入院时及治疗期间的实验室和临床改变
2.4 两组患者出院后随访
RFS组所有24例患者均获得1月随访,非RFS组有41例获得随访。RFS组没有死亡病例,非RFS组组有1例因晚期肺癌死亡;RFS组平均住院时间较非RFS组长,差异具有统计学意义(P<0.05);RFS组有4例再入院,非RFS组有1例再入院,两组间差异没有统计学意义(P>0.05)(表4)。

表4 随访结果
3 讨论
早期营养支持已成为临床治疗与护理路径的一部分,目的是促进患者康复和降低与疾病相关营养不良的并发症。RFS的风险因素包括入院时低体质指数、错误的减肥、饥饿、酗酒和某些电解质水平低。本组的数据表明RFS组患者中食欲不振、饮食摄入减少、使用营养补充剂和有癌症病史要高于非RFS组患者,此外,RFS患者入院时具有更低水平的磷酸盐、钾、镁和白蛋白,这与之前文献报告比较一致[8]。这些因素可能有助于及早期识别住院期间发生RFS的患者。尽管如此,预防措施是否能有效降低RFS的相关风险仍不清楚。据文献报告,大多数RFS患者发生在营养治疗开始后的前72小时内[9]。因此,在这个时期密切监测RFS的危险因素和临床特征有利于进一步采取预防和治疗措施。
RFS的病理生理学机制仍不完全清楚,目前研究认为代谢紊乱导致了RFS发生[1,2,10,11]。由于电解质的变化可能先于临床症状,在对高危患者进行电解质监测中,若发现严重的实验室检查异常改变,可将患者归类为即将发生的RFS,如果存在临床症状,则将患者归类为RFS[6]。我们的数据支持这些考虑,表明基线实验室参数与后来发生的RFS之间存在很强的关联。尽管如此,对患者进行电解质和维生素的系统治疗是否能降低RFS及其相关风险仍不确定。
由于RFS尚无明确的诊断标准,本组病例中纳入的患者均伴有营养不良(NRS 2002≥3分),入院后由于各种原因需要接受肠内营养>3天的患者。该类患者中有35.8%最终确诊RFS。患者的组成主要包括肿瘤(各种放化疗)约占1/3,外科感染(手术后再次入院)接近1/4,因此判断因某种疾病入院时,符合同时伴有营养不良的患者可能更易于发生RFS的观点。另外本组病例大多超过60岁,作者认为年龄可能也是一个危险因素。
总之,由于收集的病例数有限,缺乏一致的诊断标准以及提供的临床数据有限,仅通过这几十例的临床诊治过程分析,远不能够描述RFS的全面的病理生理过程。但本组病理结果也反映了因某种疾病入院时,患者若同时伴有营养不良,患RFS的风险可能明显增加,其结果导致住院时间、住院成本增高,甚至发生不良结果。未来的研究应该更多分析研究RFS患者在疾病发生发展的机制,采取预防措施以改善该患者群体的临床结果。
