硫酸右旋糖苷对宫颈癌细胞迁移、侵袭的影响及其分子机制
2021-10-09朱婷张裕民鹿恩邦殷苏威刘欣悦张萍
朱婷,张裕民,鹿恩邦,殷苏威,刘欣悦,张萍
1青岛大学附属青岛市市立医院妇科,山东青岛266011;2菏泽市食品药品检验检测研究院生物检测科;3青岛大学附属青岛市市立医院肾内科
宫颈癌是女性最常见的癌症之一。目前宫颈癌的治疗方法包括手术、放化疗以及联合治疗等,早期宫颈癌可通过根治性或保留生育能力的手术治疗,5年生存率达80%以上,但仍有40%~50%的晚期患者体内存在肿瘤的局灶复发或转移[1],疗效较差。因此,开发新型高效、低毒的治疗药物用于复发难治性及晚期宫颈癌对改善患者预后具有重要意义。硫酸右旋糖苷(DS)是一种大分子右旋糖苷衍生物,具有来源广、成本低、吸收缓慢、排泄快、安全性高、不良反应小等优点[2-3]。DS对胃癌细胞[4]、黑色素瘤细胞[5]、卵巢癌细胞[6]等多种恶性肿瘤具有明显抑制作用,是一种具有潜力的抗癌药物。上皮间质转化(EMT)即上皮细胞失去极性及细胞间黏附力,细胞骨架重塑,转变为具有间质的外观和间质特征,细胞由稳定状态变为活跃状态,侵袭性和转移性增加。EMT的标志是上皮黏附分子E-钙黏蛋白(E-cadherin)的丢失和间质标记物如波形蛋白(Vimentin)的获得[7]。研究显示,PI3K/AKT信号通路可以介导EMT过程,促进宫颈癌细胞的侵袭和转移。目前关于DS对宫颈癌作用的研究报道少见。2020年10月—2021年4月,我们观察了DS对宫颈癌Hela细胞迁移和侵袭能力的影响,并探讨其作用机制与PI3K/AKT信号通路及EMT的关系。
1 材料与方法
1.1 细胞、试剂与仪器人宫颈癌Hela细胞株由青岛大学附属医院青岛市市立医院细胞移植实验室惠赠。DS购自北京索莱宝科技技术有限公司,用DMEM培养基稀释至所需浓度,现配现用。PI3K激动剂740Y-P(美国MedChemExpressLLC公司);胎牛血清(FBS)、DMEM高糖培养液(美国HyClone公司);DMSO、ECL化学发光试剂(大连美仑生物技术有限公司);单、多道微量移液器(德国Eppendorf公司);0.25%胰酶-EDTA、蛋白酶抑制剂、RIPA裂解液、PVDF膜(上海碧云天生物技术有限公司);BCA蛋白定量试剂盒(上海爱必信生物科技有限公司);SDS-凝胶配制试剂盒(上海雅酶生物科技有限公司);抗AKT一抗、抗β-actin一抗、荧光标记二抗(美国Abcam公司);抗p-AKT一抗(美国CST公司);抗E-cadherin一抗、抗Vimentin一抗(北京Bioss公司);Matrigel胶(美国Corning公司);CCK-8试剂盒(日本同仁化学研究所);倒置显微镜(日本Nikon公司);酶标仪(美国BioTek公司);低温高速离心机、低速离心机(长沙湘仪离心机仪器有限公司)。
1.2 细胞培养取Hela细胞,加入含10%胎牛血清和1%青霉素—链霉素的DMEM中,置于37℃、5%CO2培养箱中孵育。根据细胞生长状况,每1~2天换液1次,取对数生长期细胞进行后续实验。
1.3 DS最佳作用浓度及作用时间的筛选采用CCK-8实验。取对数生长期细胞,加入0.25%胰酶-EDTA消化,制成单细胞悬液,按5×103/孔接种于96孔板中。分别加入含0、0.1%、0.3%、0.6%、1.0%DS的DMEM完全培养液,分别培养0、12、24、48 h后,于每孔中加入10µL CCK-8溶液,继续孵育1 h。用酶联免疫标记分析仪于波长450 nm处测各孔吸光度值(OD值),代表细胞增殖情况。检测结果见表1。与对照组相比,加入0.1%、0.3%、0.6%、1.0%DS后Hela细胞增殖活力下降,且随作用时间延长,细胞增殖活力随之下降(P均<0.05)。选择能够使细胞增殖活力降至约50%(即细胞增殖抑制率约50%)的DS浓度和作用时间作为最佳作用浓度和最佳作用时间用于后续实验,即0.3%DS作用48 h。
表1 不同时间点各组细胞增殖能力比较(±s)
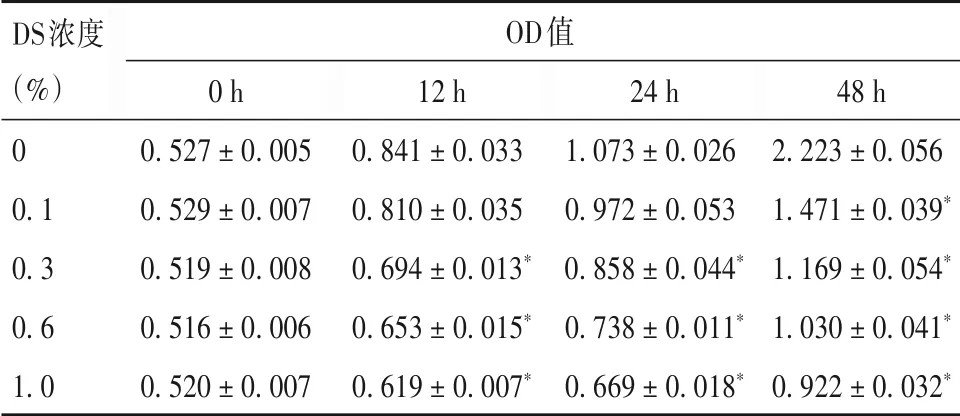
表1 不同时间点各组细胞增殖能力比较(±s)
注:与对照组比较,*P<0.05。
DS浓度(%)0 0.1 0.3 0.6 1.0 OD值0 h 0.527±0.005 0.529±0.007 0.519±0.008 0.516±0.006 0.520±0.007 12 h 0.841±0.033 0.810±0.035 0.694±0.013*0.653±0.015*0.619±0.007*24 h 1.073±0.026 0.972±0.053 0.858±0.044*0.738±0.011*0.669±0.018*48 h 2.223±0.056 1.471±0.039*1.169±0.054*1.030±0.041*0.922±0.032*
1.4 细胞分组与干预处理取对数生长期细胞,分为对照组、DS组、DS+740Y-P组,对照组不加DS及740Y-P,DS组 加 入0.3% DS,DS+740Y-P组 加 入0.3%DS和20µmol/L 740Y-P,培养48 h。
1.5 细胞迁移能力观察采用细胞划痕实验。取三组细胞,制成单细胞悬液,按5×105/孔接种于6孔板中。当细胞覆盖孔底90%左右时,用10 µL移液枪头沿底部垂直划线,观察0、48 h时的划痕愈合情况并拍照,采用ImageJ_v1.8.0软件进行图片分析,计算划痕愈合率。划痕愈合率=(划痕后的即刻面积-划痕后48 h的愈合面积)×100%/划痕后的即刻面积。
1.5细胞侵袭能力观察采用Transwell实验。用无血清培养基按1∶8的比例稀释Matrigel,取100µL稀释后的Matrigel,添加至每个小室的膜上,置于24孔板中,37℃孵育6 h使Matrigel聚合成凝胶。用无血清培养基制备单细胞悬液,调整细胞密度为1×105/mL。收集三组细胞,制成单细胞悬液,分别在Transwell小室的上室接种100µL细胞悬液,下室均加入600µL含20% FBS的完全培养基。置于24孔板中,37℃、5%CO2孵育箱内培养48 h。加入4%多聚甲醛溶液固定20 min,结晶紫染色10 min。用湿棉签小心擦去未穿过的细胞,光学显微镜下观察小室滤膜底附着的细胞数。每组随机选取5~10个视野,计数每个视野穿过膜的细胞数,取平均值。
1.6 细胞AKT、p-AKT、E-cadherin及Vimentin蛋白表达检测采用Western blotting法。收集三组细胞,加入RIPA裂解液提取总蛋白,BCA法测定蛋白浓度。聚丙烯酰胺凝胶电泳后,转移至PVDF膜上,室温5%牛奶封闭膜2 h。加入一抗(稀释浓度分别为AKT 1∶1 000、p-AKT 1∶1 000、β-actin 1∶5 000、E-cadherin 1∶250、Vimentin 1∶1 000),4℃孵育过夜;TBST洗膜3次,加入二抗,室温孵育1 h;TBST洗膜3次,ECL法显色。以目的蛋白条带灰度值与内参β-actin蛋白条带灰度值的比值表示目的蛋白的相对表达量,以p-AKT/AKT表示PI3K/AKT通路活性。
1.7 统计学方法采用Graphpad8.3统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析及Dunnett'st检验,组间两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组细胞迁移能力比较对照组、DS组、DS+740Y-P组的细胞迁移率分别为43.48%±0.20%、23.19%±0.51%、40.61%±0.27%。与对照组相比,DS组细胞迁移率降低;与DS组比较,DS+740Y-P组细胞迁移率升高(P均<0.05)。
2.2 三组细胞侵袭能力比较对照组、DS组、DS+740Y-P组的穿膜细胞数分别为(408.3±26.6)、(80.3±9.6)、(316.3±7.5)个。与对照组比较,DS组穿膜细胞数减少;与DS组比较,DS+740Y-P组穿膜细胞数增多(P均<0.05)。
2.3 三组细胞p-AKT/AKT、E-cadherin及Vimentin蛋白表达比较见表2。与对照组比较,DS组细胞p-AKT/AKT、Vimentin蛋白表达水平降低,E-cad⁃herin蛋白表达水平升高(P均<0.05);与DS组比较,DS+740Y-P组p-AKT/AKT、Vimentin蛋白表达水平升高,E-cadherin蛋白表达水平降低(P均<0.05)。
表2 三组细胞p-AKT/AKT、E-cadherin、Vimentin蛋白表达比较(±s)

表2 三组细胞p-AKT/AKT、E-cadherin、Vimentin蛋白表达比较(±s)
注:与对照组比较,*P<0.05,与DS组比较,#P<0.05。
组别对照组DS组DS+740Y-P组p-AKT/AKT 0.883±0.068 0.583±0.023*0.923±0.021#E-cadherin 0.621±0.013 0.812±0.025*0.659±0.019#Vimentin 0.728±0.015 0.564±0.015*0.685±0.016#
3 讨论
晚期宫颈癌患者因肿瘤局部复发或远处转移而不能通过手术、放疗进行治疗,且药物治疗选择有限,其5年总生存率仅为5%~16%[8]。因有放、化疗或手术史,再次治疗较为困难,如何提高患者的治疗效果、延长生存期、提高宫颈癌患者生活质量成为目前临床面临的巨大挑战。DS是一种大分子聚阴离子多糖,相对分子质量为500 kD。研究表明,DS作为一种大分子右旋糖苷衍生物,对恶性肿瘤的发展存在明显的抑制作用,因其优点多,较传统化疗药物相比,毒副作用轻微,被认为是一种具有潜力的抗癌药物。郭嘉欣等[9]报道,DS可减少M2型巨噬细胞的浸润数量,下调胃癌组织中血管内皮生长因子及血管内皮生长因子受体2的表达,从而抑制肿瘤血管生成,进而抑制胃癌进展。高文卫等[4]研究表明,DS能够抑制胃癌AGS、BGC-823、SGC-7901和GES-1细胞的增殖、迁移及侵袭能力。TAKAGI等[5]报道,DS处理B-16黑色素瘤细胞可以增加G1/G0期细胞比例,减少S和G2/M期细胞比例,表明DS通过阻止黑色素瘤细胞从G1到S期的转变来抑制细胞周期进程,从而抑制肿瘤进展。但目前关于DS对宫颈癌作用的研究尚未见报道。本研究结果显示,DS对宫颈癌Hela细胞的增殖具有抑制作用,且随时间延长和浓度增加,其抑制作用逐渐增强。
迁移、侵袭能力的获得是恶性肿瘤细胞的基本特征,也是肿瘤复发和转移的决定性因素。肿瘤的侵袭及转移是导致患者预后不良的重要因素,是患者死亡的常见原因。本研究结果显示,与对照组相比,DS组细胞迁移率降低,穿膜细胞数减少,表明DS能够显著抑制宫颈癌Hela细胞的迁移和侵袭能力。
PI3K/AKT通路调节在肿瘤的发生、侵袭和转移过程中具有重要作用。研究显示,在子宫内膜癌、乳腺癌、卵巢癌和恶性神经胶质瘤等多种肿瘤细胞中存在PI3K/AKT信号通路的失调[10-12]。活化的PI3K/AKT通过调节各种细胞功能所需的下游成分起作用,包括细胞周期、细胞凋亡、蛋白质合成、DNA损伤修复和血管生成[13]。在宫颈癌中存在AKT激酶的增强活化状态,并且这种增强活化状态与PI3KCA基因扩增相关[14-15]。本研究结果显示,DS组细胞p-AKT/AKT蛋白相对表达量较对照组显著降低,表明PI3K/AKT通路在DS抑制宫颈癌恶性行为中起关键作用。
EMT是恶性肿瘤侵袭和转移的重要因素,EMT标记蛋白E-cadherin、Vimentin等被认为是与肿瘤侵袭和转移相关的标志蛋白[16]。E-cadherin蛋白在维持细胞的形态和极性中起到了重要的作用,它的表达降低意味着肿瘤细胞的黏附力降低,侵袭和迁移潜能增大,易向远处转移。Vimentin蛋白负责维持细胞的完整性,其表达的增加可以促进细胞转化为更扁平、细长的间质细胞形状,增加肿瘤细胞的转移和侵袭潜力[17]。本研究结果显示,与对照组相比,DS组细胞中Vimentin蛋白表达降低,E-cadherin蛋白表达升高,表明DS通过上调上皮细胞标志蛋白和下调间质细胞标志蛋白,抑制了EMT的进展,从而抑制肿瘤的转移与复发。
研究显示,PI3K/AKT信号通路可以介导EMT过程,促进宫颈癌细胞的侵袭、转移。为进一步验证DS是否通过抑制PI3K/AKT信号通路进而抑制Hela细胞的恶性行为,我们采用PI3K激动剂740Y-P与DS联用处理Hela细胞,检测Hela细胞p-AKT/AKT蛋白的相对表达及对Hela细胞迁移、侵袭能力的影响。结果显示,与DS组相比,DS+740Y-P组p-AKT/AKT、Vimentin蛋白表达升高,细胞迁移率升高,穿膜细胞数增加,E-cadherin蛋白表达降低。这表明DS可通过调控PI3K/AKT信号通路抑制EMT的进展,从而抑制宫颈癌Hela细胞的迁移、侵袭等恶性生物学行为。
综上所述,DS具有抑制宫颈癌Hela细胞的迁移、侵袭的作用,其机制可能是通过抑制PI3K/AKT信号通路来抑制EMT进程,从而发挥抗肿瘤作用。通过本研究可以初步为晚期难治性宫颈癌的治疗提供新的思路和药物选择。
