EPO干预后人脐带间充质干细胞对人肾小管上皮细胞纤维化及归巢能力的影响
2021-10-09蒋红樱张春秀李晶贺婷李萌雷蕾白彝华
蒋红樱,张春秀,李晶,贺婷,李萌,雷蕾,白彝华
昆明医科大学第二附属医院肾内科,昆明650101
肾小管间质纤维化(RIF)是慢性肾脏病进展的最终病理表现,其主要特征是肾小管上皮细胞在致纤维化因子特别是转化生长因子β1(TGF-β1)的诱导下发生转化,失去其上皮细胞表型,转变为肌成纤维细胞表型如α平滑肌肌动蛋白(α-SMA)等,导致细胞外基质如纤维连接蛋白(FN)和Ⅳ型胶原(ColⅣ)表达增加,肾组织逐渐纤维化[1]。研究表明,干细胞治疗有助于修复受损的肾脏[2]。临床研究显示,对腹膜透析患者给予人脐带间充质干细胞(HUMSCs)治疗后,血红蛋白、血清白蛋白及血清促红细胞生成素(EPO)水平显著提高,血清肌酐和尿素氮虽然无明显改善,但血清胱抑素C明显下降,部分透析龄超过2年的无尿患者尿量增加[3-4]。动物实验表明,RIF大鼠给予间充质干细胞(MSC)治疗后,血清肌酐和尿素氮有所改善,但并不理想,推测可能与MSC进入体内后趋向多个受损组织,导致归巢到肾脏的MSC数量减少有关[5]。EPO主要由肾脏皮质及外髓部肾小管周围的毛细血管内皮细胞生成,具有改善肾小球毛细血管内皮功能的作用。EPO有向肾脏迁徙的特性,是较为理想的MSC动员剂[6]。使用EPO对MSC进行干预后,MSC的增殖分化能力有所增加[6]。我们的前期研究显示,对RIF大鼠使用EPO干预的MSC进行移植治疗后,大鼠肾功能明显改善,氧化应激指标血清丙二醛(MDA)下降,血清超氧化物歧化酶(SOD)增高,降低了氧化应激水平,抑制了肾脏纤维化[7]。目前的研究报道大多数是使用动物来源的干细胞[7-8],使用HUMSCs干预人肾小管上皮细胞的研究较少。2019年1月—2020年6月,我们采用TGF-β1诱导人肾小管上皮细胞HK-2纤维化,观察EPO干预后的HUMSCs对HK-2细胞纤维化及归巢能力的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 细胞、试剂与仪器HUMSCs(江阴齐式生物),HK-2细胞(美国ATCC细胞库)。人重组EPO(沈阳三生),Transwell小室(美国Corning),基质细胞衍生因子1(SDF-1)及其受体CXCR4抗体(美国Abcam),干细胞因子(SCF)抗体(美国Sigma)及SCF受体c-Kit抗体(美国Santa Cruz),DMEM/F12、高糖DMEM培养基(Gibco)和胎牛血清FBS(美国Hy⁃Clone)。CO2细胞培养箱(美国NAPCO 5410),荧光定量PCR仪(美国ABI Prism 7300),倒置荧光显微镜(日本Nikon),酶标仪(美国Bio-Tek),电泳仪(美国Bio-rad)。
1.2 HUMSCs和HK-2细胞的培养将HUMSCs加入含胎牛血清的DMEM/F12培养液、5% CO2、37%饱和湿度的培养箱中培养。培养24 h后,显微镜下观察,细胞基本全部贴壁。在无菌工作台内,用移液器弃去培养容器内的培养液,更换为新鲜、37℃预热的完全细胞培养液。培养48~72 h后,进行消化和传代培养,按1∶2传代,取第3代细胞用于后续实验。取冻存的HK-2细胞,加入含牛血清的DMEM/F12培养基,置于37℃、5%CO2培养箱中培养,待细胞生长后更换为无血清培养基继续培养24 h,显微镜下观察细胞融合至80%时进行传代接种。
1.3 EPO干预HUMSCs的最佳浓度筛选①Tran⁃swell检测细胞迁移能力:取第3代HUMSCs,按4×104/孔接种到6孔的Transwell小室底面,小室置于含10%胎牛血清的DMEM培养液内,分别加入0、1、10、100、500 IU/mL EPO培养72 h。培养结束后,用棉球擦去小室表面未移行的细胞,使用结晶紫溶液染色,倒置显微镜下观察,随机取6个视野拍照、计数。②MTT法检测细胞增殖能力:取HUMSCs接种于6孔板,分别加入0、1、10、100、500 IU/mL EPO培养72 h。加入20 µL MTT溶液,培养箱中孵育4 h。测定各孔光密度(OD)值。结果显示,与加入0 IU/mL EPO的HUMSCs比 较,加 入10、100、500 IU/mL EPO的HUMSCs细胞迁移数量和细胞增殖活力均增加(P均<0.01),且100、500 IU/mL高于1、10 IU/mL,100 IU/mL与500 IU/mL间比较差异无统计学意义(P均>0.05),见表1。故将100 IU/mL EPO作为最佳浓度用于后续实验。
表1 不同浓度EPO对HUMSCs迁移和增殖能力的影响(±s)

表1 不同浓度EPO对HUMSCs迁移和增殖能力的影响(±s)
注:与0 IU/mL组比较,*P<0.01;与10 IU/mL组比较,△P<0.01。
EPO浓度(IU/mL)0 1 10 100 500细胞迁移数量(个)18.47±2.04 18.78±1.82 28.65±1.74*37.07±2.06*△46.31±2.83*△细胞增殖OD值1.17±0.02 1.24±0.02 1.39±0.06*1.65±0.07*△1.73±0.03*△
1.4 TGF-β1诱导HK-2细胞纤维化的最佳浓度筛选取培养后的HK-2细胞,分别加入0、2、5、10、15、20 µg/L TGF-β1,置于37℃、5% CO2培养箱中培养48 h。收集细胞,采用RT-PCR法检测TGF-β1、FN、ColⅣ、α-SMA mRNA表 达,Western blotting法检测TGF-β1、FN、ColⅣ、α-SMA蛋白表达。结果显示,与加入0 µg/L TGF-β1的细胞相比,加入10、15、20 µg/L TGF-β1的细胞TGF-β1、FN、ColⅣ、α-SMA mRNA和蛋白 表达量均增加(P均<0.01),且三者之间比较差异无统计学意义(P均>0.05)。见表2。考虑到细胞毒性,故将10 µg/L作为TGF-β1的最佳诱导浓度用于后续实验。
表2 不同浓度TGF-β1对HK-2细胞TGF-β1、FN、ColⅣ、α-SMA mRNA及蛋白表达的影响(±s)

表2 不同浓度TGF-β1对HK-2细胞TGF-β1、FN、ColⅣ、α-SMA mRNA及蛋白表达的影响(±s)
注:与0µg/L组比较,*P<0.05,**P<0.01。
TGF-β1浓度(µg/L)0 2 5 10 15 20 TGF-β1 mRNA 1.03±0.04 1.94±0.25 2.61±0.22 8.25±0.28**10.13±1.02**20.44±1.31**蛋白0.65±0.01 1.32±0.03**1.56±0.04**1.55±0.03**1.71±0.05**1.62±0.04**FN mRNA 1.04±0.03 2.02±0.25 1.93±0.10 5.43±0.13*8.68±1.22**15.34±1.55**蛋白1.03±0.03 1.19±0.03 1.57±0.05**1.62±0.05**1.58±0.04**1.52±0.04**ColⅣmRNA 1.05±0.01 1.66±0.07 3.14±0.20 6.74±0.10**7.50±1.08**15.19±0.74**蛋白0.56±0.01 1.17±0.05**1.45±0.05**1.69±0.07**1.60±0.07**1.57±0.06**α-SMA mRNA 1.06±0.02 1.19±0.13 1.80±0.04 4.19±0.17*8.09±0.74**14.69±0.91**蛋白0.45±0.01 1.13±0.05**1.55±0.05**1.44±0.05**1.55±0.05**1.61±0.04**
1.5 HK-2细胞分组与干预采用Transwell体系进行细胞共培养。Transwell小室中嵌入6孔培养板,将HUMSCs置于上层,加入DMEM/F12培养基;HK-2细胞置于下室,加入DMEM高糖培养基。将细胞分为4组:①对照组:上室内为单纯培养基,下室内为HK-2细胞和培养基;②TGF-β1组:上室内为单纯培养基,下室内为HK-2细胞加入含10µg/L TGF-β1的培养基;③HUMSCs干预组:上室内为HUMSCs和培养基,下室内为HK-2细胞加入含10µg/L TGF-β1的培养基;④EPO+HUMSCs干预组:上室内为HUMSCs加入含100 IU/mL EPO的培养基,下室内为HK-2细胞加入含10 µg/L TGF-β1的培养基。各组均培养72 h。
1.6 HK-2细胞形态变化与迁移能力观察取出Transwell小室,PBS冲洗,加入4%甲醛室温固定30 min。加入0.1%结晶紫染色20 min,清水冲洗3遍以上,将小室底部的膜轻轻取下,将膜的底面朝上,在显微镜下观察细胞的形态和生长情况,比较细胞形态是否发生改变,HK-2是否失去了原有表型分化形成上皮样细胞和(或)肌成纤维细胞,记数并拍照。
1.7 HK-2细胞纤维化因子及归巢因子mRNA表达检测采用RT-PCR法。收集各组共培养后的细胞,加入TRIzol试剂提取细胞总RNA。检测RNA浓度,取总RNA 1.5 µg进 行逆转录,合成cDNA。cDNA 2 µL作用于2×EasyTaq PCR SuperMix扩增目标基因(以人β-actin为内参照)。通过GenBank基因数据库搜索大鼠TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF基因CDS序列,使用Primer5软件设计引物,目的基因及内参引物序列见表3。使用Real Time PCR扩增仪进行扩增,扩增条件:95℃预变性5 min;95℃15 s,60℃60 s,共40个循环。衡量结果的参数主要是观察熔解曲线和扩增曲线,以GAPDH为内参基因,采用2-ΔΔCt法计算纤维化因子TGF-β1、FN、ColⅣ、α-SMA和归巢因子CXCR4、SDF-1、c-Kit、SCF mRNA的相对表达量。ΔΔCt=实验组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因)。

表3 目的基因及内参引物序列
1.8 HK-2细胞纤维化因子和归巢因子蛋白表达检测采用Western blotting法测定TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-kit、SCF蛋白表达。收集各组细胞,加入裂解液裂解细胞,离心15 min,取上清,采用BCA法测定蛋白浓度。取蛋白样品,每个泳道添加30 µg蛋白样品进行蛋白电泳。配制SDS-PAGE分离胶,行10%凝胶电泳,将PVDF膜在100%的甲醇溶液中浸润,然后转移至清水中浸泡,20 V电压转膜,将蛋白固定在PVDF膜上,5%脱脂奶粉封闭。加入稀释后的一抗(1∶1 000),4℃孵育过夜;TBST溶液洗膜,加入稀释后的二抗(1∶5 000),室温孵育1 h。TBST溶液洗膜。加入ECL Plus显色试剂,曝光,使用Quantity One4.6软件对蛋白条带进行半定量,分析其读数,于Bio-Rad膜成像系统下显色成像,扫描后用Ultraviolet Transilluminator系统软件分析。以β-actin为内参,计算目的蛋白的相对表达量。
1.9 统计学方法采用SPSS25.0统计软件。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞形态变化与迁移能力比较显微镜下观察发现,TGF-β1组细胞失去了原有上皮细胞的形态,形成了具有迁移的能力的上皮样细胞和肌成纤维细胞。对照组、TGF-β1组、HUMSCs干预组、EPO+HUMSCs干预组细胞迁移数量分别为(1.66±1.27)、(9.78±0.73)、(8.95±1.23)、(6.75±0.78)个。与对照组比较,TGF-β1组、HUMSCs干预组、EPO+HUMSCs干预组细胞迁移数量均增加;EPO+HUMSCs干预组细胞迁移数量较HUMSCs干预组和TGF-β1组减少(P均<0.01)。
2.2 各组细胞纤维化因子和归巢因子mRNA表达比较与对照组比较,TGF-β1组纤维化因子TGF-β1、FN、ColⅣ、α-SMA mRNA表达水平最高,HUMSCs干预组次之,EPO+HUMSCs干预组最低(P<0.05或<0.01)。与对照组比较,TGF-β1组的归巢因子CXCR4、SDF-1、c-Kit、SCF mRNA表达水平最高,HUMSCs干预组次之,EPO+HUMSCs干预组最低(P<0.05或<0.01)。见表4。
表4 各组细胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF mRNA表达比较(±s)
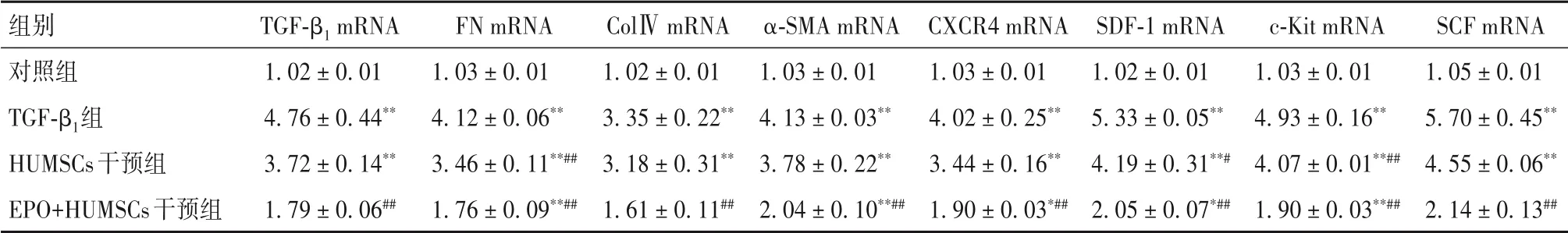
表4 各组细胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF mRNA表达比较(±s)
注:与对照组比较,*P<0.05,**P<0.01;与TGF-β1组比较,#P<0.05,##P<0.01。
组别对照组TGF-β1组HUMSCs干预组EPO+HUMSCs干预组TGF-β1 mRNA 1.02±0.01 4.76±0.44**3.72±0.14**1.79±0.06##FN mRNA 1.03±0.01 4.12±0.06**3.46±0.11**##1.76±0.09**##ColⅣmRNA 1.02±0.01 3.35±0.22**3.18±0.31**1.61±0.11##α-SMA mRNA 1.03±0.01 4.13±0.03**3.78±0.22**2.04±0.10**##CXCR4 mRNA 1.03±0.01 4.02±0.25**3.44±0.16**1.90±0.03*##SDF-1 mRNA 1.02±0.01 5.33±0.05**4.19±0.31**#2.05±0.07*##c-Kit mRNA 1.03±0.01 4.93±0.16**4.07±0.01**##1.90±0.03**##SCF mRNA 1.05±0.01 5.70±0.45**4.55±0.06**2.14±0.13##
2.3 各组细胞纤维化因子和归巢因子蛋白表达比较与对照组比较,TGF-β1组纤维化因子TGF-β1、FN、ColⅣ、α-SMA蛋白表达水平最高,HUMSCs干预组次之,EPO+HUMSCs干预组最低(P<0.05或<0.01)。与对照组比较,TGF-β1组的归巢因子CXCR4、SDF-1、c-Kit、SCF蛋白表达水平最高,HUMSCs干预组次之,EPO+HUMSCs干预组最低(P<0.05或< 0.01)。见表5。
表5 各组细胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF蛋白表达比较(±s)

表5 各组细胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF蛋白表达比较(±s)
注:与对照组比较,*P<0.05,**P<0.01;与TGF-β1组比较,#P<0.05,##P<0.01。
组别对照组TGF-β1组HUMSCs干预组EPO+HUMSCs干预组TGF-β1 0.70±0.01 1.21±0.03**1.15±0.02**0.98±0.01**##FN 0.80±0.01 1.17±0.01**1.06±0.01**##0.98±0.01**##ColⅣ0.70±0.01 0.98±0.02**0.95±0.02**0.71±0.01##α-SMA 0.77±0.02 0.94±0.03 0.92±0.03 0.80±0.03 CXCR4 0.70±0.01 1.26±0.01**1.05±0.02**##0.92±0.01**##SDF-1 0.81±0.01 1.21±0.02**1.08±0.02**#0.99±0.02**##c-Kit 0.48±0.01 1.01±0.02**0.87±0.01**##0.82±0.01**##SCF 0.83±0.01 1.11±0.02**0.95±0.02*#0.83±0.01##
3 讨论
RIF在形态学上是因为上皮细胞失去了原有表型和黏附性而分化成具有迁徙和转移的能力的上皮样细胞,最终形成肌成纤维细胞,HK-2细胞损伤和功能不全是RIF的关键因素和中心环节[9]。α-SMA是一种提示存在纤维化的因子的细胞骨架蛋白,是肌成纤维细胞的特征标志蛋白,FN是细胞外基质的主要成分,其含量可以作为反映组织纤维化程度的主要指标[9-10]。纤维化的肾间质中主要由ColⅣ组成,α-SMA和ColⅣ表达上调说明肾间质纤维化模型成功。本研究发现,体外培养的HK-2在TGF-β1的诱导下,细胞形态由上皮细胞的铺路石状变为具有侵袭的能力的长梭形上皮样细胞,此时纤维化因子α-SMA、FN和ColⅣ的mRNA和蛋白的表达明显上调,符合肌成纤维细胞的特征。
有学者认为,减少TGF-β1的合成或抑制其受体的活性,可改善纤维化[10]。本研究发现,HUMSCs抑制TGF-β1诱导的HK-2纤维化,其TGF-β1、α-SMA、FN、ColⅣ的mRNA和蛋白的表达都有不同程度下调,细胞的侵袭能力减弱,提示外源性HUMSCs有拮抗TGF-β1的作用,能改善RIF的发生和发展;还发现HUMSCs迁移数量增加,证实了干细胞优先向损伤组织迁移的特征。我们的前期研究发现,干细胞修复慢性肾衰竭时有旁分泌途径的参与,但是修复能力不是非常理想[4,11],只有少数肾组织结构修复而大部分肾组织无明显改善,推测其原因可能是归巢到肾脏的干细胞数量较少,不能满足肾脏修复的需要。由于RIF过程中受到激活的促炎症细胞因子如α-SMA、FN、ColⅣ表达增加的影响,干细胞随血循环进入肾脏后发生凋亡,分裂增殖能力减弱,因此单纯的靶向移植细胞修复肾脏的能力是有限的。如果能够使用某种物质促进干细胞在肾脏的增殖,动员干细胞向肾组织迁徙,抑制其凋亡,增加干细胞归巢到肾脏的数量,就有希望较好改善受损的肾组织。
目前有多种方法可以促进干细胞增殖,但是由于体系较为复杂,设备条件要求较高而不利于广泛应用。EPO是一种糖蛋白激素,成人80%的EPO由肾皮质的成纤维细胞生成,20%由肝星状细胞生成,EPO可通过抗氧化应激、抑制转分化、抗凋亡等的作用来延缓RIF[6]。CHEN等[12]报道,EPO可阻止TGFβ1诱导HK-2向肌成纤维样细胞转分化的作用,这种作用可能是通过调节依赖丝裂原活化的蛋白激酶机制,阻断Smad信号通路转导发挥作用。EPO是一种抗凋亡因子,能抑制肾小管上皮细胞凋亡,促进肾小球毛细血管内皮功能的修复、减轻肾脏的病理改变和改善肾功能。EPO诱导MSC增殖修复受损的肾组织,可能是EPO与靶细胞表面的EPO受体结合后激活MSC的JAK2/STAT5信号通路转导进入细胞核,发挥调节MSC增殖的作用,促进血管再生,阻止细胞凋亡[13]。
本研究结果显示,不同浓度EPO均可促进HUMSCs的增殖和迁移,且随着EPO浓度增加,HUMSCs的增殖活力和迁移能力增强。在模拟RIF微环境中,移植EPO处理过的HUMSCs,发现EPO+HUMSCs干预组的纤维化因子FN、ColⅣ、α-SMA表达下降,表明EPO可通过增加干细胞的增殖能力,趋化干细胞向受损的肾组织迁移,抑制肾小管上皮细胞分化成无功能的上皮样细胞,延缓RIF进展。
归巢因子具有诱导其受体的细胞定向趋化的能力。SDF-1是CXC趋化因子家族成员,目前多认为CXCR4是SDF-1惟一的受体。SDF-1/CXCR4轴在调控MSC迁移和归巢中起着必不可少的作用,当SDF-1被分泌后,干细胞迁移至损伤的组织[14],干细胞的趋化和归巢是未来的研究方向。NEUSS等[15]研究发现,EPO-EPOR在低氧条件下可增强SDF的表达,促进循环中CXCR4的增加,诱导内皮祖细胞定向迁移并参与新血管的形成。动物实验显示,急性肾衰竭大鼠肾脏组织中SDF-1表达增强,诱导MSC向靶器官定向迁移[16-17]。SDF-1对MSC表面的CXCR4有极强的化学吸引力,SDF-1与CXCR4的结合有利于MSC的定向迁移和归巢,可促进MSC的增殖及血管新生[5,14]。c-Kit是SCF的特异性受体,二者结合后能够调控细胞的生物学作用。细胞迁徙到特定的组织需要SCF和c-Kit的相互作用。有研究发现,增加血管内皮细胞归巢至损伤组织,是通过SCF增强血管内皮细胞的黏附能力达到的,SCF能诱导CXCR4在造血干细胞上的表达[17]。SDF-1浓度升高后激活MMP-9,促进c-Kit释放,反过来,c-Kit又可以上调SDF-1来增加细胞动员[5,10]。
本研究结果显示,TGF-β1刺激HK-2细胞后,细胞中的归巢因子SDF-1、CXCR4、SCF、c-Kit mRNA和蛋白表达增加,而EPO和HUMSCs干预后归巢因子mRNA和蛋白表达显著下调;同时发现代表HUMSCs的绿色荧光在EPO+HUMSCs组明显增加。可能是TGF-β1上调了SDF-1在HK-2的表达,促进了c-Kit的释放,c-Kit又刺激SDF-1动员细胞。使用EPO和(或)HUMSCs后降低了SDF-1、CXCR4、SCF和c-Kit的表达,由于损伤的HK-2尚未完全恢复,所以EPO+HUMSCs组的归巢因子mRNA和蛋白表达仍高于对照组。LOU等[18]认为,SDF-1/CXCR4通路虽然不能促进MSC的分化,但能够诱导MSC的增殖和迁移。本研究结果与其一致。
综上所述,在体外使用EPO处理HUMSCs作用于纤维化的人HK-2细胞,发现EPO可促进HUMSCs的增殖和迁移,将HUMSCs定向迁移至受损的HK-2细胞,抑制HK-2细胞分化成具有迁徙能力的无功能的上皮样细胞,从而延缓HK-2细胞的纤维化进程。本研究对于指导临床使用EPO干预MSC治疗RIF患者提供了较好的实验依据。
