京尼平苷对UVA诱导HSF细胞凋亡相关蛋白p53、Bax、Bcl-2 mRNA表达的影响
2021-10-09陈巧云杨柳刘斌李文鹏李伟谷建梅黄昕红尤棵王业秋
陈巧云,杨柳,刘斌,李文鹏,李伟,谷建梅,黄昕红,尤棵,王业秋
(黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007)
随着全球经济的飞速发展,臭氧层破坏加剧,辐射到地球表面的紫外线(Ultraviolet Ray,UV)日益增多。皮肤是UV 作用于人体的主要靶器官,长期的UV 照射可使其结构、功能发生改变,导致光老化的发生,出现粗深皱纹、皮肤下垂、色斑等临床表现[1]。到达地表的紫外线中,长波紫外线(UVA,320 nm~400 nm)占总量的95%,且穿透力强,能直接损伤皮肤真皮层的成纤维细胞,导致成纤维细胞功能紊乱,是引起皮肤光老化的主要因素[2-3]。
国内外学者针对UV 损伤皮肤的机制及皮肤光老化的预防和治疗进行了大量研究,取得了一定效果,但远远满足不了临床需求[4-5]。本课题组在杜仲抗皮肤光老化的药效物质基础研究中发现,京尼平苷(geniposide,GP)是杜仲抗皮肤光老化的活性物质之一,能减轻UVA 损害皮肤成纤维细胞[6]。本实验主要研究GP 对皮肤成纤维细胞活性氧簇(Reactive oxygen species,ROS)的清除、细胞凋亡率以及细胞凋亡相关蛋白p53、Bax、Bcl-2 mRNA 表达的影响,探讨GP 抗皮肤光老化的机制,为皮肤光老化的防治及GP的进一步研究提供理论基础。
1 材料
1.1 细胞
人皮肤成纤维细胞HSF(上海艾研生物科技有限公司)。
1.2 药物与试剂
DMEM 培养基、胎牛血清[赛默飞世尔生物化学制品(北京)有限公司];ROS 检测试剂盒、乳酸脱氢酶(LDH)测试盒、Annexin V-FITC 细胞凋亡检测试剂盒(上海碧云天生物技术有限公司);引物、SGExcel UltraSYBR Mixture、AMV 第一链cDNA 合成试剂盒[生工生物工程(上海)有限公司];京尼平苷(上海锐谷生物科技有限公司)。
1.3 仪器
紫外照射仪(Sigma 公司);紫外线辐照计(北京师范大学光电仪器厂);流式细胞仪(HPC-150 型,加拿大Handyem公司);实时荧光定量PCR仪(MX3000P型,美国安捷伦公司)。
2 方法
2.1 药物配制
GP 用DMEM 培 养液 配制 成5 × 10-7、5 × 10-6、5 × 10-5mol/L 三个浓度,调整pH 值为7.0,微孔滤膜(0.22 μm)过滤除菌。
2.2 HSF细胞的体外培养及模型建立
HSF 细胞用含有10%胎牛血清的DMEM 培养液,在5%CO2、37 ℃、饱和湿度的环境下培养。将对数生长期的HSF细胞制备成1×106、5×104个/mL的细胞悬液分别接种于6孔板和96 孔板。参考文献[6]和[7]的方法,用20 J/cm2的UVA照射细胞建立光老化模型。
2.3 实验分组
接种于孔板内的细胞随机分为正常对照组、模型对照组和药物处理组,其中药物处理组又分为5×10-7、5×10-6、5×10-5mol/L 三个浓度。①正常对照组:不含GP的DMEM培养液正常培养;②模型对照组:UVA照射建立光老化模型,不含GP的DMEM培养液培养;③药物处理组:UVA 照射建立光老化模型,分别给予含5×10-7、5×10-6、5×10-5mol/L GP的DMEM培养液进行培养。
2.4 MTT法检测细胞活力
接种到96 孔板的细胞,给药干预24 h,每孔加5 mg/mL 的MTT 20 μL,继续培养4 h,弃上清后加入150 μL 二甲基亚砜,室温震荡10 min,充分溶解结晶,置于酶标仪中,检测492 nm 处的吸光度(OD),计算细胞活力。
2.5 细胞中活性氧水平检测
6 孔板中细胞,给药24 h 后,使用流式细胞仪测定细胞内活性氧水平。
2.6 LDH活性检测
96 孔板中细胞,给药24 h 后,收集上清液,检测LDH活性,严格按照说明书进行操作。
2.7 细胞凋亡率检测
6 孔板中细胞,给药24 h 后,使用流式细胞仪测定细胞凋亡率。
2.8 p53、Bax和Bcl-2 mRNA检测
6孔板中细胞,给药24 h后,提取每孔总RNA;按照第一链cDNA 合成试剂盒步骤要求合成cDNA;以该cDNA 为模板进行实时荧光定量PCR。反应体系:20 μL;反应引物:p53,F 5'-ACCACCATCCACTACAACTACAT-3'、R 5'-CAGGACAGGCACAAACACG-3';Bax,F 5'-CAGGATGCGTCCACCAAGAA-3'、R 5'-GTGTCCACGGCGGCAATCA-3';Bcl-2,F 5'-ATCCAATCCTGTGCTGCAT-3'、R 5'-ACGTCCACGTTCTTCATTGT-3';以β-actin 为内参,采用2-△△Ct法,对p53、Bax和Bcl-2 mRNA进行分析。
2.9 统计学处理
3 结果
3.1 GP对HSF细胞活力的影响
20 J/cm2的UVA 照 射 后,细 胞 活 力 减 弱(P<0.01),GP 各剂量组能提高细胞活力,5 × 10-6、5 ×10-5mol/LGP 组与模型对照组相比,差异具有统计学意义(P<0.01)。见表1。
表1 GP对HSF细胞活力的影响(±s)
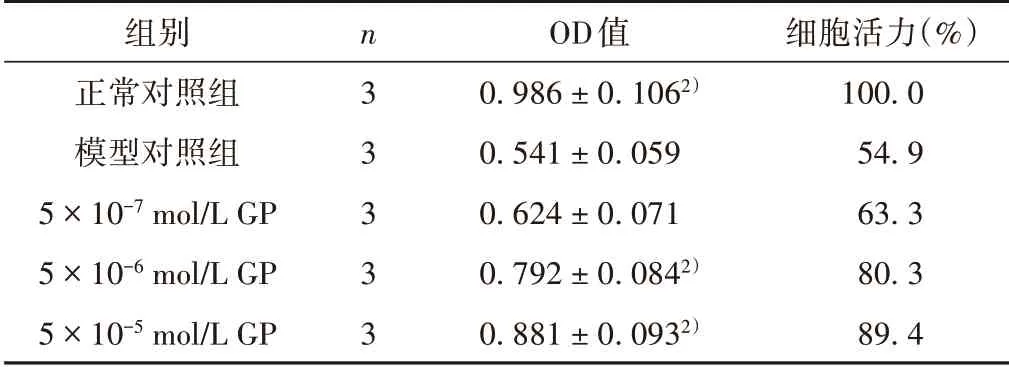
表1 GP对HSF细胞活力的影响(±s)
注:与模型对照组比较,2)P <0.01。
组别正常对照组模型对照组5×10-7 mol/L GP 5×10-6 mol/L GP 5×10-5 mol/L GP n 3 3 3 3 3 OD值0.986±0.1062)0.541±0.059 0.624±0.071 0.792±0.0842)0.881±0.0932)细胞活力(%)100.0 54.9 63.3 80.3 89.4
3.2 GP 对HSF 细胞ROS 相对含量、LDH 活性、细胞凋亡的影响
UVA 照射后,ROS 相对含量增加、LDH 活性和细胞凋亡率升高,与正常对照组相比有统计学意义(P<0.01),GP 干预后,ROS 相对含量、LDH 活性和凋亡率下降(P<0.05,P<0.01)。见表2。
表2 GP对HSF细胞ROS相对含量、LDH活性和细胞凋亡率的影响(±s)
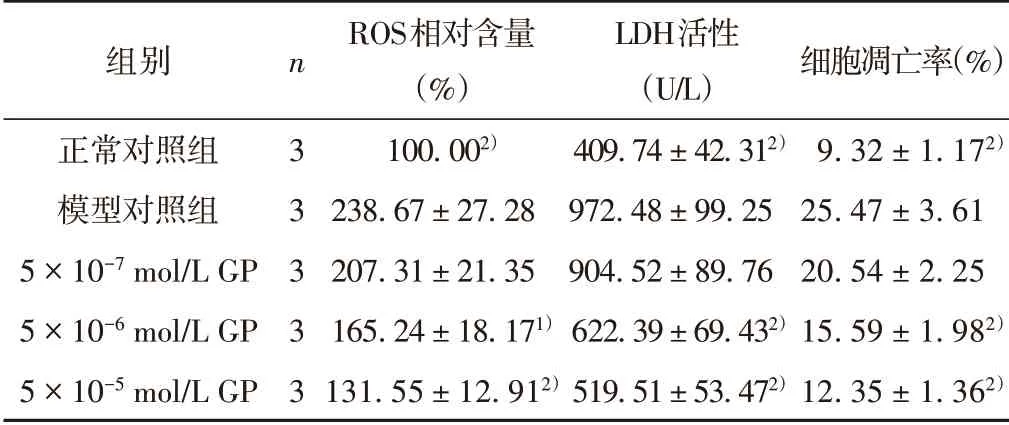
表2 GP对HSF细胞ROS相对含量、LDH活性和细胞凋亡率的影响(±s)
注:与模型对照组比较,1)P <0.05,2)P <0.01。
组别正常对照组模型对照组5×10-7 mol/L GP 5×10-6 mol/L GP 5×10-5 mol/L GP n 3 3 3 3 3 ROS相对含量(%)100.002)238.67±27.28 207.31±21.35 165.24±18.171)131.55±12.912)LDH活性(U/L)409.74±42.312)972.48±99.25 904.52±89.76 622.39±69.432)519.51±53.472)细胞凋亡率(%)9.32±1.172)25.47±3.61 20.54±2.25 15.59±1.982)12.35±1.362)
3.3 GP对p53、Bax和Bcl-2 mRNA表达的影响
20 J/cm2UVA 照射后,HSF 细胞p53、Bax mRNA 的表达量显著上升,与正常对照组相比,差异有统计学意义(P<0.01);Bcl-2 mRNA 表达量基本没变化,与正常对照组相比,差异无统计学意义(P>0.05);GP 各剂量组可降低p53、Bax mRNA 的表达,提高Bcl-2 mRNA的表达,5×10-6、5×10-5mol/L GP 组与模型对照组相比,差异具有统计学意义(P<0.05,P<0.01)。见图1和表3。
表3 GP对HSF细胞p53、Bax和Bcl-2 mRNA表达的影响(±s)
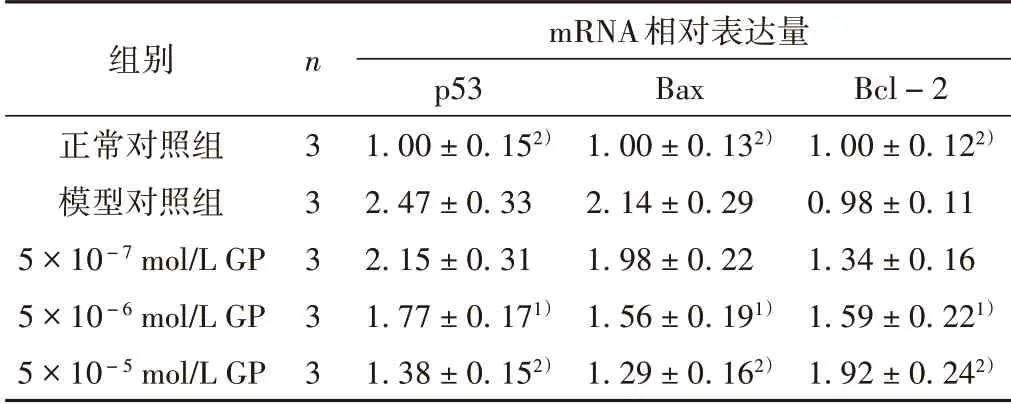
表3 GP对HSF细胞p53、Bax和Bcl-2 mRNA表达的影响(±s)
注:与模型对照组比较,1)P <0.05,2)P <0.01。
组别正常对照组模型对照组5×10-7 mol/L GP 5×10-6 mol/L GP 5×10-5 mol/L GP n 3 3 3 3 3 mRNA相对表达量p53 1.00±0.152)2.47±0.33 2.15±0.31 1.77±0.171)1.38±0.152)Bax 1.00±0.132)2.14±0.29 1.98±0.22 1.56±0.191)1.29±0.162)Bcl-2 1.00±0.122)0.98±0.11 1.34±0.16 1.59±0.221)1.92±0.242)
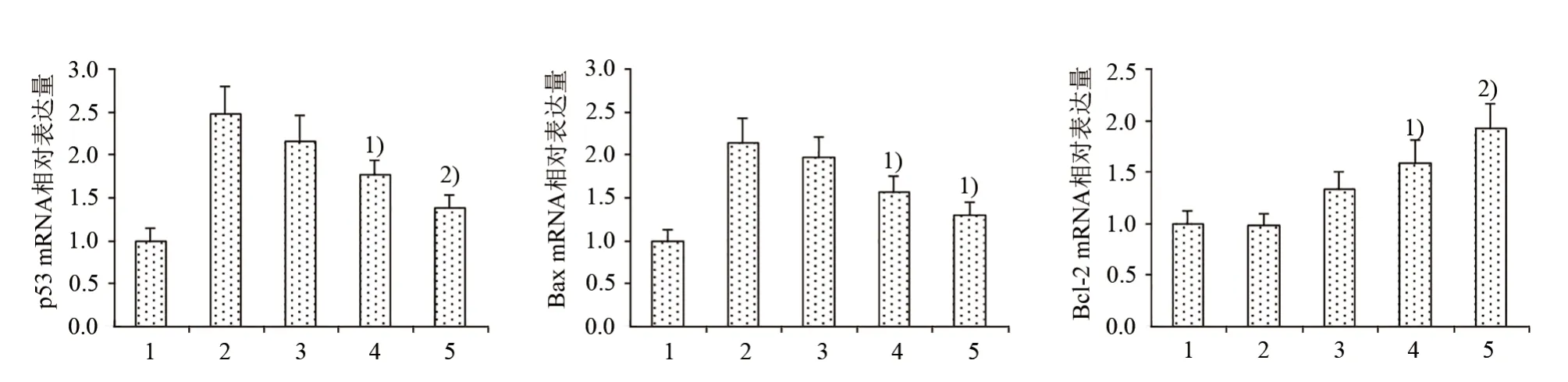
图1 GP对p53、Bax和Bcl-2 mRNA表达的影响
4 讨论
京尼平苷又名栀子苷,是一种环烯醚萜类化合物,主要存在于栀子、杜仲等植物中,具有抗炎、抗氧化、抗凋亡等多种药理作用[8-9]。本课题组前期研究发现尼平苷能提高SOD、GSH-Px 等酶的活性,通过调控MAPK 信号通路,减少炎症细胞因子表达和分泌,抑制基质金属蛋白酶的分泌,提高基质金属蛋白酶抑制因子的分泌来保护UV 损伤的皮肤细胞[6]。为了进一步探究京尼平苷抗皮肤光老化的作用机制,笔者以人皮肤成纤维细胞(HSF)作为研究对象,研究京尼平苷处理UV 照射后的HSF 细胞凋亡相关蛋白mRNA 表达的影响,为皮肤光老化的预防和治疗提供理论依据。
在皮肤光老化的各种机制中,研究比较多的是氧化应激学说,认为皮肤细胞在UV 照射下发生一系列生化反应产生ROS,ROS 既可以直接引起细胞的氧化性损伤,使细胞内的酶类失活;又可以作为第二信使,激活细胞内信号转导级联反应,调控MMPs 基因表达[10-11]。本研究中,20 J/cm2的UVA 照射后,细胞内ROS 相对含量增加,培养液中LDH 活性增强,凋亡率增加,细胞活力下降为正常对照组的54.9%,说明UVA 照射引起HSF 细胞的氧化损伤。GP 干预后,ROS相对含量、LDH 活性和凋亡率降低,细胞活力增加,说明GP 通过提高细胞内氧化系统活力,清除ROS,增加细胞活力,抑制细胞凋亡,拮抗UVA 对皮肤成纤维细胞的损伤。
细胞内过量的ROS会产生大量的凋亡转录因子,引起细胞凋亡[12]。哺乳动物中有一系列凋亡相关基因,比较重要的有胱天蛋白酶(Caspases)家族、Bcl-2 家族、ice 基因、p53基因等。Bcl-2家族是一类癌基因家族,其成员如Bcl-2等抑制细胞凋亡,也被称为存活基因;有的促进细胞凋亡,如Bad、Bax等。Bax与Bcl-2这一对相互拮抗的基因共同对细胞凋亡产生影响[13]。Bax蛋白可破坏线粒体膜的完整性,降低膜电位,增加细胞色素C释放,激活Caspase蛋白家族,诱导细胞凋亡,Bcl-2可维护线粒体膜的完整性,抑制细胞凋亡。以抑癌基因p53为核心的信号通路是UV照射诱发细胞凋亡的关键调控环节[14]。UV照射激活p53基因,表达的p53蛋白与线粒体膜上的Bcl 蛋白家族相互作用,导致细胞凋亡[15-16]。在本研究中,与空白对照组相比,UVA照射后,p53、Bax mRNA 表达量上升(P <0.01),Bcl-2 mRNA表达量无明显下降(P>0.05)。GP 处理后,p53、Bax mRNA 表达量下降,Bcl-2 mRNA 表达量升高(P<0.05),表明GP 通过下调p53、Bax mRNA 表达,上调Bcl-2 mRNA表达,抑制细胞凋亡。
综上,京尼平苷通过调控光损伤HSF 细胞活力和细 胞 内ROS 含 量、LDH 活 性;调 控p53、Bax 和Bcl-2 mRNA 表达,抑制细胞凋亡相关通路,拮抗细胞的氧化损伤,减少细胞凋亡,防治皮肤光损伤。
