铁皮石斛多糖对癫痫大鼠认知功能及海马神经元凋亡的影响
2021-10-08周宾冯涛刘晓任仙
周宾 冯涛 刘晓 任仙
癫痫由脑部神经元同步化异常放电、神经兴奋性异常增高所致,具有短暂性、发作性以及重复性等特点,持续反复发作可损伤脑组织,引起认知功能障碍,影响患者正常生活和工作,并可增加意外事件发生风险[1]。癫痫发作早期神经元损伤具有可逆性,通过相应治疗可挽救受损细胞,发作中晚期,神经元损伤转变为不可逆性,治疗只能挽救部分神经元,因此在癫痫发作早期应及时采用药物治疗防治癫痫发作[2]。传统药物治疗癫痫,可在一定程度缓解患者症状,但治疗效果有限,部分患者甚至症状加重,产生认知及情感障碍等并发症。研究结果显示,大麻二酚、地塞米松等具有抗炎作用,可降低癫痫发作频率,这为靶向炎症治疗阻止癫痫进展提供了新思路[3-4]。铁皮石斛多糖(dendrobium officinale polysaccharides,DOP)为传统中药铁皮石斛主要活性成分,具有抗炎、抗肿瘤、抗氧化、提高免疫力等作用[5]。目前,有关DOP在抗癫痫方面的研究尚少,其在抗癫痫中的作用机制尚不明确。该研究探讨了DOP抗癫痫作用及其可能机制,为临床治疗癫痫提供参考依据。
1 材料和方法
1.1 实验动物SPF级Wistar雄性大鼠85只,7周龄,体质量200~220 g,购自上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2017-0005。置22℃~25℃、相对湿度50%~70%的清洁通风环境饲养,12 h/12 h明暗交替,自由进食饮水,适应性饲养7 d。实验过程符合3R原则。
1.2 主要试剂DOP为西安中科达生物科技有限公司产品,大鼠白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自北京索莱宝科技有限公司,兔抗大鼠核因子κB(nuclear factor κB,NF-κB)p65、p-NF-κB p65,NF-κB抑制蛋白α(NF-κB inhibitor protein alpha,IκBα)、p-IκBα、p-NF-κB p65、B细胞淋巴瘤/白血病-2基因(B-cell lymphoma/leukemia-2gene,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 assoaciated X protein,Bax)一抗以及HRP标记的二抗购自美国Abcam公司。
1.3 方法
1.3.1癫痫模型制备:随机取70只大鼠制备癫痫模型,余15只大鼠为对照组。给予模型组大鼠按体重127 mg/kg腹腔注射氯化锂,20 h后按体重1 mg/kg皮下注射东莨菪碱,30 min后按体重50 mg/kg腹腔注射毛果芸香碱。对照组大鼠腹腔注射生理盐水。采用Racine分级[6]标准判定癫痫发作级别,4级持续30 min以上进入癫痫持续状态(status epilepticus,SE)视为建模成功,SE持续2 h后,按体重10 mg/kg腹腔注射地西泮终止癫痫。最终建模成功64只,随机分为癫痫模型组、丙戊酸钠组及DOP低、高剂量组,各16只。造模成功当天,分别给予DOP低剂量(200 mg/kg)组、DOP高剂量(400 mg/kg)组和丙戊酸钠组(0.94 g/kg)灌胃干预,1次/d,连续4周,对照组和癫痫模型组按相同方式给予等量生理盐水。
1.3.2行为学观察:末次干预12 h后,观察各组大鼠癫痫发作情况,记录首次发作潜伏期(末次干预12 h开始至首次出现4级以上癫痫发作时间)。
1.3.3Morris水迷宫实验:行为学观察后,采用Morris水迷宫实验检测大鼠认知能力。(1)定位航行实验(测试学习能力):将大鼠放至任一入水点,游至平台时间即为逃避潜伏期,若未能在120 s内游至平台,则引导其爬至平台,连续训练5 d,记录第6天逃避潜伏期。(2)空间探索实验(测试空间记忆能力):第7天撤去平台,以距平台最远象限为入水点,记录大鼠120 s内穿越平台次数。
1.3.4海马组织炎症因子检测:每组随机取5只大鼠,腹腔注射1%(质量浓度)戊巴比妥钠麻醉,断头取脑,分离海马组织,制备组织匀浆。按照ELISA试剂盒说明书步骤操作,采用酶标仪检测450 nm处吸光度值,根据标准曲线计算IL-1β、TNF-α水平。
1.3.5海马神经元存活情况:每组随机取5只大鼠,剥离海马组织,以4%(质量浓度)多聚甲醛固定72 h,石蜡包埋,切片(片厚4 μm),二甲苯透明、酒精脱水,Nissl染色液37℃染色30 min,水洗,风干,二甲苯透明,中性树胶封片,置显微镜下观察并计数存活神经元数目。
1.3.6TUNEL染色:取海马切片,脱蜡至水,加入3%(质量分数)H2O2反应5 min,依次加入蛋白酶K孵育30 min,TUNEL液孵育60 min,3%(质量浓度)BSA孵育20 min,POD转换液反应30 min,DAB显色,苏木素复染。置显微镜下观察神经元凋亡情况,并计算凋亡指数(棕色凋亡细胞数/细胞总数×100%)。
1.3.7Western blot检测:处死各组剩余大鼠,剥离海马组织,加入RIPA裂解液提取总蛋白,BCA法测定蛋白浓度;蛋白变性,上样,电泳,转膜;将膜放入5%(质量浓度)脱脂奶粉室温封闭2 h,加入 1∶1000稀释的IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、Bcl-2、Bax一抗,4℃孵育过夜,洗膜,加入二抗室温孵育1 h,洗膜;ECL发光,扫描图片。计算目的蛋白相对表达水平(目的蛋白条带灰度值/内参条带灰度值)。
1.4 统计学处理采用SPSS 25.0软件进行统计学处理,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差表示,两均数间比较采用t检验;多组均数比较采用单因素方差分析,两两比较采用LSD-t检验。取α=0.05。
2 结果
2.1 各组癫痫发作潜伏期比较与癫痫模型组比较,DOP低剂量组、DOP高剂量组和丙戊酸钠组发作潜伏期延长(P<0.05);与DOP低剂量组比较,DOP高剂量组和丙戊酸钠组发作潜伏期延长(P<0.05);DOP高剂量组和丙戊酸钠组比较差异无统计学意义(P>0.05)。结果见表1。
2.2 Morris水迷宫实验结果与对照组比较,癫痫模型组大鼠逃避潜伏期延长,穿越平台次数减少(P<0.05);与癫痫模型组比较,DOP低剂量组、DOP高剂量组和丙戊酸钠组逃避潜伏期缩短,穿越平台次数增加(P<0.05);与DOP低剂量组比较,DOP高剂量组和丙戊酸钠组逃避潜伏期缩短,穿越平台次数增加(P<0.05);DOP高剂量组和丙戊酸钠组比较差异无统计学意义(P>0.05)。结果见表1。
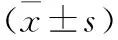
表1 各组大鼠癫痫发作潜伏期和Morris水迷宫检测结果比较
2.3 海马组织IL-1β和TNF-α水平比较与对照组比较,癫痫模型组海马组织IL-1β、TNF-α水平升高(P<0.05);与癫痫模型组比较,DOP低剂量组、DOP高剂量组和丙戊酸钠组IL-1β、TNF-α水平降低,DOP高剂量组和丙戊酸钠组低于DOP低剂量组(P<0.05);DOP高剂量组和丙戊酸钠组比较差异无统计学意义(P>0.05)。结果见表2。
2.4 海马神经元细胞存活情况与对照组比较,癫痫模型组海马神经元存活数减少,神经元凋亡指数高(P<0.05);与癫痫模型组比较,DOP低剂量组、DOP高剂量组和丙戊酸钠组海马神经元存活数增加,凋亡指数降低(P<0.05);与DOP低剂量组比较,DOP高剂量组和丙戊酸钠组神经元存活数高,凋亡指数低(P<0.05);DOP高剂量组和丙戊酸钠组比较差异无统计学意义(P>0.05)。结果见表2、图1~2。
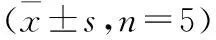
表2 各组大鼠海马组织炎性因子及神经元存活情况比较
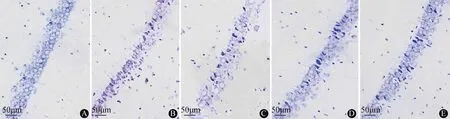
注:A:对照组;B:癫痫模型组;C:DOP低剂量组;D:DOP高剂量组;E:丙戊酸钠组图1 各组大鼠海马CA1区神经元存活情况(Nissl染色)
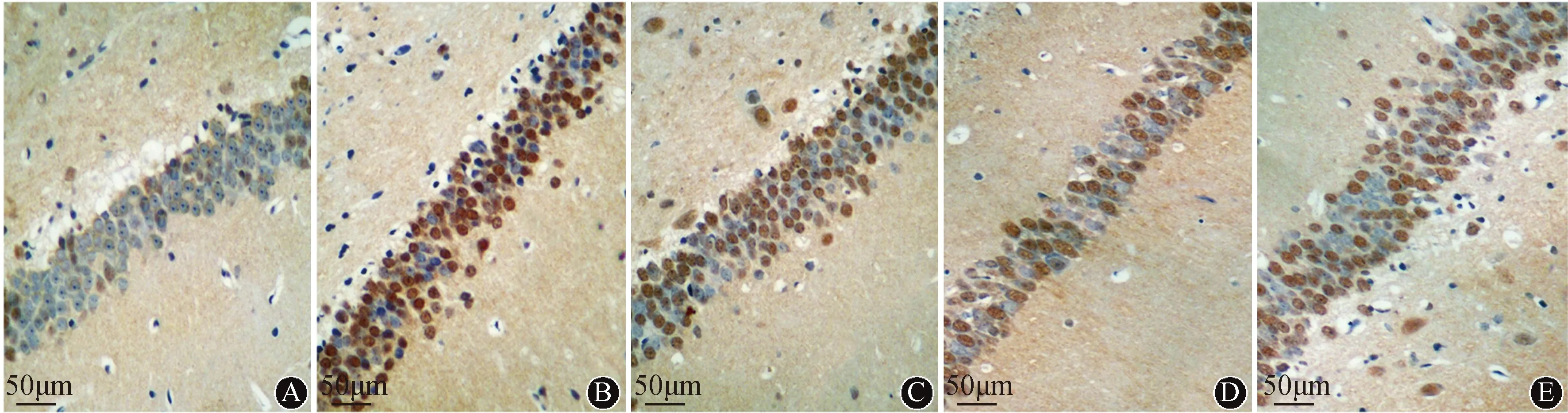
注:A:对照组;B:癫痫模型组;C:DOP低剂量组;D:DOP高剂量组;E:丙戊酸钠组图2 各组大鼠海马CA1区神经元凋亡情况(TUNEL染色)
2.5 海马组织蛋白表达与对照组比较,癫痫模型组海马组织p-IκBα、p-NF-κB p65、Bax蛋白表达高,Bcl-2蛋白表达低(均P<0.05);与癫痫模型组比较,DOP低剂量组、DOP高剂量组和丙戊酸钠组p-IκBα、p-NF-κB p65、Bax蛋白表达低,Bcl-2蛋白表达高(P<0.05);与DOP低剂量组比较,DOP高剂量组和丙戊酸钠组p-IκBα、p-NF-κB p65、Bax蛋白表达低,Bcl-2蛋白表达高(P<0.05);DOP高剂量组和丙戊酸钠组比较差异无统计学意义(P>0.05)。结果见表3、图3。
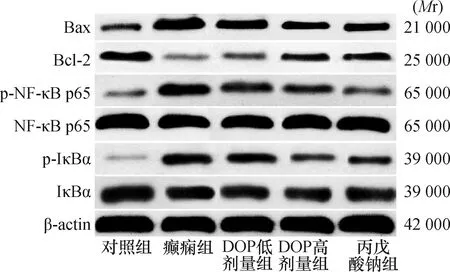
图3 各组大鼠海马组织蛋白表达电泳图(Western blot)
表3 Western blot法检测各组大鼠海马组织相关蛋白表达
3 讨论
研究结果显示,癫痫患者脑组织炎症因子水平明显升高,并可与神经元相互作用,促进癫痫进入恶性循环[7]。癫痫发作后,患者可出现不同程度认知受损。动物模型证实癫痫发作后其空间记忆能力及探索行为明显下降[8-9]。海马组织参与记忆、情感等重要认知功能,其神经元损伤可引起海马结构完整性丢失,是导致海马相关认知功能下降的重要原因之一[10]。炎症与癫痫进展及严重程度密切相关,干扰炎症通路可为治疗癫痫提供新的治疗途径。
炎症及癫痫均可激活中枢神经系统,分泌大量IL-1β和TNF-α等活性物质,增加海马神经元兴奋毒性,诱导细胞凋亡,导致海马组织丢失,引发认知功能障碍,干扰炎症通路可能为治疗癫痫提供新的治疗途径。既往研究证实,DOP在慢性萎缩性胃炎及结肠炎动物模型中具有明显抗炎作用[11-12]。该研究结果显示,模型组大鼠处于癫痫发作期,经治疗后,DOP低、高剂量组和丙戊酸钠组海马组织炎症因子水平下降,发作潜伏期延长,学习记忆能力提高,海马神经元存活数目增加,凋亡减少,且DOP高剂量组和丙戊酸钠组效果无统计学差异,提示DOP可减轻癫痫大鼠脑组织炎症,改善海马神经元损伤,维持海马认知功能,发挥抗癫痫作用。另有研究显示,DOP可抑制海马小胶质细胞活化,改善阿尔兹海默病小鼠认知功能,表明DOP具有神经保护作用[13]。由此推测DOP通过抑炎作用保护神经海马神经元,发挥抗癫痫效果,然而其确切机制尚不清楚。
NF-κB在炎症反应及细胞凋亡等过程中发挥重要作用。典型NF-κB是由p50和p65组成的异源二聚体,p50结合DNA,p65参与调节基因转录。IκBα参与调节NF-κB活性,静息状态下,NF-κB二聚体与IκBα结合成无活性三聚体存在于细胞质内,阻止NF-κB与DNA结合。当神经系统受到IL-1β、TNF-α等因素刺激时,IκBα磷酸化活化后被降解,NF-κB解离进入细胞核,p65磷酸化活化,参与调节靶基因转录。NF-κB通路参与癫痫发生发展过程,针对癫痫患者术后脑组织切片的研究显示,海马组织中NF-κB过度表达,表明NF-κB参与癫痫形成过程,推测其介导的炎症反应参与海马神经元损伤,导致认知功能障碍,与癫痫进展密切相关[14-15]。抑制NF-κB信号通路,可减少大鼠海马神经元凋亡,减轻神经损伤[16]。Bcl-2和Bax基因属于Bcl-2家族,分别为抑凋亡基因和促凋亡基因,二者可结合形成同源或异源二聚体参与调节细胞凋亡。该研究结果显示,癫痫模型组大鼠NF-κB信号通路被激活,Bax表达升高,经DOP和丙戊酸钠治疗后,p-IκBα和p-NF-κB p65表达明显下降,Bcl-2表达升高,Bax表达下降,提示DOP可能通过抑制NF-κB信号通路减轻炎症反应,减少神经元细胞凋亡,发挥抗癫痫作用。NF-κB通路在癫痫中发挥重要作用,抑制该通路可为治疗癫痫寻找新的治疗靶点[17]。
综上所述,该研究结果显示,DOP可明显改善癫痫大鼠认知功能,减轻海马炎症反应,减少神经元凋亡,保护神经元细胞,发挥抗癫痫作用,其机制可能与抑制NF-κB信号通路有关,这为临床治疗癫痫提供了新的靶点和实验依据。
