载姜黄素金纳米复合微粒的制备及体外释放研究
2021-10-07罗雪玲徐雪梅冯建海
罗雪玲,黎 姿,徐雪梅,冯建海
(河池学院化学与生物工程学院,广西 宜州 546300)
GLOBOCAN2020全球癌症数据统计表明,2020年全球癌症新增1900万例,990万例癌症患者死亡[1],由此可见,癌症的发病率和死亡率极高。目前,癌症的主要治疗手段有手术、化疗和放疗几类[2],但是这些常规治疗的局限性较大且缺乏选择性。最近发展起来的靶向治疗可以抑制癌症中的特定分子或单一致癌因素,防止细胞的生长和肿瘤的增生[3],使抗癌药物能最大限度地发挥其药效,从而达到较好的治疗作用。
姜黄素是从姜科植物中提取的一种可食用色素,安全无毒。许多研究发现,姜黄素具有众多的药理作用如抗肿瘤、抗炎、抗氧化等[4-7],被认为是理想的抗癌药物之一。但姜黄素难溶于水,生物利用率低,抗氧化性差[8-10],这些缺点极大限制了姜黄素在临床上的应用。为了克服姜黄素的稳定性差、生物利用率低等缺点,许多研究者制备了纳米粒[11]、脂质体[12-13]、介孔材料[14]等药物载体,以达到运输药物的目的,也能让姜黄素在生物体内中更加稳定且高效地发挥其药效。制备有效的载体是提高姜黄素药效的主要研究方向。
纳米材料具有优良的性质,使得其在化工[15-16]、医学[17-18]等领域具有广阔的应用前景,同时,纳米材料具有较高的灵敏性和选择性,能满足现代医疗技术的要求[19]。随着纳米技术的发展,纳米金被发现具有良好的细胞穿透性、低细胞毒性和温和的表面化学性质,被多种基团修饰后易获得对肿瘤细胞的靶向性[20-21],还具有特殊的物理性质和优良的生物相容性,是一种具有载药功能的纳米材料,广泛应用于医疗当中。
纳米金还是一种光热纳米材料[22],能利用激光作用于肿瘤部位,使其局部温度升高,从而杀死癌细胞,这在肿瘤的治疗中更有优势。利用纳米材料来传递药物,使其在体内的指定地点释放药物,不仅可提升药物的利用率,也能减少化疗后出现的副作用。雷彪[23]合成了纳米金链,将其作为诊断制剂与抗癌药物的载体,可实现癌症的诊断和治疗。
介孔二氧化硅材料是一种孔径小于50nm的多孔固体材料[24],具有较大的比表面积,热稳定性好[25],被广泛应用于载药材料的研究。介孔二氧化硅具有的细小孔径,可以增加载药空间的容量,从而提高整体的载药量[26],并能将药物稳定地吸附而不影响其性质,是载药材料研究的热点。
我们采用水热法制备了具有孔隙的纳米金微粒,对其负载姜黄素的工艺条件进行了单因素实验,以期得到最佳的姜黄素浓度、载体质量等数据,获得最佳的负载率,并在体外模拟生物的细胞环境中,进行姜黄素的体外缓释实验。
1 材料与方法
1.1 实验试剂
氯化羟胺(AR),N-乙基-Y-氨丙基三甲基硅烷(CP),磷酸二氢钾(AR),氢氧化钠(AR),硅酸四乙酯(CP),无水乙醇(AR),十六烷基三甲基溴化铵(AR),四氯金酸(CP),姜黄素(AR)。
1.2 仪器和设备
Phenom G5 pure型台式扫描电镜,ZWY-1102C型恒温培养振荡器,NICOLET6700型傅里叶变换红外光谱仪,Agilent8453型紫外可见分光光度计,MINIFLEX60型X射线衍射仪,DHG-9245A型电热恒温鼓风干燥箱,DF-101S型集热式恒温加热磁力搅拌器,TGL-18C型高速台式离心机,HZ-124/35型万分之一分析天平,LB-550型动态光散射粒度分析仪,TG/DTA6300型微分热重分析仪。
1.3 实验方法
1.3.1 Au纳米复合微粒粗产品的制备
取0.05mol·L-1的CTAB溶液5 mL加入25 mL圆底烧瓶中,放入恒温水浴锅中,在35℃条件下反应。加入100mol·L-1的HAuCl4溶液4mL,磁力搅拌10min,加入5mL盐酸羟胺溶液(5 mL去离子水+120 mg盐酸羟胺),在水浴锅中恒温反应6h后,加入1mL正硅酸乙酯和1mL的N-氢乙基-Y-氨丙基三甲基硅烷继续反应2h后,再加入2mol·L-1NaOH溶液2 mL反应2h,最后将溶液离心,除去上清液,60℃干燥48h后得到金纳米复合微粒粗产品。
1.3.2 Au纳米复合微粒的制备
准确称量400mg纳米金复合微粒粗产品,将其加入35 mL的1 mol·L-1的NaOH溶液中静置20 min,于30℃、60Hz的超声机中超声震荡30min,将溶液重复多次离心,直至上清液呈中性。用胶头滴管除去上清液,沉淀在60℃下干燥48h后得到产品。
1.4 样品表征
1.4.1 Au纳米复合微粒的XRD分析
将烘干的金纳米复合微粒放置在专用的样品台上,放入仪器中进行扫描,扫描速度5°·min-1,扫描范围为10°~90°。
1.4.2 Au纳米复合微粒粗产品、Au纳米复合微粒的粒度表征
将一定量的样品在去离子水中超声分散后,将浊液放入仪器中并选择水相进行测定,每个样品平行测定3次。
1.4.3 Au纳米复合微粒粗产品、Au纳米复合微粒的扫描电镜表征
取少量样品放到导电胶上分散均匀,置于金属载物台上,在扫描电镜上观察,选取比较有代表性的视野进行微观拍照。
1.4.4 Au纳米复合微粒、Cur-Au纳米复合微粒的热重表征
取2个干净的热重专用坩埚,放置在对应位置进行调零后,将右边的坩埚取下,放入10mg左右的样品,设置1000℃的温度对样品进行灼烧。仪器温度显示为室温时,对数据进行保存。
1.4.5 Au纳米复合微粒、Cur-Au纳米复合微粒、姜黄素的红外光谱表征
将待测样品和溴化钾干燥后,取质量比为200∶1的溴化钾和样品放在玛瑙研钵中进行充分研磨。将研磨好的粉末压片,以KBr为空白对照,将压片放在红外光谱仪中,在波长4000cm-1~500cm-1下进行扫描分析。
1.5 单因素实验
1.5.1 不同质量的金纳米复合微粒对包封率和载药量的影响
准确称取一定质量的金纳米复合微粒(5.0、10.0、15.0、20.0、25.0、30.0 mg),分别加入装有20 mL的1mg·mL-1姜黄素溶液的锥形瓶中,放进摇床中,30℃下恒温避光震荡4 h,12000r·min-1离心5min。将上清液稀释到合适倍数,测定其紫外吸收吸光度,计算相应的包封率和载药量,考察不同质量的金纳米复合微粒对包封率和载药量的影响。
1.5.2 不同的姜黄素浓度对包封率和载药量的影响
配制不同浓度的姜黄素溶液(0.5、1.0、1.5、2.0、2.5、3.0mg·mL-1),准确量取20mL各个浓度的姜黄素溶液,分别加入250mL锥形瓶中,称量最优的金纳米复合微粒质量,分别加入到各个浓度的姜黄素溶液中,后续操作与1.5.1相同,考察不同的姜黄素浓度对包封率和载药量的影响。
1.5.3 不同的反应时间对包封率和载药量的影响
准确称取最优质量的金纳米复合微粒,加入20 mL最优浓度的姜黄素溶液中,在30℃、避光的摇床中反应,并在不同的反应时间(2h、6h、12h、24h、48h),用针筒过滤器将少量的姜黄素进行过滤,将姜黄素滤液稀释到一定倍数后,测定吸光度,并计算相应的时间,考察不同的反应时间对包封率和载药量的影响。
1.5.4 最优条件下Cur-Au纳米微球的制备
准确称量4份最优质量的纳米金复合微粒,分别加入20mL最优浓度的姜黄素溶液中,放置在摇床中,30℃下恒温避光震荡最优的反应时间。反应完成后将溶液离心,沉淀在60℃烘箱中避光烘干。将上清液的姜黄素稀释到一定倍数后测定吸光度,计算得到最优的金纳米复合微粒的包封率和载药量
1.6 包封率、载药量和缓释实验
1.6.1 姜黄素乙醇溶液标准曲线的测定
精密称量姜黄素5mg溶于50mL乙醇中,配制成0.1mg·mL-1的姜黄素乙醇原液,再将原液配制成0.5、1.0、2.0、4.0、6.0、8.0mg·L-1的标准姜黄素乙醇溶液。用无水乙醇作为空白液,姜黄素最大吸收波长为427 nm,用紫外-可见分光光度计在427 nm波长下测定各个浓度的吸光度,得到相应浓度下姜黄素溶液的吸光度。以吸光度A为纵坐标,以浓度C(mg·L-1)为横坐标,绘制散点图,得到姜黄素乙醇溶液的标准曲线。
1.6.2 包封率和载药量的测定
精确吸取一定量未经处理的上清液,将其加入5 mL棕色容量瓶中,加入无水乙醇定容,测定吸光度,并根据以下公式计算包封率和载药量。

1.6.3 姜黄素-乙醇-磷酸缓冲液标准曲线的测定
取一定量的0.1mg·mL-1的姜黄素乙醇溶液放入5 mL锥形瓶,用pH=6.5的磷酸盐缓冲液定容,然后在427 nm的最大吸收波长下测定吸光度,得到相应浓度下的吸光度,并以浓度C(mg·L-1)为横坐标,吸光度A为纵坐标,绘制散点图,得到标准曲线。
1.6.4 姜黄素-金纳米复合微粒体外释放药物
实验组:称取一定质量的姜黄素-金纳米复合微粒,加入一定体积的无水乙醇进行分散,并将其转移至透析袋中,再加入pH=6.5的磷酸盐缓冲溶液50 mL,放置在37 ℃、160 r·min-1的恒温摇床中进行避光震荡。分别于0.5、1.0、2.0、4.0、6.0h时,取磷酸盐缓冲液5mL,测定其吸光度,测完后将取出来的溶液再放回到相应的锥形瓶中,使其继续缓释。
空白组:取一定质量的姜黄素,用10mL无水乙醇分散后转移至透析袋,之后的操作同实验组。
2 结果分析与讨论
2.1 材料形貌结构的分析与讨论
2.1.1 Au纳米复合微粒的XRD图分析
由PDF标准卡片可知,Au的标准衍射峰为38.26°、44.60°、64.78°、77.55°等。图1为金纳米复合微粒的X射线粉末衍射图,由图可知,该材料在与标准卡片对应的位置都出现了衍射峰,而且在38.30°时衍射峰的强度最大,表明制备的材料中存在Au。主要的衍射峰清晰且尖锐,表明复合微粒的晶形较好,晶化程度较高。
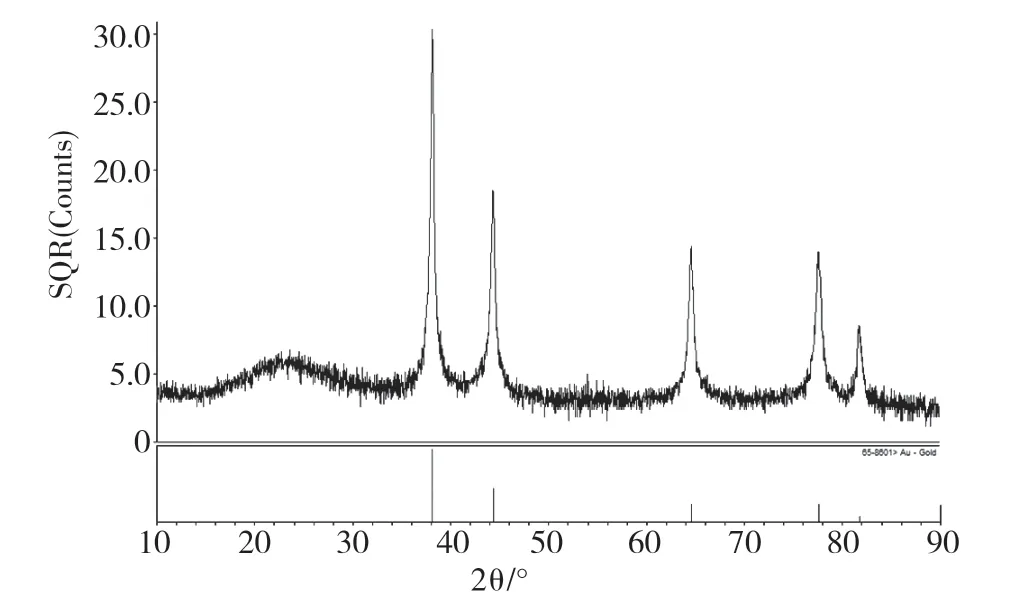
图1 Au纳米微球材料的XRD图Fig.1 XRD image of nanometer microsheres
2.1.2 Au纳米复合微粒粗产品、Au纳米复合微粒的粒度分析
作为药物载体的纳米材料,是粒径介于10~1000nm的固体颗粒。由图2可知,金纳米复合微粒粗产品的平均粒径为593.4 nm,由图3可知,粗产品经NaOH处理后得到金纳米复合微粒,其粒径有明显降低,最后得到的复合微粒的平均粒径为259.6 nm,粒径较小且分散性良好。对于药物载体来说,载体的粒径越小,在生物体内的运输会更加方便,更加有利。
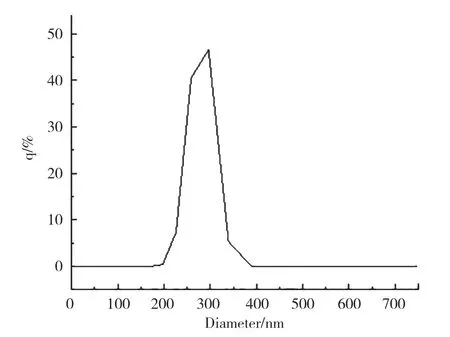
图2 Au纳米复合微粒粗产品粒度分析图Fig.2 Particle size analysis diagram of Au nanometer coarse products
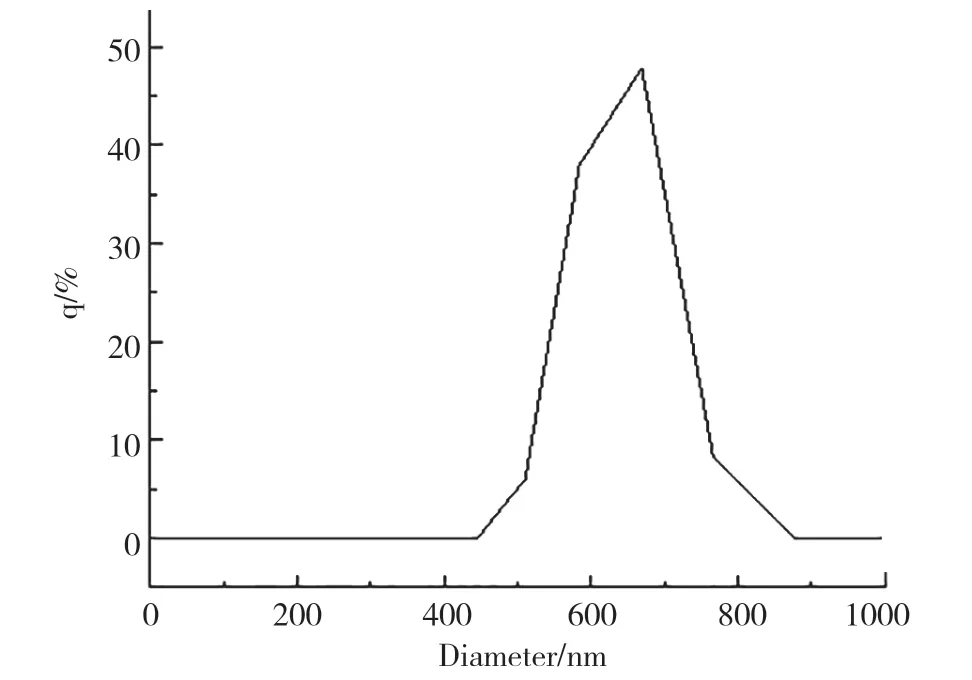
图3 Au纳米复合微粒粒度分析图Fig.3 Au nanoparticle particle size nanlysis diagram
2.1.3 Au纳米复合微粒粗产品、Au纳米复合微粒的扫描电镜分析
金纳米复合微粒和姜黄素-金纳米复合微粒的扫描电镜结果见图4、图5。由图4(a)可以看出,复合微粒没有固定的形状,形态各异,颗粒大小分布不均,效果较差。由图4(b)可看出,粗产品有很多小颗粒,堆积在一起,分散不完全,造成复合微粒的体积较大,而且孔隙也很小,不能有效地负载药物。
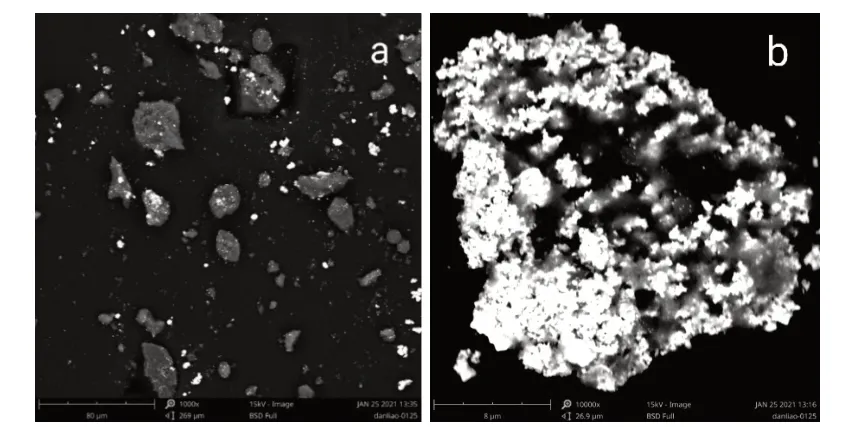
图4 金纳米复合微粒粗产品电镜分析图Fig.4 Electron microscope analysis of gold nanocomposite particles
由图5(a)可看出,经NaOH处理后的金纳米复合微粒的直径在5~10 μm左右,尺寸明显减小,分散性较好,微粒的形态较为圆整,大小较为均一。由图5(b)可以清楚地看到,经NaOH处理后的金纳米复合微粒呈鳞片状,表面较为粗糙,片状与片状之间相互堆积,形成一个新的纳米金微粒,使其作为一个载体。片状微粒在堆积时形成了一些小孔,这些小孔可以有效地包裹住姜黄素,将姜黄素运输到指定位置,又不破坏姜黄素的结构和性质。
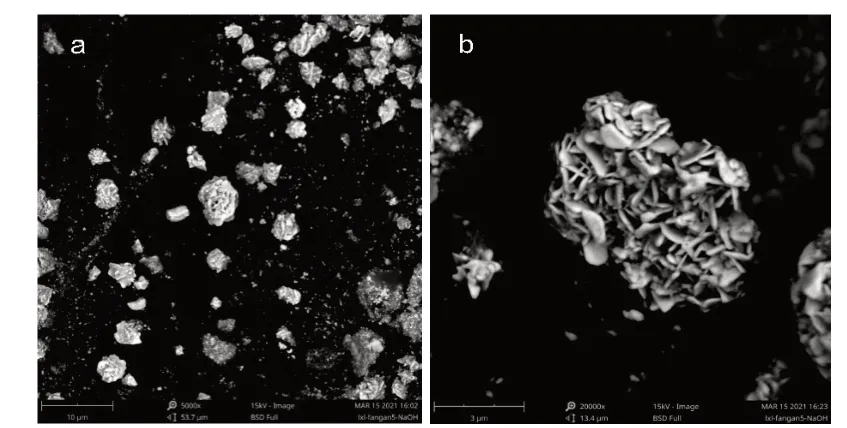
图5 金纳米复合微粒电镜分析图Fig.5 Electron microscopic analysis of gold nanocomposite particles
2.1.4 Au纳米复合微粒及Cur-Au纳米复合微粒的热重图分析
图6是金纳米复合微粒和姜黄素-金纳米复合微粒的热重分析图谱。由图可知,金纳米复合微粒经高温灼烧后,质量由9.02 mg减少为8.87 mg,失重百分比由100 %变成98.31 %。姜黄素-金纳米复合微粒经相同的处理后,质量由11.43 mg减少为11.22 mg,失重百分比由100 %变为97.84 %。
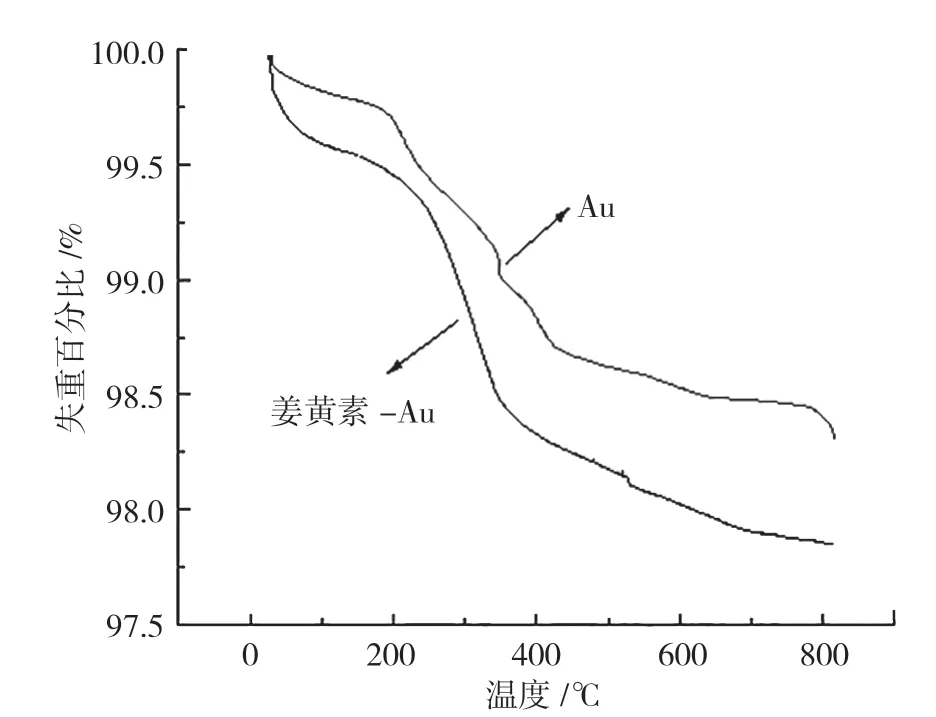
图6 Au、姜黄素-Au材料的微分热重图Fig.6 Differential thermogravimetric diagram of Au and Cur-Au materials
失重比的降低较小,说明制备的纳米微粒较为稳定,能在体内稳定存在,其性质不易被改变,对于运输药物也更加有利。负载姜黄素的金纳米复合微粒有一定的失重率损失,在一定程度上证明了姜黄素的存在。
2.1.5 Au纳米复合微粒、姜黄素-Au纳米复合微粒、姜黄素的红外光谱分析
图7为姜黄素、姜黄素-金纳米复合微粒和金纳米复合微粒的红外吸收光谱。由图7的姜黄素红外谱图可知,3450 cm-1出现了−OH伸缩震动吸收峰,1628cm-1出现了−OH面内弯曲震动,1510 cm-1附近是苯环结构,2923 cm-1出现的较强吸收峰,主要是−C−H伸缩震动峰,符合姜黄素的基本结构,这些峰都是姜黄素的特征峰。
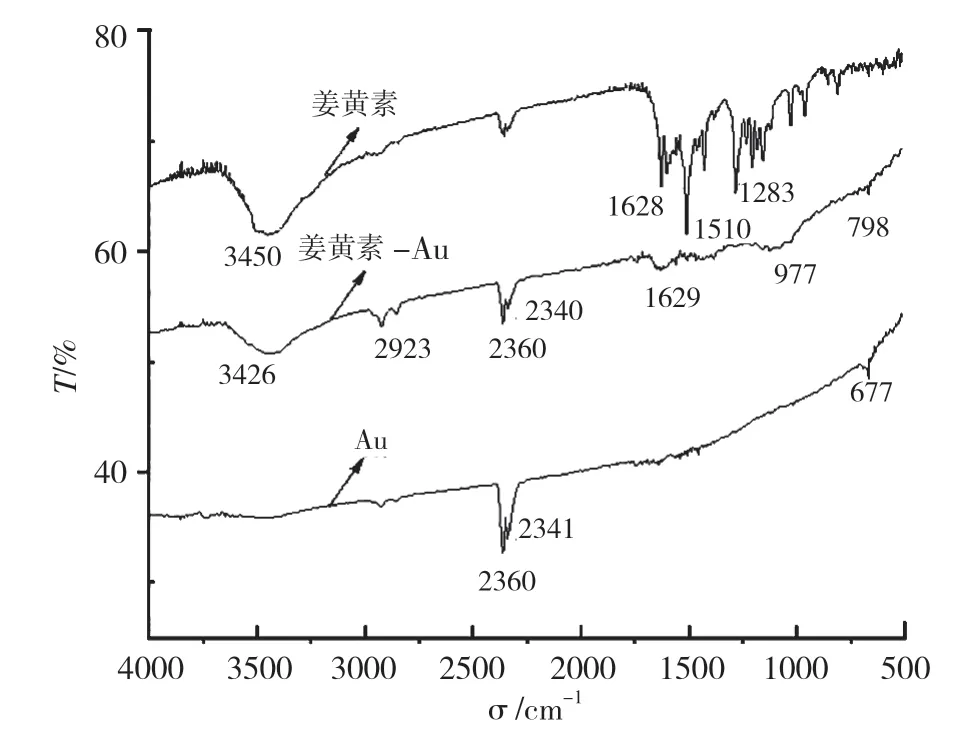
图7 姜黄素、姜黄素-Au、Au红外吸收光谱图Fig.7 Infrared absorption spectra of Cur,Cur-Au and Au
Au的红外谱图较为单一,主要出现了2360cm-1和2341cm-1这2个特征峰。姜黄素-Au纳米复合微粒的红外光谱图中不仅在1629 cm-1出现了−OH面内弯曲震动,也在3426cm-1出现了−OH伸缩震动吸收峰。姜黄素-Au纳米复合微粒的红外光谱不仅在一定位置出现了单料的特征峰,还出现了姜黄素的特征峰,说明纳米金复合微粒上成功负载了姜黄素。
2.2 单因素实验结果分析
2.2.1 Au纳米复合微粒的最优质量
由表1可知,其他条件相同时,金纳米复合微粒质量为25 mg时的包封率最大,复合微粒质量为10 mg时的载药量最大。当复合微粒质量为20 mg时,包封率和载药量相对来说都比较好。考虑到实验数据及可行性等各种因素,复合微粒质量20 mg是最优质量。
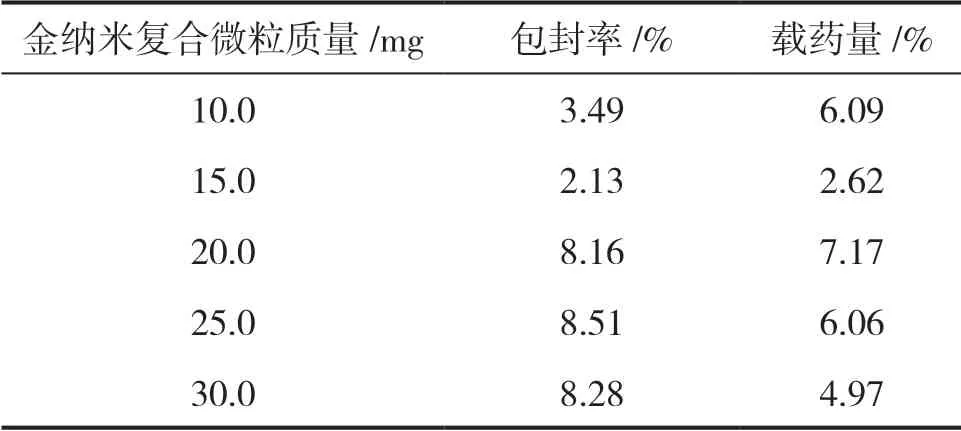
表1 不同复合微粒质量的包封率和载药量结果Table 1 The encapsulation rate and drug loading under different composite particle mass
2.2.2 姜黄素的最优浓度
由表2可知,其他条件都相同时,姜黄素浓度为1.0mg·mL-1时的包封率最大,姜黄素浓度为3.0mg·mL-1时的载药量最大。综合考虑,姜黄素浓度为3.0mg·mL-1时单料的包封率和载药量都较好,因此,最优的姜黄素浓度为3.0mg·mL-1。
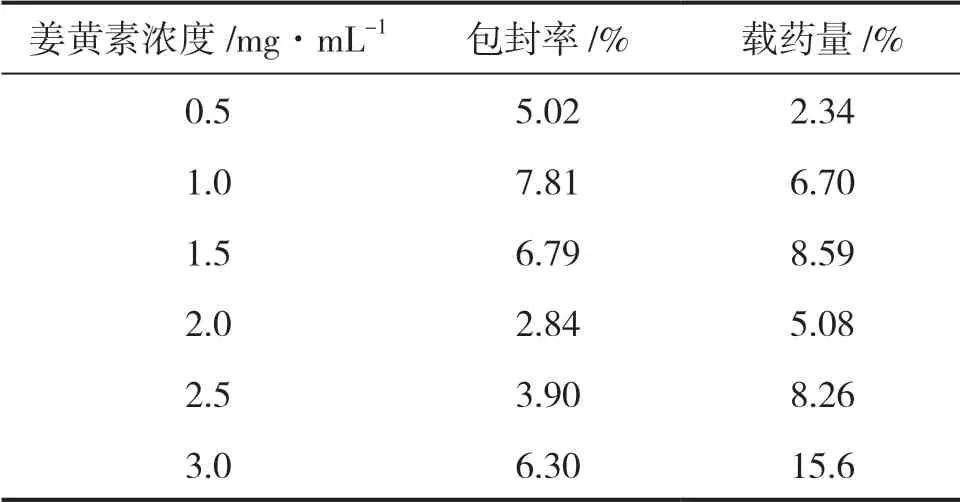
表2 姜黄素浓度不同时的包封率和载药量结果Table 2 The encapsulation efficiency and drug loading with different ccurcumin concentration
2.2.3 最优的姜黄素吸附时间
由表3可知,其他反应条件都相同时,单料吸附姜黄素的时间为6h,计算得到的包封率和载药量都最大,因此,复合微粒吸附姜黄素的最优时间为6h。
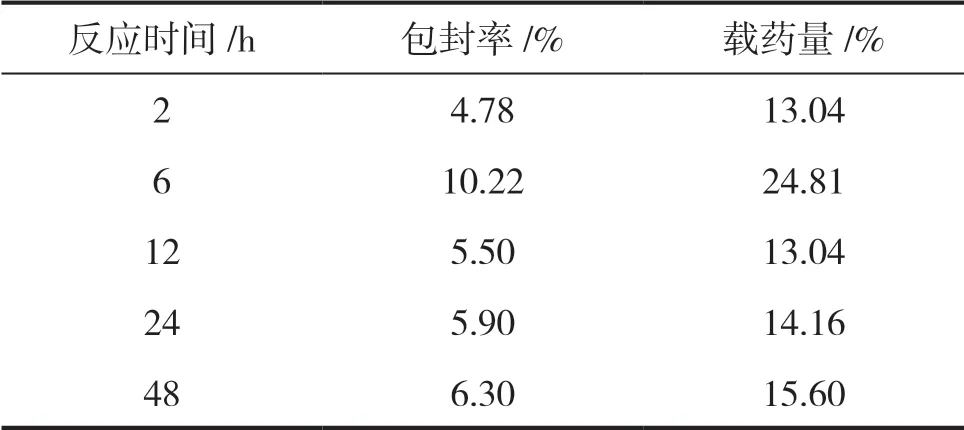
表3 姜黄素的吸附时间不同时的包封率和载药量结果Table 3 The encapsulation efficiency and drug loading with different adsorption time of curcumin
2.2.4 黄素乙醇溶液标准曲线的结果与分析
将配制好的姜黄素-乙醇标准溶液,在最大吸收波长427 nm下测定其吸光度,得到的标准曲线见图8。在427nm处,姜黄素-乙醇溶液的回归方程为A=0.1723C-0.015(R2=0.9997)。由标准曲线可知,姜黄素-乙醇溶液在浓度为0.5~8.0 mg·L-1时有良好的线性关系。如图9所示,姜黄素-乙醇-缓冲溶液的回归方程为A=0.0751C-0.01(R2=0.9999),表明姜黄素乙醇磷酸缓冲液也有较好的线性关系。
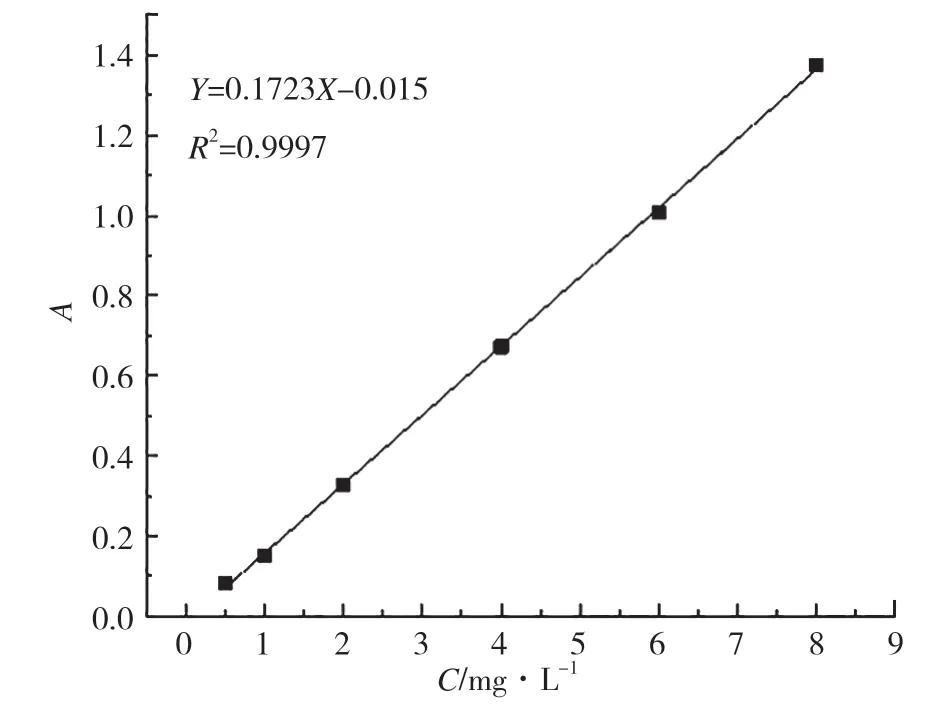
图8 姜黄素-乙醇溶液标准曲线图Fig.8 Standard curve of curcumin-ethanol solution
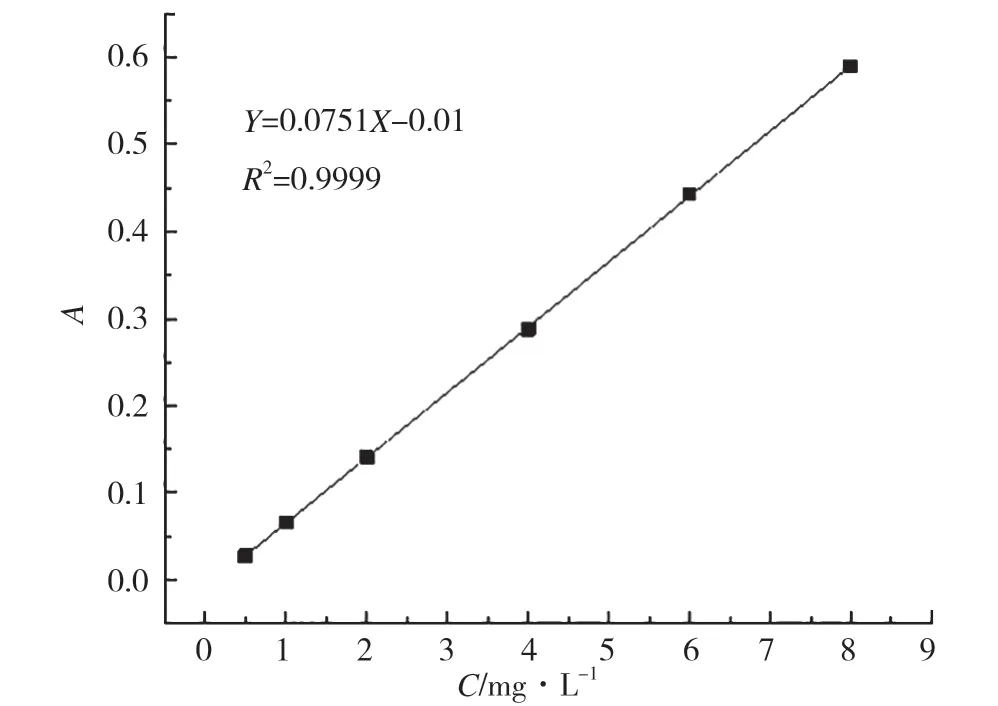
图9 姜黄素-乙醇-磷酸缓冲液标准曲线图Fig.9 Curcumin-ethanol-phosphoric acid bufferstandard curve
2.3 材料的载药量和缓释性能
2.3.1 姜黄素-金纳米复合微粒的包封率和载药量的结果与分析
表4是平行制作的4组负载姜黄素的金纳米复合微粒的包封率和载药量结果。实验结果表明,制备的姜黄素金纳米复合微粒具有较好的包封率和载药量,作为药物载体比较合格。
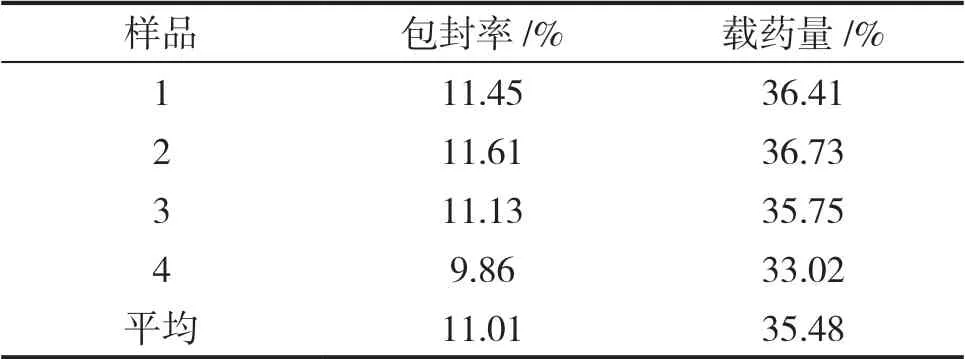
表4 最优条件下的包封率和载药量结果
2.3.2 材料的载药缓释性能结果与分析
由图10可知,只用姜黄素进行体外缓释实验时,姜黄素的释放率很快,缓释的前2h,甚至出现了突释现象,这种缓释结果是较差的。对于生物体来说,如果药物的释放率较快,则达不到所需的治疗效果,还可能对其他细胞造成损伤,导致出现严重的副作用。

图10 姜黄素、姜黄素-Au材料的缓释图Fig.10 Slow-release diagram of Cur and Cur -Au materials
用姜黄素-金纳米复合微粒组合体进行体外缓释实验时,药物释放较慢,6h姜黄素的释放率仅为6.4%,没有出现突释现象,缓释率较低,效果较好。对于生物体来说,较慢的药物释放率更容易接受,也使载体能够到达指定地点后再释放药物,增加了杀死癌细胞的几率。由此可见,姜黄素负载在金纳米复合微粒上,实现了药物长时间释放的效果,既可以降低药物对人体产生的副作用,也能更有效地杀死癌细胞,因此将姜黄素负载在金纳米复合微粒上,可以有效地将药物进行缓释。
3 结论
本文采用水热法,成功制备了金纳米复合微粒,并对其进行了XRD、扫描电镜、红外光谱等表征。表征结果表明,微粒的形态较好,尺寸大小较为均匀,符合预设目标。同时成功制备出负载了姜黄素的金纳米复合微粒,并对姜黄素的浓度和单料质量进行了单因素实验,结果表明当姜黄素浓度为3mg·mL-1、单料质量为20mg时,复合微粒的包封率和载药量最大,平均包封率为11.01%,平均载药量为35.48%,结果较好。
从体外缓释的实验结果可知,负载了姜黄素的金纳米复合微粒的性质,较单纯的姜黄素更为稳定,在相同的实验条件下,负载了姜黄素的金纳米复合微粒在体外释放姜黄素的速度较为缓慢,而单纯的姜黄素释放率较大,表明金纳米复合微粒有较好的稳定性,对姜黄素有一定的保护作用,可增加姜黄素在生物体内的稳定性,也能最大限度地发挥其药效。相关的载药物质的生物体内缓释实验及有效剂量等,还有待进一步进行研究。
