Fe/Ni比对Li1.2Fe0.2-xNi0.1+xMn0.5O2纳米颗粒电化学性能的影响
2021-10-07朱志红肖雨刚
朱志红,肖雨刚
(1.洛阳职业技术学院食品与药品学院,河南 洛阳 471000;2.兰州理工大学石油化工学院,甘肃 兰州 730050)
随着锂离子电池的快速发展,锂离子电池工业对电极材料比容量的要求也越来越高[1]。材料内Li的含量和放电时的电压决定了电池的容量和电压,因此正极材料的合理选择对锂电池的产品性能非常重要。传统的正极材料如层状结构的LiCoO2,理论容量为274 mAh·g-1(实际容量仅为140 mAh·g-1左右),橄榄石结构的LiFePO4的理论容量为170mAh·g-1,尖晶石结构的LiMn2O4的理论容量约为148mAh·g-1,均不能满足动力锂离子电池对能量密度(400Wh·kg-1)的要求[2]。所以,提升正极材料的能量密度一直是科研工作的重点。THACKERAY等人[3-5]提出了Co与Ni共掺杂的富锂固溶体xLi2MnO3·(1-x)LiMO2(0<x<1,M=Co和Ni),其中的Li1.2Ni0.13Co0.13Mn0.54O2凭借高比容量(>250 mAh·g-1)的优势[6-9],吸引了众多研究者的关注。但Co元素的使用大大增加了电池成本,因此合成低成本、高比容量的无钴富锂固溶体正极材料非常迫切。
富锂xLi2MnO3·(1-x)LiMO2(0<x<1,M=Fe和Ni)材料具有高比容量(约250mAh·g-1)、低成本和环境友好等优点[10-11],是理想的高比容量、低成本的富锂固溶体正极材料。TABUCHI等人[12]采用Fe掺杂Li2MnO3来减少阳离子混排,提高正极材料的循环稳定性。Ni2+具有2个电子电荷补偿机制,可显著提高可逆脱嵌Li+。Li+的半径(0.076nm)和Ni2+的半径(0.069nm)相近,可以减少过渡金属层中的Li+,减缓材料向尖晶石转化,采用Fe与Ni共掺杂[13],能兼顾Li2MnO3的循环稳定性和材料的可逆容量。元素的含量及比例的变化可以改变材料结构的晶胞常数[14-15],从而影响材料的电化学性能,同时纳米颗粒不仅能提高材料的导电性能和锂离子的扩散速率,还能增加材料活性物质的整体利用率,从而提升材料的倍率性能[16-17]。因此,我们尝试调控Fe与Ni含量,采用自蔓延燃烧来控制材料的颗粒粒径,从而达到改善材料的倍率与循环性能的目的。
本文采用自蔓延燃烧法,以二水合乙酸锂、九水合硝酸铁、六水合硝酸镍和四水合乙酸锰为原料,通过调控组分中x的数值(x分别取0、0.05、0.1),采用自蔓延燃烧合成了不同Fe/Ni比的前驱体,再经700℃煅烧5h,合成了富锂Li1.2Fe0.2-xNi0.1+xMn0.5O2纳米颗粒,通过XRD、SEM和恒流充放电测试等方法,研究不同的Fe/Ni比对材料性能的影响。
1 实验部分
1.1 Li1.2Fe0.2-xNi0.1+xMn0.5O2的制备
按摩尔 比Li∶Fe∶Ni∶Mn=1.2∶0.2∶0.1∶ 0.5,称取CH3COOLi·2H2O(99%,AR)、Fe(NO3)3·9H2O(98.5%,AR)、Ni(NO3)2·6H2O(98%,AR)和Mn(CH3COO)2·4H2O(99%,AR)置于蒸发皿中,再加入无水乙醇作溶剂,置于磁力搅拌器上80℃加热搅拌2h左右,使其蒸干备用。
将蒸干后的混合物置于马弗炉中,在200℃下利用混合物中的硝酸根与乙酸根的氧化还原作用,发生自蔓延燃烧,降至室温后得到蓬松的前驱体并用研钵研细。将研细的前驱体以5℃·min-1的升温速率升至700℃煅烧5h,降温后即可制得最终材料,将其记为LFNMO-2F1N。改变化学组成x分别为0.05和0.1,采用自蔓延燃烧得到Fe/Ni比分别为1∶1和1∶2的前驱体,再经700℃煅烧5h后,降至室温即获得最终目标材料,分别记为LFNMO-1F1N和LFNMO-1F2N,具体指标见表1。

表1 不同Fe/Ni比样品的化学组成Table 1 Chemical composition of samples with different Fe/Ni ratios
1.2 电池的装配
按质量比8∶1∶1,称取Li1.2Fe0.2Ni0.1Mn0.5O2纳米颗粒、Super P和LA132水性黏接剂,置于玛瑙研钵中,以无水乙醇作分散剂,混合研磨2h后,将研磨好的浆料均匀涂布于铝箔上,干燥后用圆形打孔器制成Φ12 mm的正极片。
以金属锂片为对电极,Cellgard-2400型聚丙烯膜为隔膜,1.0 mol·L-1的LiPF6(EC+EMC+DEC) 溶液(质量比1∶1∶1,电池级)为电解液,在氩气氛围保护下,在手套箱中装配成CR2032型扣式电池。
1.3 电化学性能测试
将装配好的扣式电池在CT2001A型电池测试系统上进行充放电性能测试,电压范围2.0~4.8V (vs.Li/Li+),在室温下恒流测试充放电性能及电化学循环性能。用CHI 604E电化学分析仪进行电池的电化学阻抗谱(EIS)测试。采用DH 7000电化学工作站对电池进行循环伏安(CV)测试,测试的电压范围为2.0~4.8 V,扫描速率0.1 mV·s-1。EIS测试的频率为0.01~105Hz,交流振幅为5 mV。
1.4 材料的结构与形貌表征
采用D/max-2400型X射线衍射仪对样品进行物相分析,CuKα,波长0.154 nm,管电压40 kV,管电流100 mA,步长为0.02°,扫描速率为10°·min-1。采用JSM-6700F扫描电子显微镜观察样品的表面形貌。
2 结果与讨论
2.1 材料的结构与形貌分析
图1为不同Fe/Ni比的样品的XRD谱图。从图中的衍射峰可以看出,不同Fe/Ni比的样品均为典型的α-NaFeO2层状结构(R3m空间群)[18],且在20°~22.5°范围内出现了Li2MnO3(C2/m空间群)的特征峰,主要与组分中的Li与Mn按1∶2的比例交替排列形成的一种超晶格有序排列有关[19]。从表2可知,样品的c/a值均大于4.899,表明合成的样品都有良好的层状结构[20],对比后发现,样品LFNMO-1F1N的c/a值最大,说明其具有更好的层状结构。根据Scherrer公式:D=Kl/(b cos q),计算得到LFNMO-2F1N、LFNMO-1F1N和LFNMO-1F2N的晶粒尺寸分别为20.36nm、10.96nm和8.93nm,说明随着Fe/Ni比增大,晶粒尺寸也随之增大,而晶胞体积略有减少,可能与Fe3+(0.055 nm)与Ni2+(0.069nm)的半径有关。带有*的衍射峰是单斜晶系Li2MnO3(C2/m空间群)特有的衍射峰,从图上可以明显看出随着Fe/Ni比的增大,材料的晶体结构从α-NaFeO2结构向单斜Li2MnO3结构过渡,原因可能是相比R3m型α-NaFeO2结构,当Fe与Ni离子出现在过渡金属层中时,会影响Li和Mn在ab面上的有序排列(正常值是1∶2),偏离了α-NaFeO2的a/b值,降低了材料的结构对称性,使其向单斜晶系转变[21]。

图1 样品的XRD图谱Fig.1 XRD patterns of the sample

表2 不同Fe/Ni比的样品的晶胞参数Table 2 Unit cell parameters of samples with different Fe/Ni ratios
图2是不同Fe/Ni比的样品的SEM及克体积图。从图2的(a)、(b)、(c)可以看出,所合成的材料由初级纳米颗粒组成,经煅烧后存在一些团聚颗粒。其中,样品LFNMO-1F2N团聚较为严重;样品LFNMO-1F1N的团聚最小且为均匀纳米颗粒。材料内存在的亚微米颗粒,可能会使其核心区的活性物质不能得到有效利用,同时Li+在颗粒内脱嵌的迁移路径变长,降低了材料的电化学性能[22]。图2(d)是1g的不同Fe/Ni比的样品在量筒内敦实后的图片,不同Fe/Ni比的样品在敦实后的体积,分别为2.7mL、3.1mL和2.6mL,其中样品LFNMO-1F1N的克体积最大(3.1mL·g-1),这与图2(b)的结果一致。

图2 样品的扫描电镜图片和克体积图Fig.2 Scanning electron microscope and gram volume diagram of the sample
图3(a)是样品LFNMO-1F1N在高倍率下的SEM图片,样品的形貌以类球形颗粒为主,颗粒间存在空隙,图3(b)是其对应的粒径分布图。经过统计计算,样品LFNMO-1F1N的粒径集中在38~62nm范围内,分布均匀且颗粒间存在少量空隙。分布均匀的纳米颗粒,可以缩短Li+在材料内的扩散路径,有利于电化学反应的快速发生,进而提升材料的电化学性能[23-24]。

图3 LFNMO-1F1N的高倍SEM图片和粒径分布图(a) high magnification SEM;(b) particle size distributionFig.3 High magnification SEM image and particle size distribution of sample LFNMO-1F1N
2.2 电化学性能分析
图4是不同样品在0.1C倍率、电压范围2.0~4.8V下的首次及第2次充放电曲线。在首次充电曲线中,每个样品都存在斜线区域和平台两个部分,在斜线部分即4.5V以下,主要是Fe3+/Fe4+与Ni2+/Ni4+的电极氧化过程[25],4.5V处的平台,与Li2MnO3组分中脱出的Li2O有关[26]。放电过程仅有斜线部分,未出现明显的放电平台。在第2次充放电过程中,4.5V处的充电电压平台消失,说明富锂锰基材料在首次充电过程中存在Li2MnO3组分的不可逆活化。从图4(a)、(b)可看出,样品LFNMO-1F1N具有较低的充电电压平台和较高的放电电压,意味着充放电平台间的电位差最小,即电池极化最小。
图5是3种样品的首次循环伏安曲线。氧化峰对应的是充电过程(脱锂),还原峰对应的是放电过程(嵌锂)。在阳极扫描过程中,样品LFNMO-1F1N的首个氧化峰约为4.15V,主要与Ni2+氧化为Ni4+、Fe3+氧化为Fe4+有关。在较高电势下出现的4.65 V氧化峰,是从Li2MnO3组分中脱出的Li2O的不可逆的电化学活化反应(Li2MnO3→MnO2+Li2O)。在阴极扫描过程中,3.8V左右的还原峰,与Ni4+还原为Ni2+、Fe4+还原化为Fe3+有关[27]。3.0V左右的还原峰,则是Mn4+还原为Mn3+(MnO2+Li++e-→LiMnO2)[28]。由于Li2MnO3在首次充电过程中的不可逆活化,所以未出现4.5V以上的还原峰。比较3种样品的首次循环曲线可知,当Fe/Ni比为1∶1时,材料的氧化还原峰比较明显,与图4(a)中的首次充放电曲线结果相吻合。

图4 不同样品在0.1C倍率下的充放电曲线Fig.4 The first and 2nd charge-discharge curves of different samples at 0.1C rate
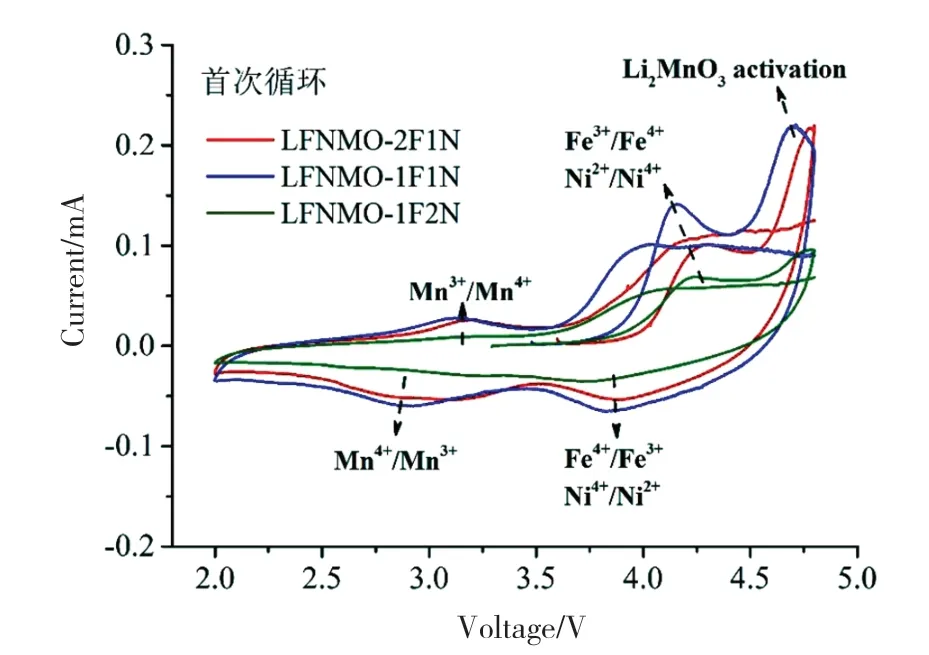
图5 不同样品的首次循环伏安曲线Fig.5 First cyclic voltammetry curves of different samples
图6是不同样品的充放电倍率性能。从图6可看出,相比其他样品,样品LFNMO-1F1N在各个倍率下的放电比容量都较高,倍率性能最好。样品LFNMO-1F1N在0.1C倍率下的首次放电容量可达258.9 mAh·g-1,远高于LFNMO-2F1N(191.6 mAh·g-1)和LFNMO-1F2N(155 mAh·g-1)。在0.2C、0.5C、1C和2C倍率下,样品LFNMO-1F1N的首次放电比容量分别 为218.6 mAh·g-1、183.4 mAh·g-1、158.8 mAh·g-1和138.4 mAh·g-1;经过2C倍率循环再回到0.1C时,放电容量仍有218.9 mAh·g-1,说明材料的可逆容量较高,表明层状结构较完整的纳米颗粒,可以减缓材料在充放电过程中的容量衰减与电压衰减[29-30]。
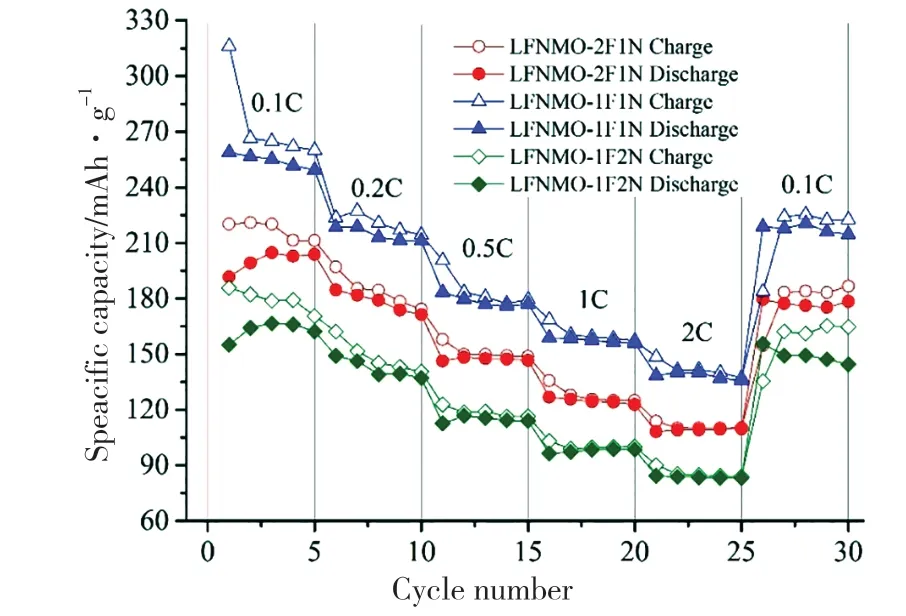
图6 不同样品的充放电倍率性能Fig.6 Charge-discharge rate performance diagram of different samples
图7是不同样品在1C倍率下的循环性能。从图7可明显看出,样品LFNMO-1F1N具有较高的放电容量,首次放电和循环后放电的比容量分别为156mAh·g-1和122.6mAh·g-1,容量保持率为78.6%。样品LFNMO-2F1N的放电容量仅次于样品LFNMO-1F1N,首次放电和循环后放电的比容量分别为151.8mAh·g-1和111.7mAh·g-1,容量保持率为73.7%。样品LFNMO-1F2N的放电容量最少,首次放电和循环后放电的比容量分别为110.8mAh·g-1和86.9mAh·g-1,容量保持率为78.4%。对比可知,样品LFNMO-1F1N具有较高的放电容量和循环性能,说明较完整的层状结构能减缓材料的不可逆相变;分布均匀的纳米颗粒可以缩短Li+在材料内的扩散路径,有利于快速发生电化学反应,从而提高材料的电化学性能。

图7 不同样品在1C倍率下的循环性能Fig.7 Cycle performance of different samples at 1C ratio
图8是不同Fe/Ni比样品的EIS谱,以及低频区的Z’与ω-1/2的关系图。从图8可看到,不同Fe/Ni比的样品的EIS谱,均是由高频区的半圆(其中高频区的半圆弧代表电荷转移电阻)和低频区的斜线(其斜率指Li+在电极内部扩散引起的Warburg阻抗Zw)构成的[31]。从图7(a)可知,样品LFNMO-2F1N、LFNMO-1F1N和LFNMO-1F2N的电荷转移电阻Rct,分别为105Ω、49Ω和161Ω,由此可知,样品LFNMO-1F1N的Rct最小,也就是Li+的脱嵌速率最大,说明其具有最佳的电化学性能。样品LFNMO-1F2N的Rct最大,与一些较大的亚微米颗粒有关,也与其起始放电容量最低相吻合。
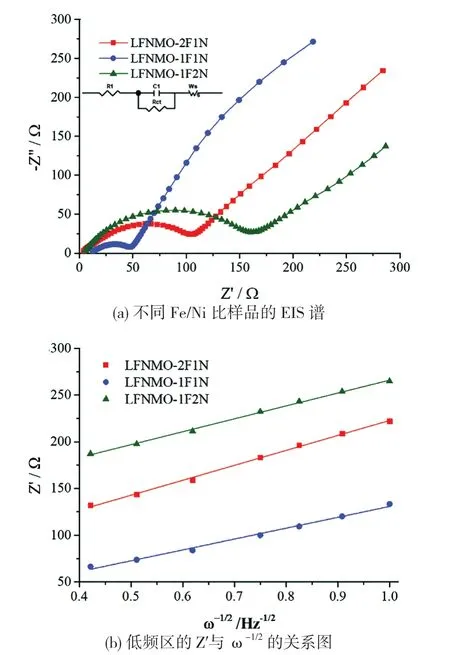
图8 不同Fe/Ni比样品的EIS谱和低频区的Z’与ω-1/2的关系图(a) EIS spectra of different Fe/Ni ratios samples;(b) The relationship between Z’ and ω-1/2 at low frequency regionFig.8 EIS spectra of different Fe/Ni ratios samples and the relationship between Z’ and ω-1/2 at low frequency region
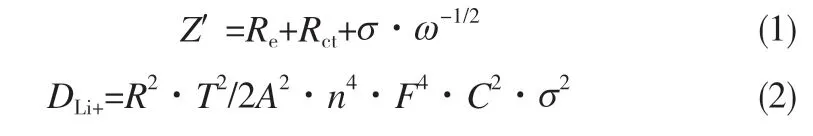
式中,Z′是实部阻抗,Ω;Re是电解液阻抗,Ω;ω是低频区的角频率,Hz;σ是Z′~ω-1/2线性关系的斜率;R是摩尔气体常数,8.314 J·mol-1·K-1;T是开尔文温度,298.15K;A是电极片的表面积,1.13cm2;n是参与反应的电子数目,n=1.2 mol;F是法拉第常数,96500 C·mol-1;C是锂离子的摩尔浓度,0.0496mol·cm-3[32]。
对Z’和ω-1/2进行拟合[图8(b)],再利用公式(2)求出Li+的扩散系数DLi+(表3)。对比不同电极材料的DLi+可知,样品LFNMO-1F1N具有最小的σ值(116.19 Ω·cm2·s-1/2)和最大的DLi+(4.028×10-16cm2·s-1),证明在低频交流阻抗测试条件下,当x=0.05(Fe/Ni比为1∶1)时,Li1.2Fe0.15Ni0.15Mn0.5O2正极材料拥有最佳的离子扩散特性。

表3 不同Fe/Ni比样品的EIS拟合参数Table 3 EIS fitting parameters of samples with different Fe/Ni ratios
3 结论
采用自蔓延燃烧法,经700℃高温煅烧,制备了富锂Li1.2Fe0.2-xNi0.1+xMn0.5O2纳米材料,并研究了不同的Fe/Ni比对材料性能的影响。XRD分析证实,Fe/Ni比为1∶1的样品LFNMO-1F1N具有典型的α-NaFeO2层状结构和更完整的层状程度,晶粒尺寸为10.96nm。SEM测试分析结果表明,LFNMO-1F1N为分布均匀的纳米颗粒,粒径集中在38~62nm范围内。恒电流测试结果表明,样品LFNMO-1F1N具有最大的首次放电比容量、最佳倍率与循环性能以及最小的电荷转移阻抗(49Ω)。在0.1C倍率下,样品LFNMO-1F1N的首次可逆比容量高达258.9 mAh·g-1,远高于LFNMO-2F1N(191.6 mAh·g-1)和LFNMO-1F2N(155 mAh·g-1)的可逆比容量;2C倍率下的放电容量为138.4 mAh·g-1;在1C倍率下进行100次充放电循环测试后,材料的放电容量仍有122.6mAh·g-1。LFNMO-1F1N具有低成本、高比容量和环境友好等优点,有望成为下一代锂离子电池极富竞争力的正极材料。
