急性肠梗阻肠坏死患儿A2B腺苷受体、紧密连接蛋白、肿瘤坏死因子-α表达及与肠上皮细胞凋亡的相关性分析
2021-09-29张雪峰张丽莉李明晖
张雪峰,张丽莉,李明晖
急性肠梗阻是因任何原因引起的部分或全部肠内容物通过障碍,是临床最常见的急腹症[1]。小儿肠梗阻临床表现为腹痛、呕吐、腹胀、肛门停止排便排气,严重影响患儿生长发育,严重者可并发肠坏死,升高病死率。研究显示,梗阻导致肠坏死的发生可能与肠道黏膜功能障碍造成肠道菌群环境改变有关,通过探讨相关机制可能为急性肠梗阻肠坏死的治疗带来新契机[2]。A2B腺苷受体(A2BAR)参与调节机体多种生理及病理过程,包括刺激内皮细胞生长、调节炎性因子释放、调节肠道氯离子分泌等[3]。紧密连接蛋白为紧密连接复合体重要组成蛋白,肿瘤坏死因子-α(TNF-α)为引起感染性休克和组织损伤的重要炎症介质,二者与急性肠梗阻肠坏死患儿细菌移位存在明显关系[4]。本研究通过分析65例急性肠梗阻肠坏死患儿的临床资料,探讨A2BAR、紧密连接蛋白、TNF-α在急性肠梗阻肠坏死患儿中的表达及与肠上皮细胞凋亡的相关性。
1 资料与方法
1.1一般资料 选取我院2015年4月—2020年2月行手术治疗的急性肠梗阻肠坏死患儿65例作为研究组。纳入标准:①符合急性肠梗阻肠坏死的诊断标准[5];②年龄2~14岁;③入组前未接受过相关治疗者;④临床资料完整。排除标准:①合并其他系统疾病者;②患有盆、腹腔巨大肿块者;③患有弥漫性腹膜炎伴肠梗阻者;④患有腹部疝或横膈疝者;⑤合并心脑血管或造血系统等严重疾病者。研究组中男34例,女31例;年龄2~14(5.31±2.43)岁;急性肠套叠23例,紫癜合并肠套叠15例,腹内疝13例,肠扭转6例,粘连性肠梗阻肠绞窄5例,嵌顿性腹股沟斜疝3例。另选择同期于我院行肠切除吻合术治疗的消化道畸形患儿30例作为对照组,入院前均未合并其他疾病,其中男16例、女14例,年龄2~11(5.26±2.35)岁。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2检测方法
1.2.1样本收集:收集65例术中切除的部分肠管作为研究标本,近端约0.5 cm×0.5 cm采用蛋白免疫印迹法处理,其余肠管相应处理后采用免疫组织化学染色法测定A2BAR、紧密连接蛋白。
1.2.2A2BAR、紧密连接蛋白检测:将术中标本切为4 μm薄片,脱蜡、水化、高压修复后滴加3%过氧化氢溶液,常温下灭活内源性酶,封闭,滴入A2BAR抗体3 μg/ml、紧密连接蛋白抗体(1∶300),4℃过夜后滴加二抗,DAB显色,常规脱水后封片待测。选用PBS液代替一抗为阴性对照,半定量分析切片(每张切片在400倍镜下随机选择3~4个视野),阳性表达呈棕黄色颗粒,检测阳性反应产物的灰度值。见图1。

图1 急性肠梗阻肠坏死患儿A2BAR、紧密连接蛋白免疫组织化学染色图(DAB显色,苏木素复染,×400)A.A2BAR,B.紧密连接蛋白,A2BAR为A2B腺苷受体
1.2.3TNF-α检测:所有患儿在入院时及术后1周抽取静脉血液3 ml,3000 r/min离心10 min后分离血清,采用酶联免疫吸附试验测定TNF-α浓度。
1.3肠上皮细胞凋亡指数(AI)检测 采用原位末端标记法检测AI。病理切片常规脱蜡入水,将切片放入新配制的3%过氧化氢溶液中10 min。蒸馏水洗涤3次,每次2 min。标本滴加新稀释的蛋白酶K中消化15 min,按TdT∶DIG-d-UTP∶标记缓冲液为1∶1∶18比例配制混合液,混匀。TBS液反复冲洗,DAB显色,苏木素轻度复染。最后TBS液冲洗,蒸馏水洗涤,脱水,透明,封片。光学显微镜观察,以400倍放大切片,棕黄色颗粒呈现于细胞核中提示细胞凋亡。每张切片按顺序选择5~10个视野,共计数1000个细胞,以TUNEL阳性细胞所占百分比计算AI,AI=阳性细胞数/细胞总数×100%。
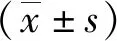
2 结果
2.1A2BAR、紧密连接蛋白及TNF-α表达 研究组A2BAR灰度值、紧密连接蛋白灰度值及AI低于对照组(P<0.05,P<0.01)。与对照组术前比较,研究组术前血清TNF-α水平显著升高(P<0.05);术后7 d,研究组血清TNF-α水平较术前显著降低(P<0.05),但与对照组比较差异无统计学意义(P>0.05)。见表1。

表1 手术治疗的急性肠梗阻肠坏死和消化道畸形患儿A2BAR灰度值、紧密连接蛋白灰度值、TNF-α、AI比较
2.2A2BAR灰度值、紧密连接蛋白灰度值、TNF-α与AI的相关性分析 A2BAR灰度值、紧密连接蛋白灰度值与AI呈正相关(P<0.01),TNF-α与AI呈负相关(P<0.01),见表2和图2。

表2 急性肠梗阻肠坏死患儿A2BAR灰度值、紧密连接蛋白灰度值、TNF-α与AI的相关性分析
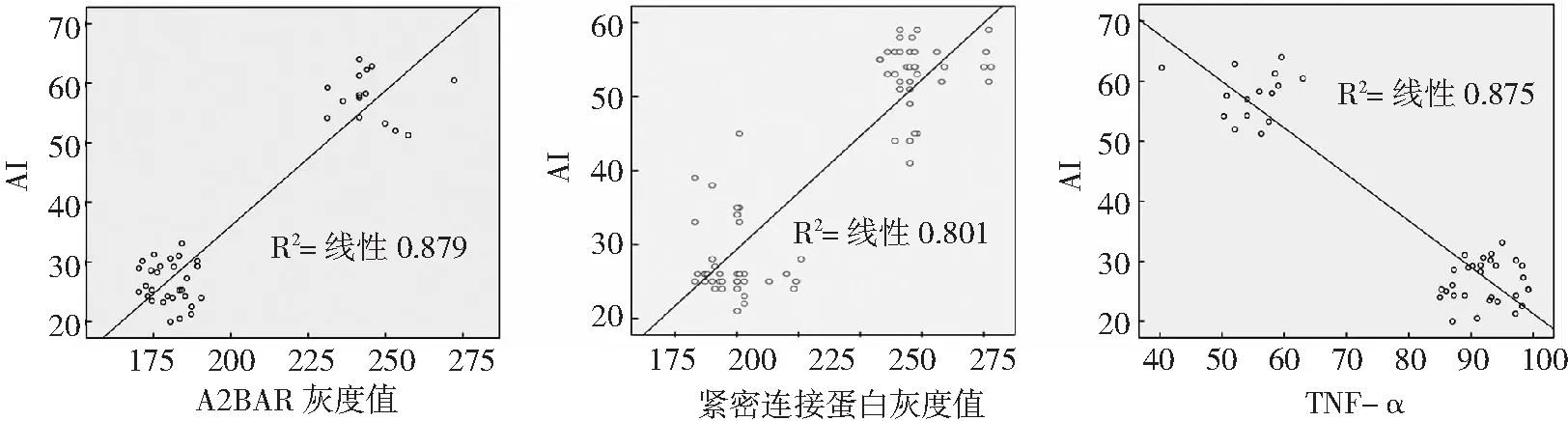
图2 急性肠梗阻肠坏死患儿A2BAR灰度值、紧密连接蛋白灰度值、TNF-α与AI的相关性分析散点图A2BAR为A2B腺苷受体,TNF-α为肿瘤坏死因子-α,AI为凋亡指数
3 讨论
既往研究指出,急性肠套叠、肠扭转及嵌顿疝是导致小儿急性肠梗阻肠坏死的主要原因[6],严重者可引发中毒性休克甚至全身炎症反应综合征、全身多器官衰竭等,危及患儿生命[7]。由于急性肠梗阻肠坏死病情变化快,需早期做出诊断并处理。
肠屏障是机体重要的屏障结构,对于稳定肠道内环境平衡和阻碍致病菌及毒素进入体内等具有重要作用[8]。目前已有研究表明,小儿急性肠梗阻发生时细菌或其产物穿过肠屏障进入其他器官[9]。但是,目前临床对于不同病理条件下肠屏障功能变化的作用机制仍存有争议[10]。有学者提出,肠黏膜损伤后可引发强烈的炎症反应,而炎性因子TNF-α等又会导致肠道内缺氧,进而对肠黏膜屏障功能产生影响[11]。本文研究组术前TNF-α水平显著升高,原因在于肠黏膜损伤激活体内丝裂原活化蛋白激酶活性,促进大量炎性因子释放,进而加重炎症反应。
A2BAR作为腺苷的一种亚型,与炎性因子分泌、血管松弛及肥大细胞增生均有着密切联系,现已成为国内外研究的焦点[12]。研究发现,急性血液阻滞和缺氧可诱导肠道内A2BAR表达升高,进而加速各种条件下受损黏膜自我修复过程[13-14]。此外,A2BAR还具有调节巨噬细胞功能、抑制促炎因子TNF-α分泌的作用[15]。本文镜下观察发现,研究组肠黏膜上皮细胞膜表面A2BAR表达更为显著,并且在肠黏膜上皮细胞的多个位置广泛表达;同时A2BAR灰度值低于对照组,表明急性肠梗阻肠坏死患儿肠管内A2BAR表达升高。
研究表示,紧密连接蛋白可形成紧密的封闭带,以维持细胞两端不同的形态或功能和细胞内外的水平衡,并可参与细胞间信号的传送调节[16]。本研究显示,急性肠梗阻肠坏死患儿肠管紧密连接蛋白灰度值明显降低,推测其参与了小儿急性肠梗阻肠坏死的病理生理过程[17]。进一步分析其可能作用机制:肠内血液循环受阻、缺氧时p-p38MAPK活化转录因子升高促进了促炎细胞因子的分泌,此类因子激活后可与相应的肠上皮细胞表面特异性死亡受体结合并活化,通过Caspase级联反应对肠黏膜细胞的程序性凋亡起到激活作用,从而达到减少肠黏膜相关细胞数量的效果[10,18]。
为进一步探讨A2BAR、紧密连接蛋白及TNF-α异常表达在急性肠梗阻肠坏死中的作用机制,本研究采用Pearson相关分析观察急性肠梗阻肠坏死患儿A2BAR、紧密连接蛋白及TNF-α与AI的关系,结果显示A2BAR灰度值、紧密连接蛋白灰度值与AI呈正相关,TNF-α与AI呈负相关。表明A2BAR、紧密连接蛋白及TNF-α与急性肠梗阻肠坏死患儿肠上皮细胞大量凋亡关系密切,提示临床可将三者作为治疗靶点,以保障患儿肠黏膜屏障功能的完整性作为临床治疗的新方向[19]。
综上,A2BAR、紧密连接蛋白及TNF-α在急性肠梗阻肠坏死患儿中异常表达,且与患儿肠上皮细胞大量凋亡关系密切,临床需重视患儿A2BAR、紧密连接蛋白及TNF-α水平监测,以改善其预后。
