固本抑瘤Ⅱ号抑制Hep-2荷瘤小鼠喉癌发生的机制研究
2021-09-29白云飞崔晓波王博谦王亚平杨莉娜刘佳荣
白云飞,崔晓波,王博谦,王亚平,杨莉娜,刘佳荣,覃 洁
喉癌起源于喉黏膜上皮,是头颈部主要恶性肿瘤,占所有恶性肿瘤的1%~5%[1],且病死率高[2]。目前,喉癌治疗方法以外科手术、放疗、化疗或联合治疗为主,但通常会发生较严重的不良反应,严重影响新患者的治疗和预后[3]。因此,迫切需要研发新的有效治疗药物。固本抑瘤Ⅱ号(GYⅡ)是由多名著名中医在经方基础上结合临床实践经验研制的具有益气、活血、解毒作用的综合方剂。多项临床试验已证实,GYⅡ具有良好的抗肿瘤作用,可有效缓解化疗的毒副作用,减轻化疗引起的气虚血瘀证状[4-5]。但目前尚无GYⅡ在喉癌中应用的报道。近年来ERK和Akt信号通路已被确定为肿瘤治疗的潜在靶点,最新研究表明,在小鼠乳腺癌模型中,GYⅡ可通过抑制ERK和Akt信号通路激活,抑制肿瘤的生长和转移[6-7]。因此,本研究构建Hep-2荷瘤小鼠,探究GYⅡ的抗肿瘤作用,以及其是否通过作用于ERK和Akt信号通路而发挥生物学功能的。
1 材料与方法
1.1实验动物 6周龄雌性裸鼠,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0006。在22℃、湿度55%、12 h/12 h明暗光照循环条件下饲养。
1.2主要试剂
1.2.1GYⅡ制备方法:GYⅡ由北京中医院提供,由党参、茯苓、苍术、黄芪、川芎、白术等13味中药组成,按照《中国药典(2010)》规程和《药品生产质量管理规范》生产,经石油醚脱脂,水提醇沉和去蛋白程序获得。临用前,用0.9%氯化钠注射液溶解至0.05和0.10 mg/ml[8]。
1.2.2检测试剂:RPMI 1640培养液、胎牛血清(FBS)和双抗购自Gibco公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海锐赛生物技术有限公司;蛋白免疫印迹使用的一抗anti-β-actin(1︰1000)购自Santa Cruz公司,anti-ERK1/2(1︰500)、anti-ERK1/2(1︰1000)、Akt(1︰1000)和p-Akt(1︰500)均购自CST公司;小鼠肿瘤组织解离液购自美天旎生物技术公司;TUNEL凋亡检测试剂盒及4%多聚甲醛固定液购自上海碧云天生物技术有限公司。
1.2.3实验仪器:流式细胞仪(FACS Calibur,BD公司),轮转式切片机(HistoCore MULTICUT,徕卡公司),CO2培养箱(4111,Thermo公司),数显游标卡尺(0~150 mm,Mitutoyo公司),全自动组织处理器(gentleMACS,美天旎生物技术公司),显微镜(BX51,奥林巴斯株式会社)。
1.3研究方法
1.3.1Hep-2细胞培养:Hep-2细胞系从中国典型培养物保藏中心购买,并于本实验室传代、保存。用含10% FBS的RPMI 1640培养基培养,培养条件为37℃、5% CO2,当细胞汇集率达90%时传代。
1.3.2Hep-2荷瘤小鼠模型的构建:将对数生长期Hep-2细胞制成无血清细胞悬液,接种于裸鼠背部,每只接种100 μl,含有2×106细胞,待瘤体直径约50 mm3时,采用随机数字表法将模型小鼠分为模型组、GYⅡ 2.5 g/kg组和GYⅡ 5.0 g/kg组,每组5只,GYⅡ不同剂量组灌胃法给药,每日1次,持续30 d,模型组替换为生理盐水。每3天测量肿瘤体积1次。肿瘤体积=1/2×a(长径)×b(短径)2[7]。
1.3.3肿瘤单细胞悬液制备:实验终点,剪开小鼠背部皮肤,钝性分离取出肿瘤,将肿瘤置于预冷的RPMI 1640培养液中。配制小鼠肿瘤解离液,按照Gentle MACS肿瘤解离器使用说明解离肿瘤,经70 μm细胞筛过滤获得单细胞悬液。
1.3.4Annexin-V和PI流式细胞凋亡检测:上述获得的细胞悬液用PBS液洗涤2次,收集细胞加入200 μl Binding Buffer、10 μl Annexin V-FITC和5 μl PI后混合,避光条件下孵育30 min,缓慢加入PBS液400 μl,防止剧烈操作导致细胞破裂,随后立即用流式细胞仪进行检测。
1.3.5TUNEL凋亡染色:使用TUNEL凋亡检测试剂盒检测肿瘤组织中凋亡细胞数量,肿瘤组织经冰冻切片,切片厚10 μm,浸入4%多聚甲醛15 min后,PBS液充分清洗3次,每次15 min。后行TUNEL染色,主要步骤:按照使用说明配制TUNEL反应液;取反应液50 μl加至预处理好的切片组织正中,室温静置孵育1 h;DAB染色,置于光镜下,随时观察以控制染色时间;苏木精复染,时间2~3 min,染色完成后蒸馏水冲洗,梯度乙醇脱水,二甲苯透明组织,封片。凋亡细胞计数方法:置于OLYMPUS普通光学显微镜下,随机选取5个视野,通过划“正”字法计数TUNEL阳性细胞,5个视野细胞数量求和作为总数,最终统计数量以总数/5±标准差表示。
1.3.6Western blot法测定ERK和Akt蛋白磷酸化表达:研钵预冷状态下加入瘤组织,快速研磨成粉末状后立即加入同等适量RIPA裂解液,充分混匀提取总蛋白并采用BCA法定量,将等量蛋白提取液(蛋白量约45 μg)用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离;40 V电压下转膜1 h至聚偏二氟乙烯(PVDF)膜上;将PVDF在4.5%脱脂牛奶缓冲液中室温封闭1 h;清洗后按比例加入相应一抗,4℃静置过夜;TBST缓冲液清洗3次,每次15 min;加入对应二抗,注意二抗需与显色方式相对应,然后室温孵育1 h;显影并拍摄,Image J软件分析条带灰度值。
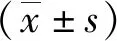
2 结果
2.1肿瘤生长情况 模型组小鼠瘤体持续生长,至处理第30天,瘤体达(1387±232)mm3;GYⅡ灌胃给药第12天,肿瘤体积逐渐小于模型组,至第30天,GYⅡ 2.5 g/kg组肿瘤体积为(765±152)mm3,GYⅡ 5.0 g/kg组肿瘤体积为(440±98)mm3。见图1。至实验终点,GYⅡ 2.5 g/kg组和GYⅡ 5.0 g/kg组肿瘤体积均小于模型组,GYⅡ 5.0 g/kg组肿瘤体积小于GYⅡ 2.5 g/kg组,差异有统计学意义(P<0.01)。见图2。
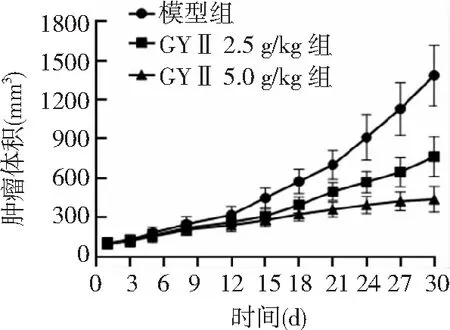
图1 Hep-2荷瘤小鼠肿瘤生长曲线GYⅡ为固本抑瘤Ⅱ号
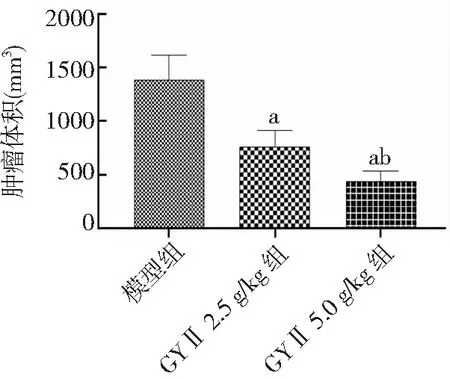
图2 实验终点各组Hep-2荷瘤小鼠肿瘤体积比较GYⅡ为固本抑瘤Ⅱ号;与模型组比较,aP<0.01;与GYⅡ 2.5 g/kg组比较,bP<0.01
2.2肿瘤细胞凋亡情况 模型组肿瘤细胞凋亡率为(6.2±1.2)%,GYⅡ 2.5 g/kg组肿瘤细胞凋亡率为(15.8±4.3)%,GYⅡ 5.0 g/kg组肿瘤细胞凋亡率为(36.5±5.2)%。GYⅡ 2.5 g/kg组和GYⅡ 5.0 g/kg组肿瘤细胞凋亡率均高于模型组,GYⅡ 5.0 g/kg组高于GYⅡ 2.5 g/kg组,差异有统计学意义(P<0.01)。见图3、4。TUNEL凋亡染色结果所示,模型组TUNEL阳性细胞数量为(23±4)个,GYⅡ 2.5 g/kg组为(68±15)个,GYⅡ 5.0 g/kg组为(147±36)个。GYⅡ 2.5 g/kg组和GYⅡ 5.0 g/kg组肿瘤凋亡细胞数量均高于模型组,GYⅡ 5.0 g/kg组高于GYⅡ 2.5 g/kg组,差异有统计学意义(P<0.01)。见图5、图6。
图3 流式细胞术检测各组Hep-2荷瘤小鼠肿瘤细胞凋亡率GYⅡ为固本抑瘤Ⅱ号

图4 各组Hep-2荷瘤小鼠细胞凋亡率比较GYⅡ为固本抑瘤Ⅱ号;与模型组比较,aP<0.01;与GYⅡ 2.5 g/kg组比较,bP<0.01
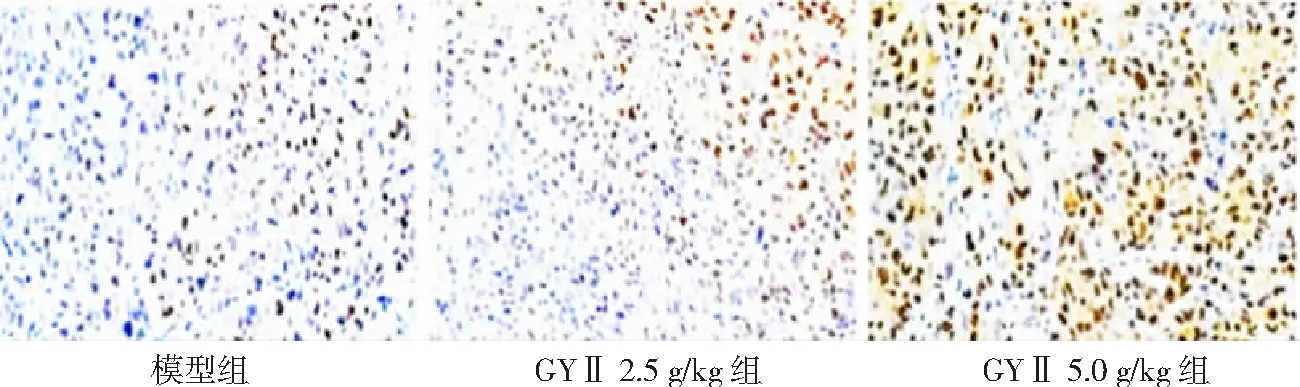
图5 各组Hep-2荷瘤小鼠TUNEL凋亡染色图片(100×)GYⅡ为固本抑瘤Ⅱ号
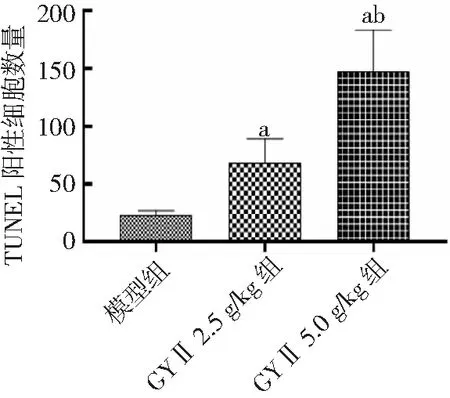
图6 各组Hep-2荷瘤小鼠TUNEL阳性细胞数量比较GYⅡ为固本抑瘤Ⅱ号;与模型组比较,aP<0.01;与GYⅡ 2.5 g/kg组比较,bP<0.01
2.3GYⅡ对ERK和Akt信号通路的影响 GYⅡ 2.5 g/kg组和GYⅡ 5.0 g/kg组肿瘤组织中p-ERK和p-Akt蛋白表达量较模型组低,且GYⅡ 5.0 g/kg组低于GYⅡ 2.5 g/kg组,差异有统计学意义(P<0.01)。见图7、图8。
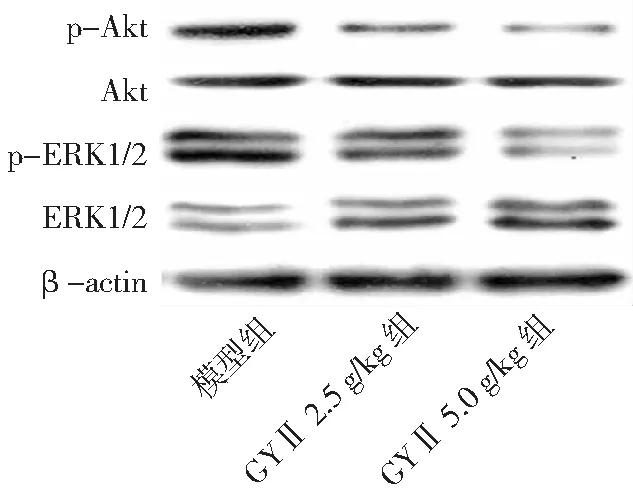
图7 各组Hep-2荷瘤小鼠ERK和Akt相关蛋白表达情况GYⅡ为固本抑瘤Ⅱ号
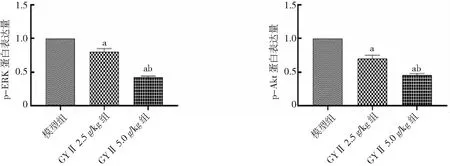
图8 各组Hep-2荷瘤小鼠p-ERK和p-Akt蛋白表达量GYⅡ为固本抑瘤Ⅱ号;与模型组比较,aP<0.01;与GYⅡ 2.5 g/kg组比较,bP<0.01
3 讨论
喉癌是头颈部第二常见恶性肿瘤[2],传统治疗方法均可导致不同程度的不良反应,如免疫抑制、营养代谢紊乱等[9-14]。因此,研发新的有效的喉癌治疗药物势在必行。中药已有数千年的实践历史,目前已被广泛应用于肝癌、乳腺癌、非小细胞肺癌、胰腺癌等多种癌症的治疗[15-16],具有抗药性低、毒副作用小等优点[17-22]。GYⅡ是根据益气、活血化瘀、解毒散结理论研制的由13种不同中草药组成的综合方剂[7],可与化疗和放疗协同作用提高癌症的治疗效果,延长患者生存期,改善患者预后[4]。在Lewis肺癌移植瘤小鼠中,GYⅡ可诱导细胞凋亡从而抑制肿瘤生长[23]。最新研究发现,在小鼠乳腺癌模型中,GYⅡ可抑制肿瘤生长和转移,作用机制与抑制ERK和Akt信号通路有关[7]。但目前关于GYⅡ在喉癌中治疗效果的报告较少。本研究证实,在Hep-2荷瘤模型鼠中,不同剂量GYⅡ处理均能够抑制肿瘤细胞生长,肿瘤体积显著小于模型组,且能加速肿瘤细胞凋亡。
Akt和ERK信号通路在癌症患者体内异常激活,既往一直是癌症治疗的靶点。Akt信号通路参与肿瘤细胞生长、增殖、存活、迁移和侵袭的调节;ERK信号通路是重要的促有丝分裂信号通路[6,24]。Akt和ERK信号通路能够抑制肿瘤细胞凋亡,相反通过基因敲除技术或靶向药物抑制Akt和ERK信号通路活性则可抑制肿瘤进展。在下咽部鳞状细胞癌患者中,GDC-0980处理能够明显降低FaDu细胞中Akt和ERK磷酸化水平,将癌细胞阻滞于G1期,抑制肿瘤细胞增殖[25]。TBX1因子失活可降低甲状腺癌细胞PI3K/Akt和MAPK/ERK信号通路活性,延缓疾病进展[26]。但目前关于GYⅡ对喉癌细胞Akt和ERK信号通路影响的研究较少。本研究结果显示,在Hep-2荷瘤小鼠中,GYⅡ可显著降低ERK和Akt蛋白磷酸化水平,抑制ERK和Akt信号通路活性,加速肿瘤细胞凋亡,抑制肿瘤细胞增殖,且与GYⅡ剂量呈正相关。但是,肿瘤进展涉及到多种信号通路,并且ERK和Akt信号通路除了具有抗凋亡、促增殖作用外,还具有调节血管生成等作用,因此GYⅡ对喉癌的抑制作用还有待更深入的研究[27-28]。
综上,在Hep-2异种移植模型小鼠中,GYⅡ通过抑制ERK和Akt信号通路活性,促进肿瘤细胞凋亡,抑制肿瘤细胞增殖,GYⅡ有望成为喉癌患者有效的辅助治疗方剂。本研究进一步拓展了GYⅡ治疗的肿瘤类型,为其临床应用奠定了基础。
