circ_0001946靶向miR-1270/Cyclin T2轴调控胃癌细胞恶性表型的分子机制研究
2021-09-29赵亚男刘为平霍晓辉范红云
王 竞,赵亚男,文 欢,刘为平,霍晓辉,范红云
据GLOBOCAN最新统计数据显示,2018年胃癌新发病例约103.3万例,死亡病例约78.3万例,其发病率在所有恶性肿瘤中位居第5,病死率位居第3[1]。中国是胃癌高发国家,且存在明显的地区差异。胃癌发病隐匿,易误诊,多数患者预后较差[2]。目前胃癌发病机制尚未明了,且缺乏有效的治疗方法。环状RNA(circRNA)和微小RNA(miR)是2类非编码RNA,且circRNA可作为竞争性内源性RNA与miR靶向结合,调控miR靶基因表达,进而影响细胞增殖和凋亡等生命活动,参与肿瘤发展过程[3]。研究显示,circ_0001946在结直肠癌组织中表达升高,沉默其表达可通过靶向miR-135a-5p/上皮间质转化(EMT)轴抑制癌细胞生长、迁移和侵袭能力,其可能是结直肠癌治疗的分子靶点[4]。胶质母细胞瘤细胞中circ_0001946表达较低,circ_0001946过表达通过靶向miR-671-5p/CDR1轴降低体外胶质母细胞瘤细胞的增殖、迁移和侵袭能力,增加细胞凋亡,并抑制体内异种移植瘤生长,提示其在胶质母细胞瘤中起抑癌作用[5]。Starbase靶基因在线软件预测显示,circ_0001946可能与miR-1270存在靶向调控关系,细胞周期蛋白T2(Cyclin T2)可能是miR-1270的靶基因。研究显示,miR-1270在卵巢癌[6]、肺腺癌[7]、多形胶质母细胞瘤[8]和骨肉瘤[9]等肿瘤中表达降低,上调miR-1270表达可抑制肿瘤细胞恶性表型,进而抑制肿瘤发展。有报道称,靶向抑制Cyclin T2表达可削弱胃癌细胞的增殖、迁移和侵袭能力,并阻碍细胞周期进程,诱导细胞凋亡,其可作为促癌基因参与胃癌的发展进程[10]。本研究检测了胃癌组织和细胞系中circ_0001946与miR-1270的表达,并以miR-1270/Cyclin T2轴为切入点,探究circ_0001946对胃癌细胞增殖、凋亡和侵袭的影响及可能作用机制。
1 材料与方法
1.1组织、细胞和试剂 45例胃癌组织及癌旁组织取自2017年6月—2019年12月在本院确诊并行手术治疗的胃癌患者,其中男25例、女20例,年龄(58.63±8.49)岁。正常胃黏膜上皮细胞GES-1及胃癌细胞系(HGC-27、AGS、MKN45),由中国科学院上海细胞库提供;RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒,购自宝生物工程(大连)有限公司;RPMI 1640培养液、BCA蛋白检测试剂盒和双荧光素酶活性检测试剂盒,购自北京索莱宝科技有限公司;胎牛血清,购自浙江天杭生物科技股份有限公司;LipofectamineTM2000试剂盒,购自美国Invitrogen公司;PCR引物、circ_0001946小干扰RNA(si-circ_0001946)、小干扰RNA阴性对照(si-NC)、miR-1270抑制剂(anti-miR-1270)及阴性序列(anti-miR-NC)、miR-1270模拟物(mimics)及对照序列(miR-NC),购自生工生物工程(上海)股份有限公司。
1.2研究方法
1.2.1qRT-PCR法检测circ_0001946和miR-1270表达:将组织样本在液氮保护下充分研磨,用RNA抽提试剂提取组织总RNA,并逆转录为cDNA,行PCR扩增。扩增程序:95℃ 5 min,95℃ 10 s,60℃ 30 s,72℃ 30 s,共35个循环。引物序列见表1。用2-ΔΔCt法计算circ_0001946相对于内参GAPDH、miR-1270、U6的表达水平。

表1 引物序列
1.2.2细胞培养:复苏正常胃黏膜上皮细胞GES-1及胃癌细胞系(HGC-27、AGS、MKN45),均用含10%胎牛血清的RPMI 1640培养液于普通培养箱中培养。将各对数生长期细胞接种至6孔板中(1.0×105个/孔),培养24 h后收集细胞,qRT-PCR法检测细胞中circ_0001946和miR-1270表达,方法同“1.2.1”,选择circ_0001946和miR-1270表达较GES-1细胞差异最显著的胃癌细胞HGC-27进行后续实验。
1.2.3细胞转染:将对数生长期HGC-27细胞接种至6孔板中(1.0×105个/孔),培养4 h后弃培养液。用LipofectamineTM2000脂质体法,分别转染si-NC(si-NC组)、si-circ_0001946(si-circ_0001946组)、miR-NC(miR-NC组)、miR-1270 mimics(miR-1270组)、共转染si-circ_0001946与anti-miR-NC(si-circ_0001946+anti-miR-NC组)、共转染si-circ_0001946与anti-miR-1270(si-circ_0001946+anti-miR-1270组)。转染12 h后,换为新鲜培养液再培养24 h,qRT-PCR法检测细胞中circ_0001946或miR-1270表达验证转染效果,方法同“1.2.1”,并收集细胞备用。同时设置对照组(Control组),细胞常规培养,不进行转染操作。
1.2.4CCK-8法检测细胞增殖情况:将转染后的各组细胞接种至96孔板中(2.5×104个/孔),分别培养24、48和72 h后加CCK-8 10 μl孵育2 h,用酶标仪于450 nm波长处测光密度(OD)值。
1.2.5克隆形成实验:将转染后各组细胞接种至6孔板中(1.0×104个/孔),每2天换新鲜培养液1次。培养14 d后弃培养液,经多聚甲醛固定、结晶紫染色后,显微镜下统计超过50个细胞的克隆数。
1.2.6Transwell法检测细胞侵袭情况:将转染后的各组细胞密度调至5.0×104个/ml。Transwell小室置于24孔板中,铺Matrigel基质胶,自然晾干。在上室中加细胞悬液100 μl,下室加培养液500 μl。培养48 h后弃培养液,多聚甲醛固定、结晶紫染色,显微镜下随机取5个视野记数细胞侵袭情况。
1.2.7双荧光素酶报告基因实验:由生工生物工程(上海)股份有限公司根据Starbase靶基因在线软件预测的miR-1270与circ_0001946或Cyclin T2结合位点,分别设计并合成circ_0001946、Cyclin T2的野生型荧光素酶载体(WT-circ_0001946、WT-Cyclin T2)及突变型荧光素酶载体(MUT-circ_0001946、MUT-Cyclin T2)。将HGC-27细胞接种至6孔板中(1.0×105个/孔),用LipofectamineTM2000脂质体法,分别共转染miR-1270 mimics与WT-circ_0001946或WT-Cyclin T2、miR-NC与WT-circ_0001946或WT-Cyclin T2、miR-1270 mimics与MUT-circ_0001946或MUT-Cyclin T2、miR-NC与MUT-circ_0001946或MUT-Cyclin T2。转染12 h后,换新鲜培养液再培养24 h,收集各组细胞并裂解。3500 r/min离心5 min后取上清,检测荧光素酶活性。
1.2.8蛋白免疫印迹法检测Cyclin T2蛋白表达:将转染后的各组细胞接种至6孔板中(1.0×105个/孔),培养48 h后用RIPA试剂提取细胞中总蛋白。经BCA定量、电泳、转膜和封闭后,分别用Cyclin T2(1︰500)和GAPDH(1︰1000)一抗4℃孵育过夜。洗膜后,用山羊抗兔二抗(1︰1000)37℃孵育2 h。显影液避光显影,凝胶系统拍照,Image J软件分析Cyclin T2对于GAPDH表达量。
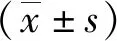
2 结果
2.1胃癌组织中circ_0001946与miR-1270表达及相关性 胃癌组织中circ_0001946表达高于癌旁组织(2.65±0.18 vs 1.00±0.06),而miR-1270表达低于癌旁组织(0.26±0.06 vs 1.00±0.05),差异有统计学意义(P<0.05)。Pearson相关性分析显示,胃癌组织中circ_0001946与miR-1270表达呈负相关(r=-0.752,P<0.05)。见图1。

图1 胃癌组织中circ_0001946与miR-1270表达及相关性A.胃癌组织中circ_0001946和miR-1270的表达水平,与癌旁组织比较,aP<0.05;B.胃癌组织中circ_0001946与miR-1270表达的相关性
2.2胃癌细胞系中circ_0001946与miR-1270表达情况 胃癌细胞系(HGC-27、AGS、MKN45)中circ_0001946表达高于正常胃黏膜上皮细胞GES-1(2.81±0.17、1.43±0.08、2.08±0.15 vs 1.00±0.01),而miR-1270表达低于GES-1细胞(0.29±0.07、0.79±0.09、0.52±0.09 vs 1.00±0.00),差异有统计学意义(P<0.05)。见图2。

图2 胃癌细胞系中circ_0001946与miR-1270的表达与GES-1细胞比较,aP<0.05
2.3circ_0001946过表达对胃癌HGC-27细胞增殖、凋亡和侵袭能力的影响 si-circ_0001946组胃癌HGC-27细胞中circ_0001946表达量低于Contorl组和si-NC组(P<0.05),表明敲减circ_0001946的HGC-27细胞构建成功,见图3。si-circ_0001946组HGC-27细胞OD值、克隆形成数和侵袭数低于Contorl组和si-NC组,凋亡率高于Contorl组和si-NC组,差异有统计学意义(P<0.05);Contorl组与si-NC组各检测指标比较差异无统计学意义(P>0.05)。见图4~7及表1。
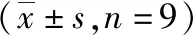
表1 敲减circ_0001946对胃癌HGC-27细胞克隆、凋亡和侵袭能力的影响
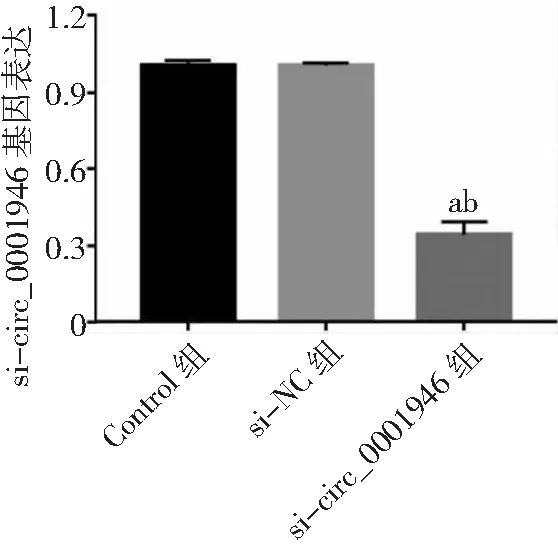
图3 胃癌HGC-27细胞si-circ_0001946转染效果与Control组比较,aP<0.05;与si-NC组比较,bP<0.05
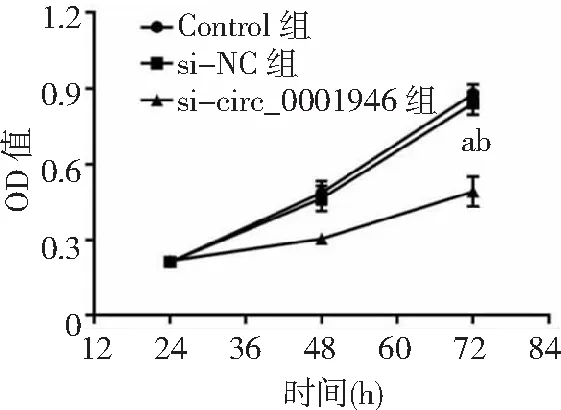
图4 敲减circ_0001946对胃癌HGC-27细胞OD值的影响OD为光密度;与Control组比较,aP<0.05;与si-NC组比较,bP<0.05
2.4miR-1270过表达对胃癌HGC-27细胞增殖、凋亡和侵袭能力的影响 miR-1270组胃癌HGC-27细胞中miR-1270表达量高于Control组和miR-NC组(P<0.05),表明miR-1270过表达的HGC-27细胞构建成功,见图8。miR-1270组HGC-27细胞OD值、克隆形成数和侵袭数低于Control组和miR-NC组(P<0.05),凋亡率高于Control组和miR-NC组(P<0.05),而Control组与miR-NC组各检测指标比较无统计学意义(P>0.05)。见图9~12及表2。
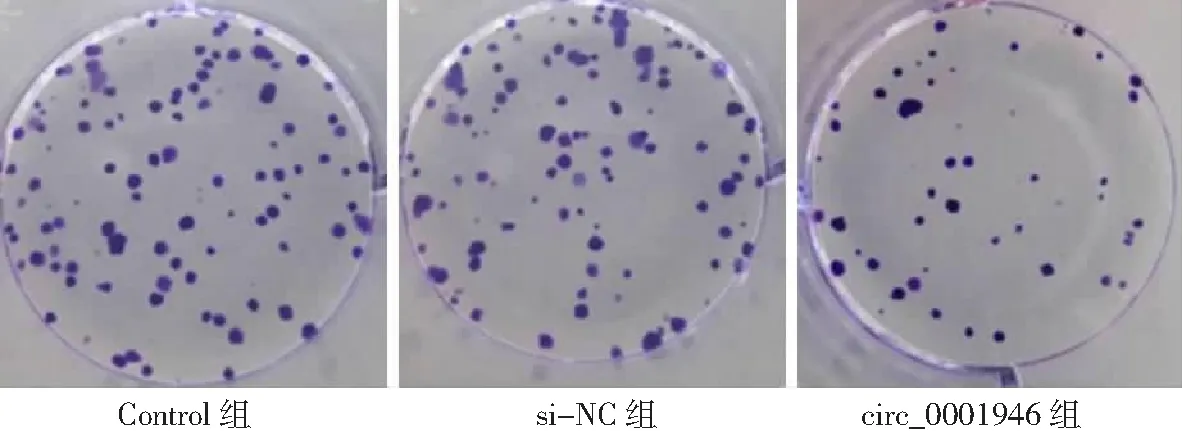
图5 敲减circ_0001946对胃癌HGC-27细胞克隆形成数的影响(×10)
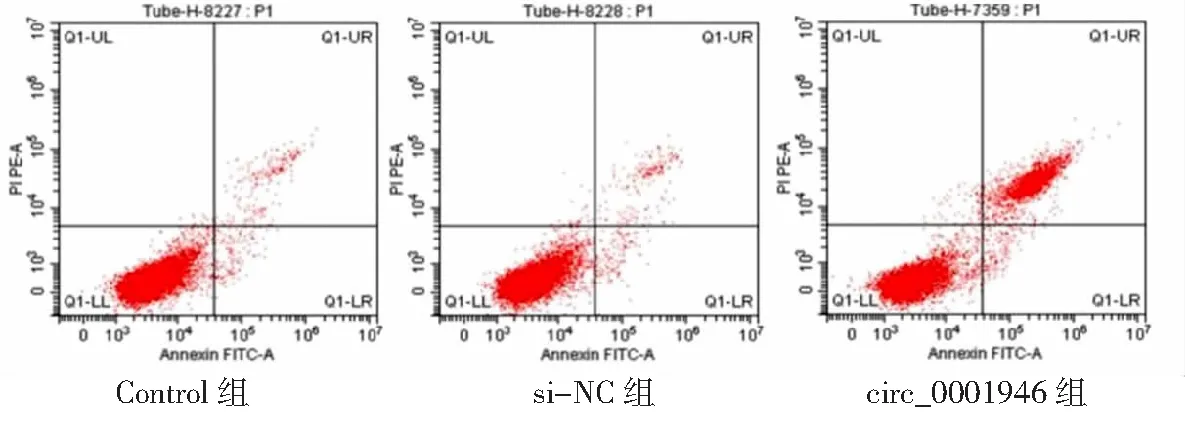
图6 敲减circ_0001946对胃癌HGC-27细胞凋亡的影响
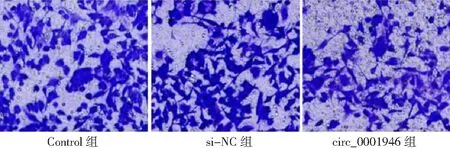
图7 敲减circ_0001946对胃癌HGC-27细胞侵袭的影响(×100)

图8 胃癌HGC-27细胞miR-1270 mimics转染效果与Control组比较,aP<0.05;与miR-NC组比较,bP<0.05
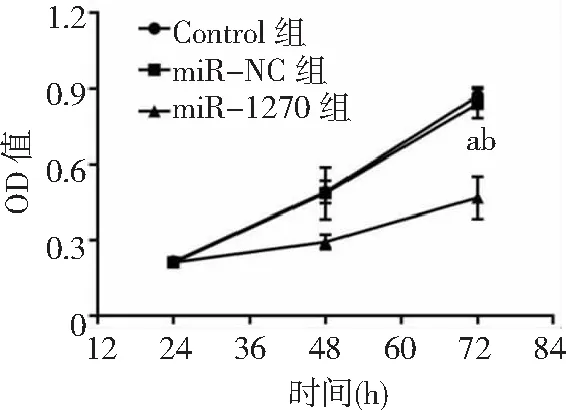
图9 miR-1270过表达对胃癌HGC-27细胞OD值的影响OD为光密度;与Control组比较,aP<0.05;与miR-NC组比较,bP<0.05
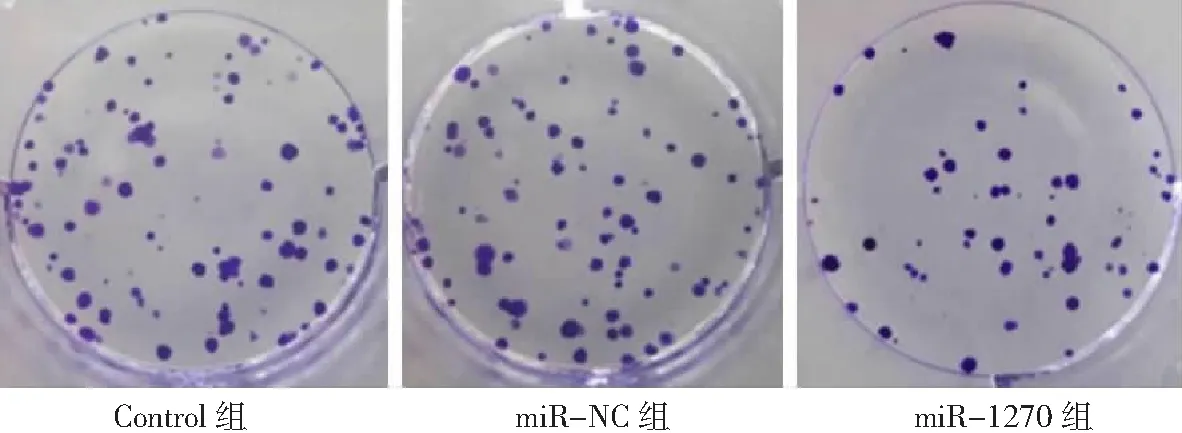
图10 miR-1270过表达对胃癌HGC-27细胞克隆形成数的影响(×10)

图11 miR-1270过表达对胃癌HGC-27细胞凋亡的影响

图12 miR-1270过表达对胃癌HGC-27细胞侵袭的影响(×100)
表2 miR-1270过表达对胃癌HGC-27细胞克隆、凋亡和侵袭能力的影响
2.5敲减miR-1270抑制敲减circ_0001946对胃癌细胞的影响 si-circ_0001946+anti-miR-1270组胃癌HGC-27细胞miR-1270表达量低于si-circ_0001946+anti-miR-NC组(P<0.05),细胞OD值、克隆形成数和侵袭数高于si-circ_0001946+anti-miR-NC组(P<0.05),凋亡率低于si-circ_0001946+anti-miR-NC组(P<0.05),而si-circ_0001946组与si-circ_0001946+anti-miR-NC组各指标无差异(P>0.05)。见图13~17及表3。
表3 敲减miR-1270抑制敲减circ_0001946对胃癌细胞克隆、凋亡和侵袭能力的影响

图13 胃癌HGC-27细胞anti-miR-1270转染效果与si-NC组比较,aP<0.05;与si-circ_0001946+anti-miR-NC组比较,bP<0.05
2.6circ_0001946对miR-1270/Cyclin T2的影响 双荧光素酶报告基因实验结果显示,miR-1270与WT-circ_0001946或WT-Cyclin T2共转染后的胃癌HGC-27细胞荧光素酶活性显著降低(P<0.05),而与MUT-circ_0001946或MUT-Cyclin T2共转染后的胃癌HGC-27细胞荧光素酶活性无显著变化(P>0.05)。见图18。si-circ_0001946组胃癌HGC-27细胞中miR-1270表达高于Control组和si-NC组(P<0.05),而Cyclin T2蛋白表达低于Control组和si-NC组(P<0.05)。miR-1270组胃癌HGC-27细胞中Cyclin T2蛋白表达低于Control组和miR-NC组(P<0.05),而si-circ_0001946+anti-miR-1270组HGC-27细胞中Cyclin T2蛋白表达高于si-circ_0001946+anti-miR-NC组(P<0.05)。见图19、20。

图14 敲减miR-1270抑制敲减circ_0001946对胃癌HGC-27细胞OD值的影响OD为光密度;与si-NC组比较,aP<0.05;与si-circ_0001946+anti-miR-NC组比较,bP<0.05
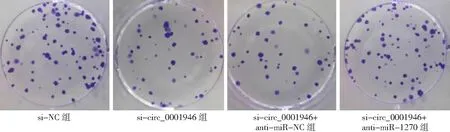
图15 敲减miR-1270抑制敲减circ_0001946对胃癌HGC-27细胞克隆形成数的影响(×10)
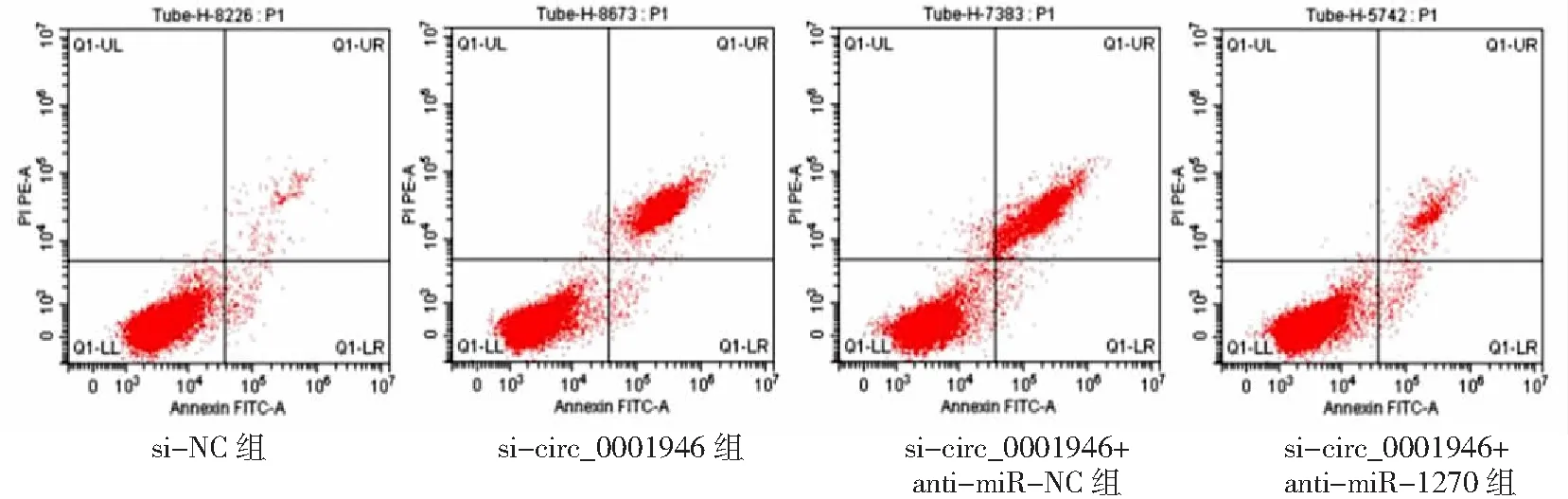
图16 敲减miR-1270抑制敲减circ_0001946对胃癌HGC-27细胞凋亡的影响

图17 敲减miR-1270抑制敲减circ_0001946对胃癌HGC-27细胞侵袭的影响(×100)

图18 双荧光素酶报告基因实验结果与miR-NC组比较,aP<0.05
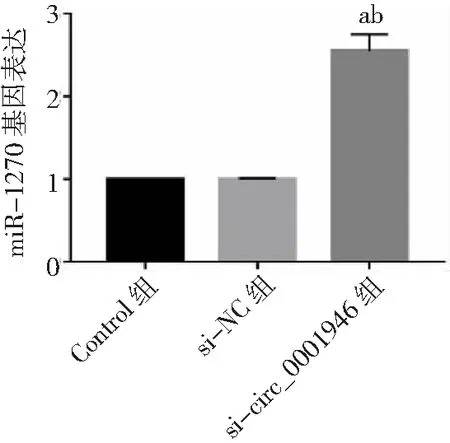
图19 敲减circ_0001946对胃癌HGC-27细胞miR-1270表达的影响与Control组比较,aP<0.05;与si-NC组比较,bP<0.05
3 讨论
胃癌的发生发展与多种因素有关[11-12],其中原癌基因的激活与抑癌基因的失活在胃癌的发生发展中起重要作用[13]。circRNA呈闭合环状结构,具有较高的稳定性和保守性,在真核生物中广泛存在。近年来,随着高通量测序技术的发展,发现肿瘤中存在大量异常表达的circRNA,这些异常表达的circRNA参与调控肿瘤细胞的恶性表型,进而影响肿瘤的发生发展。
已有研究表明,circ_0032627[14]、circ-ZNF609[15]、circ-CCDC66[16]等多种circRNA在胃癌中表达升高,促进了胃癌的发展进程。作为一种circRNA,circ_0001946参与了多种肿瘤的发展进程。有报道称,circ_0001946在肺腺癌组织和细胞系中均过表达,敲减其表达可通过靶向miR-135a-5p/SIRT1轴抑制癌细胞生长,提示其可能是治疗肺腺癌的潜在生物学标志物[17]。本研究首先采用qRT-PCR技术检测了胃癌组织及细胞系中circ_0001946的表达情况,结果显示,circ_0001946在胃癌组织及细胞系中表达升高,提示其可能促进了胃癌的发展进程;通过干扰胃癌细胞中circ_0001946的表达,发现干扰circ_0001946能够显著削弱胃癌细胞的增殖和侵袭能力,并促进胃癌细胞凋亡,提示circ_0001946也有可能成为胃癌治疗的分子靶点。


图20 circ_0001946靶向miR-1270调控胃癌HGC-27细胞中Cyclin T2蛋白基因表达情况A为Control组,B为si-NC组,C为si-circ_0001946组,D为miR-NC组,E为miR-1270组,F为si-circ_0001946+anti-miR-NC组,G为si-circ_0001946+anti-miR-1270组;与Control组比较,aP<0.05;与si-NC组比较,bP<0.05;与miR-NC组比较,cP<0.05;与si-circ_0001946+anti-miR-NC组比较,dP<0.05
为探究敲减circ_0001946抑制胃癌细胞恶性表型的分子机制,本研究利用双荧光素酶报告基因实验证实了circ_0001946可竞争性结合miR-1270,同时敲减circ_0001946可促进胃癌细胞中miR-1270的表达,这与本文胃癌组织中circ_0001946与miR-1270表达呈负相关的结果相一致。miR-1270参与多种肿瘤的发展进程,且在不同肿瘤中发挥的作用不同。有报道称,circ_0001247在宫颈癌中表达升高,其通过竞争性结合miR-1270上调ZEB2表达,进而促进宫颈癌细胞的增殖和转移,减少癌细胞凋亡[18];circ_103809在肝癌细胞中高表达,干扰circ_103809可通过靶向miR-1270/PLAGL2轴抑制肝癌细胞增殖、迁移、侵袭能力及EMT过程[19]。miR-1270在甲状腺乳头状癌细胞系和肿瘤组织中表达上调,可促进癌细胞增殖和迁移[20]。本研究结果显示,miR-1270在胃癌组织及细胞系中表达降低, miR-1270过表达可有效阻碍胃癌细胞增殖和侵袭,并加剧胃癌细胞凋亡,说明miR-1270在胃癌的发展中起抑制作用。本研究结果还显示,敲减miR-1270可抑制敲减circ_0001946对胃癌细胞增殖、凋亡及侵袭能力的影响,提示circ_0001946可能通过靶向结合miR-1270影响胃癌细胞的恶性表型。
Cyclin T2是细胞周期调控蛋白,其可与CDK9结合形成异二聚体后活化转录延长促进因子P-TEFb,进而调控细胞周期,影响细胞增殖。研究显示,胃癌组织中miR-142-3p表达降低,上调其表达可通过靶向抑制Cyclin T2的表达降低胃癌细胞的增殖、侵袭和迁移能力[21]。本研究证实了Cyclin T2是miR-1270的靶基因,且敲减circ_0001946或miR-1270过表达可降低胃癌细胞中Cyclin T2的表达,且敲减miR-1270可降低敲减circ_0001946对胃癌细胞Cyclin T2表达的抑制作用,进一步提示circ_0001946可通过靶向结合miR-1270进而调控Cyclin T2的表达。
综上,circ_0001946在胃癌组织和细胞系中表达升高,敲减其表达可有效阻碍胃癌细胞增殖和侵袭,并促进胃癌细胞凋亡,其可能通过竞争性结合miR-1270并调控Cyclin T2来影响胃癌细胞的恶性表型,有可能成为胃癌治疗的分子靶点。
