黄粉虫蛋白对小鼠脑和肝Nrf2、HO-1、GCLC、NQO1基因表达的影响
2021-09-28刘永华王秀君许文元付运星
刘永华,王秀君,阎 峰,许文元,付运星*
(1.漯河立蓓生物科技有限公司,河南 漯河 462300;2.河南牧业经济学院;3.郑州市农业行政综合执法支队)
1 材料与方法
1.1 试验试剂
试验饲料黄粉虫蛋白饲料购自郑州立蓓有限公司;D-半乳糖购自天津市凯通化学试剂有限公司;反转录试剂盒及Trizol试剂均购自赛默飞世尔科技(中国)有限公司;SuperReal荧光定量预混试剂购自天根生化科技有限公司。
1.2 试验动物
75只30日龄的昆明小鼠。饲养环境:室温(22±2)℃,湿度50%±10%,光照明暗各12 h,每日早8点晚6点投食换水,确保小鼠可以自由摄食和饮水,垫料每周更换两次,保持卫生状态,防止因卫生状况出现疾病。
1.3 试验分组
为防止小鼠出现应激,在适应性喂养小鼠3 d后,将75只昆明小鼠分为A、B、C、D、E五组。其中A组为对照组,B组为模型组,C、D、E组为试验组,具体试验方法见表1试验小鼠的饲喂方案。分组后进行造模即每日对试验组和模型组小鼠进行皮下注射浓度为0.15 g/ml的D-半乳糖溶液(生理盐水溶解)0.05 ml,在造模一周时间后观察小鼠无应激反应则加大D-半乳糖溶液注射量,由最初的每天每只0.05 ml每周递加0.02 ml注射量,连续8周。

表1 试验小鼠的饲喂方案
1.4 试验设备与器材
试验中使用到的设备与器材见表2。
表2 试验中使用到的设备
1.5 荧光定量聚合酶链式反应(qPCR)检测方法
造模给药后,取各组小鼠的脑、肝组织,提取脑、肝组织中的总RNA,反转录合成cDNA,试剂盒扩增,qPCR法检测小鼠肝脏组织中Nrf2、HO-1、GCLC和NQO1的mRNA相对表达水平,GAPDH为内参。具体引物序列见表3。
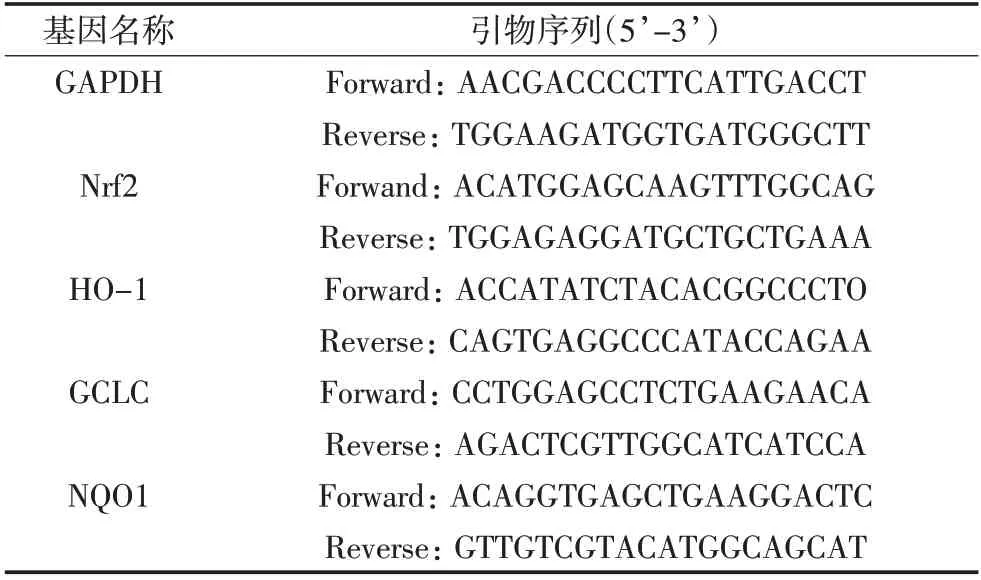
表3 检测基因所用引物序列
1.5.1 Trizol法提取RNA
Trizol是一种总RNA抽提试剂,含有异硫氰酸胍等物质,能够迅速破碎细胞,抑制细胞释放出核酸酶。
①剪取1 mg冰冻组织放入1.5 ml离心管并加入300 ul Trizol试剂静置1h。
②使用研磨棒将组织研碎后加入100 ul氯仿和500 ul Trizol试剂后摇匀并静置5 min后放入离心机离心,以彻底分离核蛋白复合体。离心机设定条件为12,000×g,15 minutes,4℃。
③吸取离心后的上清液400 ul加入1.5 ml离心管中后再加入400 ul异丙醇摇匀后放入离心机离心设定条件为12,000×g,15 minutes,4℃。注意全程转移样品时应使用无RNA酶试验器材。
④除去上清液留下离心管底部沉淀,加入1 000 ul浓度为75%乙醇(无RNA酶水配置)后放入冰箱-20℃保存。
1.5.2 RNA反转录合成cDNA
①存有RNA的离心管离心(12,000×g,5 minutes,4℃)后除去上清液并静置5 min使酒精挥发,再向其中加入无RNA酶水20~100 ul(视沉淀数量酌情添加),吹打混合均匀,要求一样品一个枪头,防止样品污染。
②根据表格4配制反应体系以除去样品中的基因组DNA(gDNA)污染,混合均匀37℃孵育2 min,为预混样1。

表4 预混样1反应体系
③根据表5配制反应体系以进行RNA反转录,为预混样2。之后将预混样1和预混样2进行混合。吹打混匀后进行水浴加热。要求42℃加热1 h接着80℃加热10 min,-20℃保存。

表5 预混样2反应体系
1.5.3 荧光定量PCR步骤
①配制反应液20 ul规格加入八联管中,离心后放入ABI 7500 PCR仪器检测。配制所需溶液如表6。

表6 检测反应体系
②ABI 7500 PCR仪器程序的设定,如表7。
表7 仪器程序的设定
2 结果与分析
2.1 黄粉虫蛋白对小鼠脑组织相关基因表达的影响
黄粉虫蛋白对小鼠脑组织相关基因表达的影响结果见图1,在检测了各组小鼠脑组织中Nrf2、HO-1、GCLC和NQO1基因的mRNA表达水平后结果显示,与正常组比较,模型组小鼠Nrf2、HO-1、GCLC和NQO1的mRNA表达明显下调(P<0.05或P<0.01)。与模型组比较,除黄粉虫蛋白低剂量组Nrf2、HO-1和黄粉虫蛋白中剂量组HO-1 mRNA表达水平无统计学意义外,其余黄粉虫蛋白低、中、高剂量组Nrf2、HO-1、GCLC和NQO1的表达均上调(P<0.05或P<0.01)。
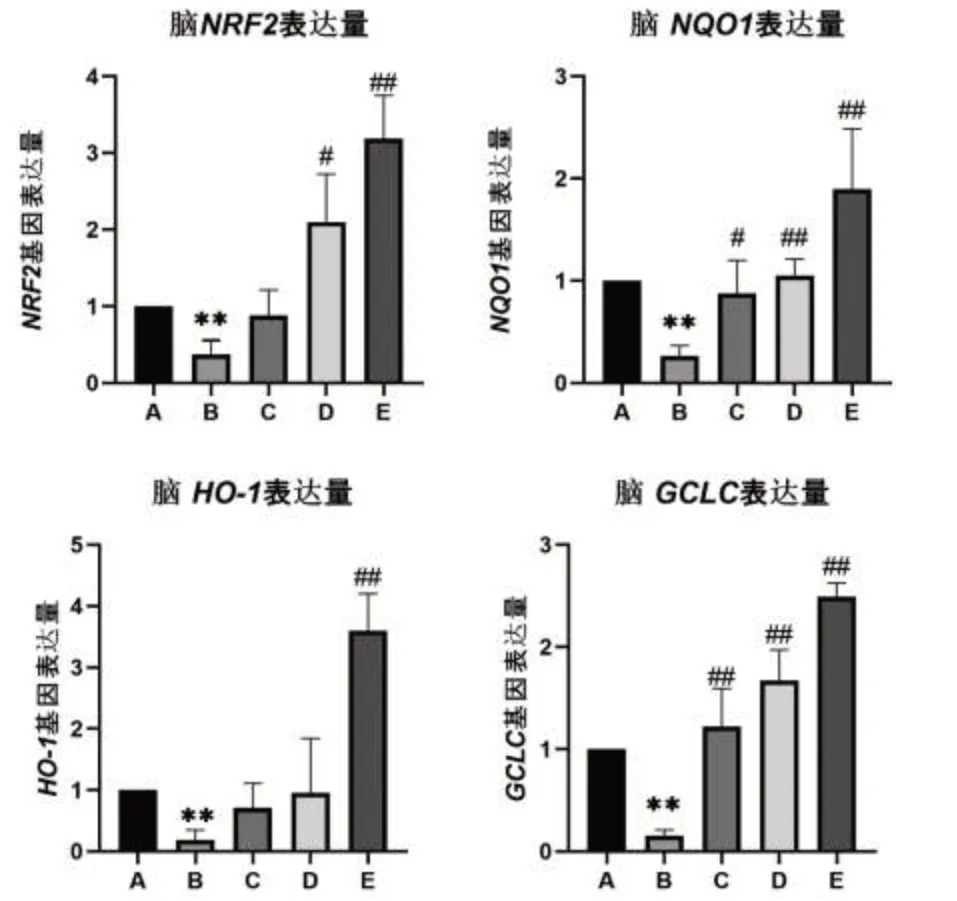
图1 小鼠脑组织Nrf2、HO-1、GCLC、NQO1基因表达量
2.2 黄粉虫蛋白对小鼠肝组织相关基因表达的影响
黄粉虫蛋白对小鼠肝组织相关基因表达的影响结果见图2,在检测了各组小鼠肝组织中Nrf2、HO-1、GCLC和NQO1基因的mRNA表达水平后结果显示,与正常组比较,模型组小鼠Nrf2、HO-1、Gclc和NQO1的mRNA表达明显下调(P<0.05或P<0.01)。与模型组比较,除黄粉虫蛋白低剂量组HO-1、Nrf2、NQO1表达水平无统计学意义外,其余黄粉虫蛋白低、中、高剂量组Nrf2、HO-1、Gclc和NQO1的表达均上调(P<0.05或P<0.01)。
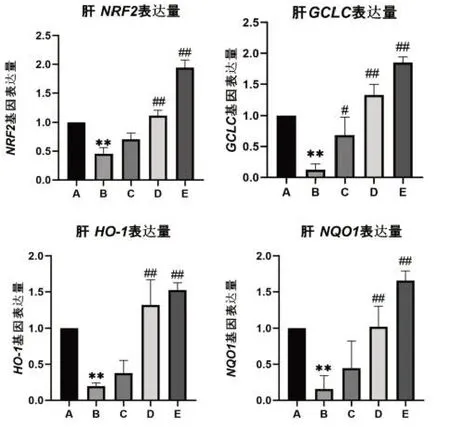
图2 小鼠肝组织Nrf2、HO-1、GCLC、NQO1基因表达量
3 讨论
氧化应激指机体内活性氧(reactive oxygen species,ROS)与抗氧化成分平衡发生崩坏后而引起的一系列适应性反应。ROS是在正常的生理过程中产生的,如果在无外界刺激源的条件下,机体内ROS的产生和消除是处于一种动态平衡的状态下的。但是如果机体内的ROS含量相对升高而机体无法及时将其清除,这就会使得机体组织中的过氧化水平明显升高引发一系列反应后导致机体受到损害。肝、脑的氧化应激是其发生损伤、发展为疾病的重要机制之一,因此,抑制氧化应激就成为防止肝脑损伤、疾病发生的一个有效途径。
在对抗氧化的研究中,人们普遍认为最为重要的内源性抗氧化通路之一就是Nrf2-ARE信号通路。其中Nrf2是调节氧化应激反应的重要转录因子,其靶基因编码的蛋白具有抗氧化、解毒和抗炎等广泛的细胞保护作用。而ARE是一种能编码启动子区域的多种解毒酶和细胞保护蛋白基因的增强子序列。正常生理状态下,Nrf2通过与ECH联合蛋白1(Keap1)特异性结合于细胞质中,此时Nrf2的活性受到抑制,Nrf2蛋白是处于低水平的,这是因为Keap1是一个Nrf2的E3泛素连接酶底物接头,可导致蛋白酶体的快速降解。更重要的是,Keap1是含有高活性的半胱氨酸,一旦被活性氧(ROS)或其他亲电试剂刺激时,就会阻止对Nrf2进行蛋白酶体降解,从而导致Nrf2蛋白在氧化应激下迅速积累,激活后的Nrf2进入细胞核,并与小肌肉腱膜纤维肉瘤癌基因同源物(s MAF)蛋白结合形成二聚体,并与顺式作用元件ARE相结合,启动下游抗氧化保护性基因和Ⅱ相解毒酶基因的转录,包括血红素氧化酶(HO-1)、NAD(P)H醌氧化还原酶(NQO1)、谷氨酸半胱氨酸连接酶(GCL)等。这些抗氧化物质能够保护机体和细胞免受ROS及一些毒性物质(如致癌物、药物活性代谢产物等)的侵害。
在对试验数据及试验结果进行处理分析后,从图1中的四组柱状图里组A对照组和组B模型组的基因表达量对比中可以得出结论:GAL诱导小鼠成功建立衰老模型。并且,在与模型组的对照中可见Nrf2、HO-1低浓度黄粉虫蛋白组和HO-1中浓度黄粉虫蛋白组表达量水平无明显差异。由此结合四组柱状图及结果可得出:低浓度黄粉虫蛋白组对于脑Nrf2、HO-1、NQO1基因表达无明显积极影响,对GCLC基因表达却有明显的积极影响,中浓度黄粉虫蛋白组对脑HO-1基因表达无明显积极影响,对脑Nrf2、NQO1、GCLC基因表达却有着较为明显的积极影响。高浓度黄粉虫蛋白组则对脑Nrf2、HO-1、NQO1、GCLC基因表达均有着明显的积极作用,其基因表达量均较大幅上调。
同理,在对试验数据及试验结果进行处理分析后,从图2中的四组柱状图里组A对照组和组B模型组的基因表达量对比中可以得出结论:GAL诱导小鼠成功建立衰老模型。并且,在与模型组的对照中可见Nrf2、HO-1低浓度黄粉虫蛋白组和HO-1中浓度黄粉虫蛋白组表达量水平无明显差异。由此结合四组柱状图及结果可得出:低浓度黄粉虫蛋白组对于脑Nrf2、HO-1、NQO1基因表达无明显积极影响,对GCLC基因表达却有明显的积极影响,中浓度黄粉虫蛋白组和高浓度黄粉虫蛋白组则对脑Nrf2、HO-1、NQO1、GCLC基因表达均有着明显的积极作用,其基因表达量均较大幅上调。
4 结论
该试验结果说明,一定浓度的黄粉虫蛋白或许能提高Nrf2、HO-1、NQO1及GCLC基因表达量,从而缓解、抑制氧化应激反应,提示黄粉虫蛋白可能是通过激活Nrf2-ARE信号通路来缓解D-半乳糖诱导的衰老模型小鼠的肝、脑衰老受损,可能为临床黄粉虫蛋白应用于缓解慢性肝脑损伤提供理论依据。□
