支架辅助栓塞未破裂颅内动脉瘤术后颅内微缺血危险因素
2021-09-27贾耀辉
贾耀辉,吕 超
(1.三二○一医院神经外科,陕西 汉中 723000;2.空军军医大学第一附属医院神经外科,陕西 西安 710032)
颅内动脉瘤栓塞后继发颅内微缺血(intracranial micro-ischemia, IMI)临床常见[1-2],发生率约10%~77%[1-3]。既往研究[4-6]发现,支架辅助栓塞(stent-assisted embolization, SAE)与IMI相关,而高血压、糖尿病、血小板抑制不足、动脉瘤宽颈形态等亦被认为是IMI的危险因素[6-7]。MR弥散加权成像(diffusion weighted imaging, DWI)是诊断IMI的敏感方法[3-4]。本研究分析SAE治疗未破裂颅内动脉瘤后发生IMI的危险因素。
1 资料与方法
1.1 一般资料 回顾性分析2016年1月—2020年1月空军军医大学第一附属医院收治的236例未破裂颅内动脉瘤患者。纳入标准:①DSA确诊未破裂颅内动脉瘤;②接受SAE治疗;③术前血小板抑制率达标;④术前及术后3天内接受头部MR平扫+DWI。排除标准:①脑血管畸形或烟雾病相关动脉瘤;②支架内血栓或动脉瘤破裂;③联合应用替罗非班等抗血小板治疗。
1.2 仪器与方法
1.2.1 术前准备 术前口服阿司匹林肠溶片(100 mg)+硫酸氢氯吡格雷片(75 mg)进行抗血小板准备,待血栓弹力图提示花生四烯酸(arachidonic acid, AA)或二磷酸腺苷(adenosine diphosphate, ADP)通道抑制率之一≥75%(达标)时方可实施治疗。
1.2.2 介入操作 采用Siemens Artist Zeego DSA机为引导设备。穿刺股动脉后予5 000 IU肝素,术中每小时追加1 000 IU肝素,持续监测活化凝血时间并保持≥300 s。以5F Cordis导管行全脑血管造影,明确动脉瘤基本情况。而后采用6F Envoy指引导管建立通路,将支架微导管送入动脉瘤远端载瘤动脉,妥善固定后将栓塞微导管头端送入动脉瘤腔内,实施栓塞并释放支架后完成治疗。
1.3 术后MR检查 于术后3天内以Siemens Avanto 1.5T MR仪采集头部DWI,参数:层厚8 mm,TR/TE 9 000 ms/137 ms,间距1.5 mm,矩阵230 mm×230 mm,b值为0、900 s/m2;将直径≤15 mm的高信号病变判定为IMI[8]。
1.4 观察指标 以AA及ADP通道抑制率均≥75%为血小板抑制良好,仅单通道抑制率≥75%为血小板抑制不足。对比IMI与非IMI患者的基线资料、动脉瘤特征、术中及术后相关指标。观察术后支架贴壁程度和微弹簧圈襻疝出瘤囊情况,并由2名从事神经介入治疗5年以上的医师根据Raymond分级标准[9]共同判断动脉瘤栓塞程度。
1.5 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布的计量资料,采用t检验进行比较;以百分数(%)表示计数资料,采用χ2检验或Fisher精确概率法进行比较。以多因素Logistic回归分析评价IMI的独立危险因素。P<0.05为差异有统计学意义。
2 结果
236例未破裂颅内动脉瘤患者,经SAE治疗后,97例(97/236,41.10%)发生IMI(IMI组,图1),139例未发生IMI(非IMI组);两组间合并糖尿病、缺血性卒中病史、血小板抑制不足、前交通动脉瘤、伴瘤内附壁血栓、支架贴壁不良及微弹簧圈襻疝出瘤囊差异均有统计学意义(P均<0.05),见表1~3。多因素Logistic回归分析结果显示,血小板抑制不足、前交通动脉瘤、伴瘤内附壁血栓、支架贴壁不良及微弹簧圈襻疝出瘤囊是IMI独立危险因素(P均<0.05),见表4。
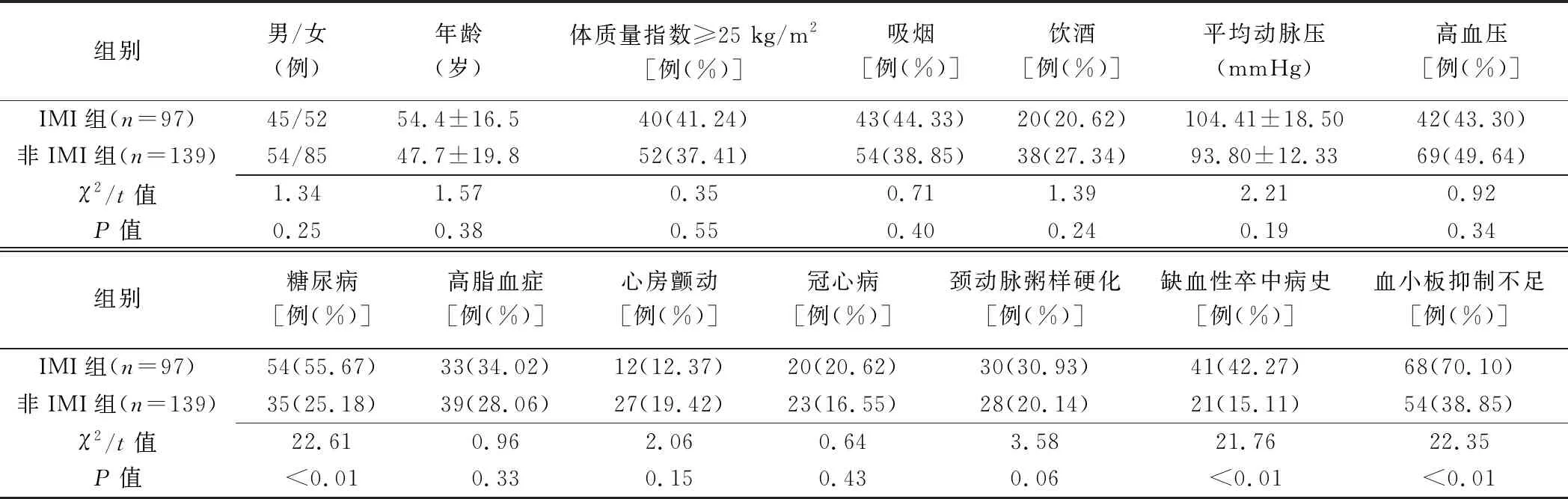
表1 SAE治疗未破裂颅内动脉瘤后IMI与非IMI患者术前基线资料比较
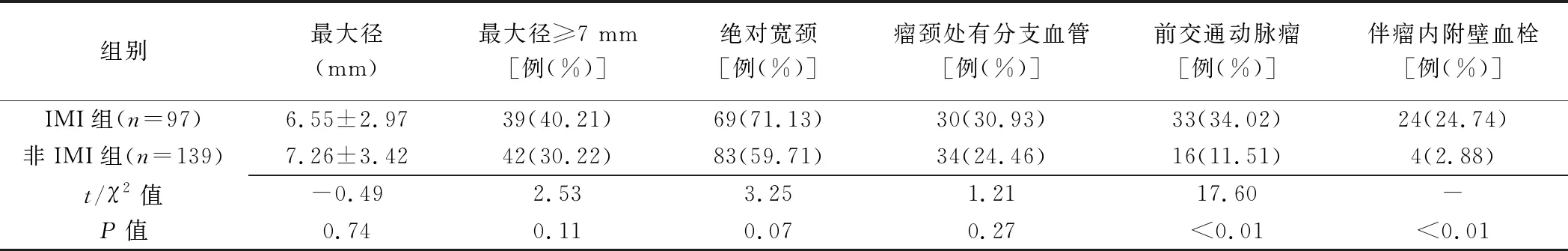
表2 SAE治疗未破裂颅内动脉瘤后IMI与非IMI患者颅内动脉瘤特征比较

表3 SAE治疗未破裂颅内动脉瘤后IMI与非IMI患者术中及术后相关指标比较

表4 多因素Logistic回归分析IMI危险因素

图1 患者女,45岁,SAE治疗未破裂前交通动脉瘤后继发IMI MR DWI连续断层图像示右侧额顶叶新发点状高信号
3 讨论
既往文献[1-3]报道,SAE治疗未破裂颅内动脉瘤栓塞后IMI发生率为10%~77%,本组为41.10%。明确SAE后IMI发生危险因素对于改善预后意义重大,但目前对于IMI发生危险因素的报道不一。PARK等[1]观察271例未破裂颅内动脉瘤患者,发现年龄、糖尿病、既往缺血性脑卒中、脑白质液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列呈高信号、多发动脉瘤及植入Enterprise支架是发生IMI的危险因素。IOSIF等[3]报道,复杂栓塞动脉瘤(植入T或Y形支架)后,影像学IMI检出率高达75%。HAHNEMANN等[6]发现,相比单纯栓塞,SAE更易导致无症状IMI;樵凡原等[10]亦认为植入支架与发生IMI相关。本研究单因素及多因素Logistic回归分析结果提示,血小板抑制不足、前交通动脉瘤、伴瘤内附壁血栓、支架贴壁不良及微弹簧圈襻疝出瘤囊是SAE治疗未破裂颅内动脉瘤后发生IMI的独立危险因素。
血小板抑制率是评估介入操作围术期缺血事件风险的重要因素,血栓弹力图是检测血小板抑制率的常用方法[11]。本研究中仅单通道抑制率良好(即血小板抑制不足)者占全部患者的51.69%,而在IMI组中显著高于非IMI组(70.10% vs 38.85%,P<0.01),提示术前应根据血小板抑制情况调整抗血小板治疗方案,或谨慎选择手术时机。
糖尿病及缺血性卒中可通过炎性因子驱化、G蛋白偶联受体活化、表面识别受体激活、表面糖蛋白暴露等多途径过度激活血小板功能[12-14],促进IMI发生。本研究结果显示糖尿病及缺血性卒中均与IMI有关,但并非IMI的独立危险因素,可能与样本量及患者个体差异等因素有关。糖尿病参与包括缺血性卒中在内的多种脑血管性疾病的发生,主要机制是血管内皮损害、小血管炎症。SAE术后发生IMI的主要机制是微血栓致小血管急性闭塞。有学者[2,6]认为微血栓形成与介入材料及介入操作时血管内皮损伤相关;另有研究[12-14]发现,糖尿病患者体内血小板功能存在过度激活,常规剂量抗血小板药物可能无法取得理想的血小板抑制效果。因此,即使糖尿病并非IMI发生的独立危险因素,对于合并糖尿病的动脉瘤患者,围术期仍需严格进行血糖管理,并监测血小板抑制率。
关于动脉瘤部位对IMI的影响尚未明确。针对前交通动脉瘤栓塞的研究[15-16]结果显示,前交通动脉瘤栓塞术后缺血事件发生风险高于其他部位动脉瘤。本研究IMI组内前交通动脉瘤占比显著高于非IMI组(34.02% vs 11.51%,P<0.01),且前交通动脉瘤是IMI独立危险因素。分析原因,可能为前交通动脉复合体存在丰富的穿支血管[15],且解剖变异大[16],导致介入治疗操作复杂,可能增加微栓子形成和逃逸风险,造成穿支血管闭塞。动脉瘤内存在附壁血栓时,栓塞过程中微弹簧圈襻的切割效应可能增加栓子逃逸和IMI风险。
本研究发现支架贴壁不良是IMI的独立危险因素,原因可能在于支架贴壁不良时易形成支架挂壁微血栓。此外,成篮圈选择不当、瘤颈保护不足及收尾圈偏大等均可致微弹簧圈襻疝出瘤囊,后者亦为IMI的独立危险因素,因疝出弹簧圈的游离金属襻易致血液有形成分附着并形成血栓[17]。支架腔内球囊扩张可促进支架贴壁,采用支架套叠已固定疝出的微弹簧圈襻可减少IMI发生。
本研究不足之处在于系回顾性分析,样本量小,且仅关注围术期IMI,未能分析中长期IMI发生情况及其影响因素。
综上,SAE治疗未破裂颅内动脉瘤后可发生IMI;血小板抑制不足、前交通动脉瘤、伴瘤内附壁血栓、支架贴壁不良及微弹簧圈襻疝出瘤囊是IMI的独立危险因素。充分抗血小板准备、慎重制定治疗策略、促进支架贴壁和以理想的弹簧圈进行填塞有助于降低IMI发生率。
