P450酶催化C—H键官能团化的研究进展
2021-09-27李应娜万南微陈永正
李应娜,万南微,陈永正*
(1.遵义医科大学 a.药学院;b.贵州省生物催化与手性药物合成重点实验室;c.贵州省绿色制药工程研究中心,贵州 遵义 563000)
C—H键选择性活化是构建C—X键的有效策略[1-3],该策略已成为向有机化合物中引入新功能基团最直接的方法之一[4]。在有机化合物中常常存在化学性质相似的C—H键[5],且C—H键的解离能较高、极性小[6],如何在温和条件下实现C—H键的选择性官能团化是该策略的研究难点。在传统的合成化学中,金属催化法[7-10]和有机小分子催化法[11]都是C—H键选择性活化官能团化的重要路线,但该过程中涉及昂贵催化剂的使用,反应条件苛刻,存在化学、区域和立体选择性控制难等问题。随着生物信息学、分子生物学和结构生物学的发展,可通过定向进化技术赋予酶更多的催化功能,以P450单加氧酶为代表的生物催化方法在C—H键活化上取得了突破性的进展[12-15]。本文综述了近10年P450酶催化C—H键选择性官能团化方面的研究进展。
P450酶,全称细胞色素P450(cytochrome P450或CYP450),因血红素还原态与一氧化碳结合后在450 nm有特征吸收峰而得名[16-17]。P450是一类硫醇盐蛋白的超家族酶类,亚铁血红素近端连接到保守的半胱氨酸(Cys)残基上,远端则与反应底物相结合进行催化活化[18]。其广泛存在于自然界的动植物、微生物体内,是一类拥有多种催化功能的酶,可以实现不同底物的羟基化、氨基化等。除此之外,P450酶还影响植物中天然产物的活性,参与类固醇、萜烯类、维生素等复杂天然产物的合成,参与动物的新陈代谢以及人体内药物的分解代谢[19]。根据氨基酸序列的同源程度,其成员又依次分为家族和亚家族。根据自身能否实现亚铁血红素的辅酶循环又可将其分为自给型和非自给型。
醇类化合物是药物、农药、聚合物和天然化合物的结构单元,是多功能合成的中间体[20]。合成醇类化合物最直接有效的方法是C—H键直接氧化羟基化(直接将C—H键一步转化为C—O键)[4],符合绿色化学提倡的原子经济性。目前,已有许多文献报道,将P450酶作为催化剂实现C—H键的羟基化[21-24]。
早在1995年,Dawson等[25]就报道将P450cam作为催化剂,催化樟脑1实现C—H键的羟基化生成樟脑醇2,但这一过程中该酶展现出底物普适性和兼容性差等局限。P450cam能高选择性氧化(1R)-樟脑生成(1R)-5-羟基-樟脑作为唯一产物;当底物换成(1S)-樟脑时,除了生成主要产物(1S)-5-羟基-樟脑外,还会有少量的2,5-双酮产物产生(Scheme 1)。

Scheme 1
自二十世纪九十年代以来,定向进化已成为改善菌株催化活性和选择性的有效方法。2014年,李智等[26]报道了源自SphingomonasSp.HXN-200的P450pyr,是一种具有烷烃末端羟化功能的P450酶。通过迭代饱和突变(ISM)策略对P450pyr进行定向进化,成功得到了对烷烃次末端具有高区域选择性和高立体选择性羟化的P450pyr突变体,可用于催化烷烃C—H键的活化羟基化以制备高光学纯的醇(Scheme 2)。2015年,李智等[27]又对P450pyr进一步定向进化获得新的突变菌株,不仅提高了P450pyr对脂环族化合物的化学、区域和立体选择性,而且使P450pyr对新的底物产生兼容性,完成了N-取代吡咯烷羟基化产物的构型互补、烷烃羟基化位点的改变以及催化正丁醇生成1,2-二丁醇,区域选择性均高于98%,实现烷烃C—H键的区域/立体选性功能化(表1)。
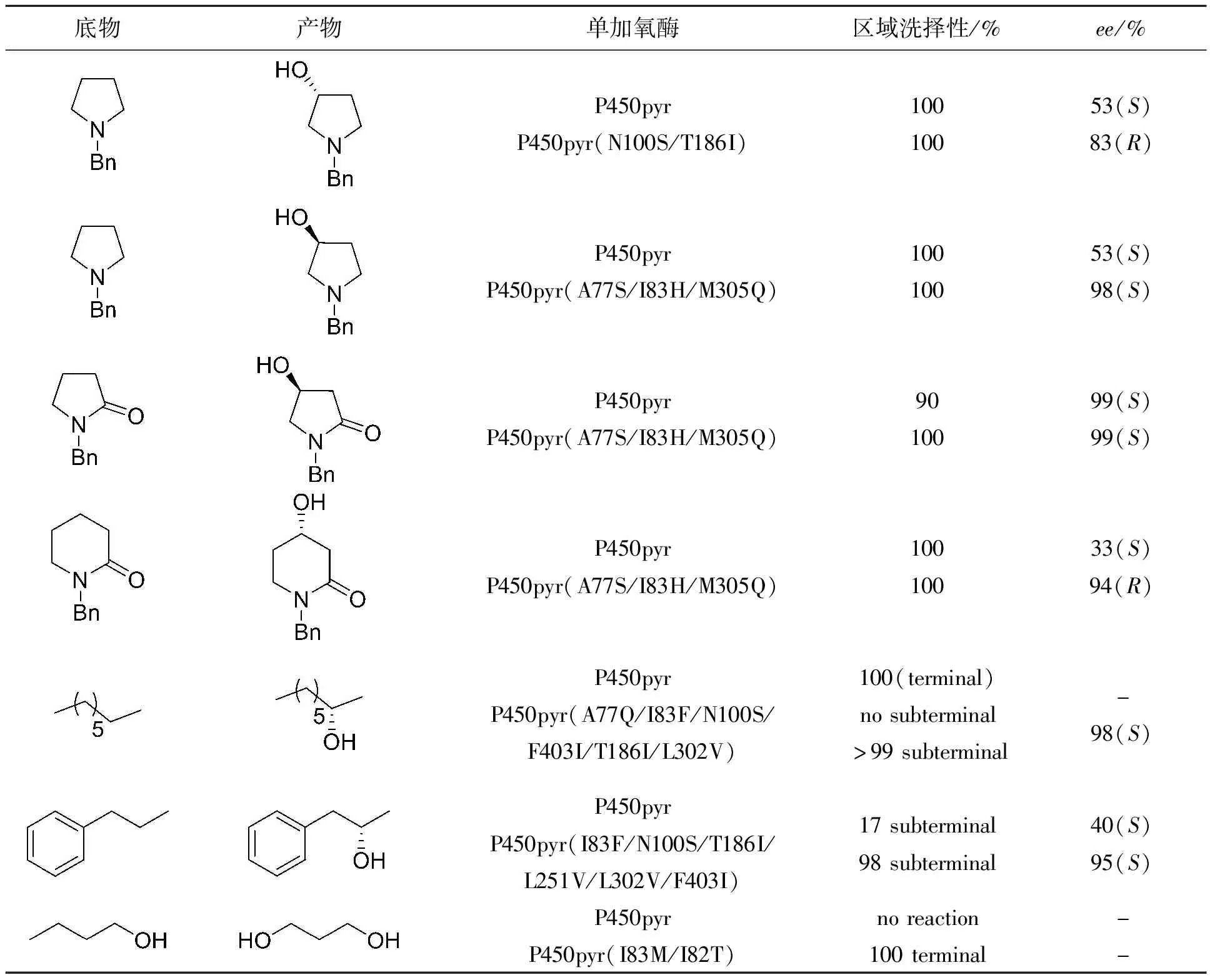
表1 P450pyr及突变体的底物谱考察
与此同时,Priska等[28]采用迭代饱和突变策略对P450BM3进行了分子改造,得到了两株对底物7具有高选择性的突变体。其中F87A/I263L突变体对底物7的C9具有非常高的区域羟化活性(100%);而L75A/V78A/F87G突变体则对底物7的C10具有较高的区域选择性(97%)(Scheme 3)。

Scheme 2

Scheme 3
P450酶在催化过程中表现出高立体/区域选择性,促使化学家们考虑用酶催化来补充甚至替代传统的合成路线,用于实现药物分子的修饰及合成。2009年,Fasan等[29]利用P450酶作为催化剂实现C—H键的羟基化,并将P450酶与化学法级联实现含氟化合物的合成。这一过程主要是通过使用P450单加氧酶将羟基引入到目标骨架中,再使用亲核氟化剂(DF)取代羟基实现氟化(Scheme 4)。使用具有不同区域选择性的P450突变体与亲核氟化剂(DF)级联可获得不同氟化衍生物。
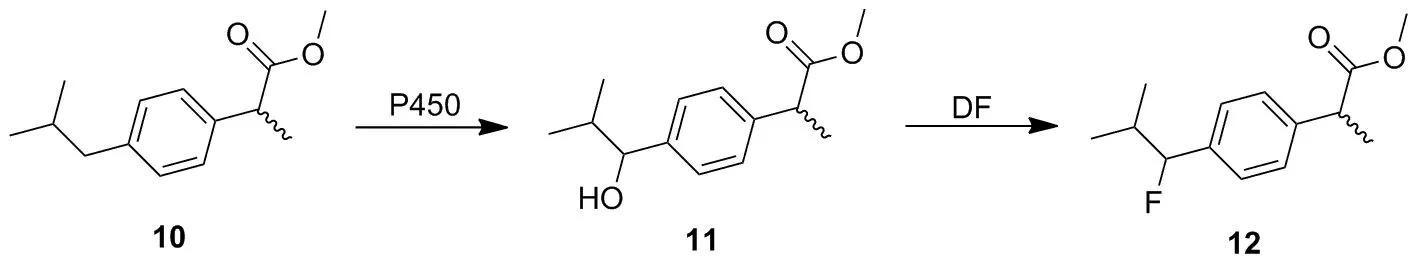
Scheme 4

Scheme 5
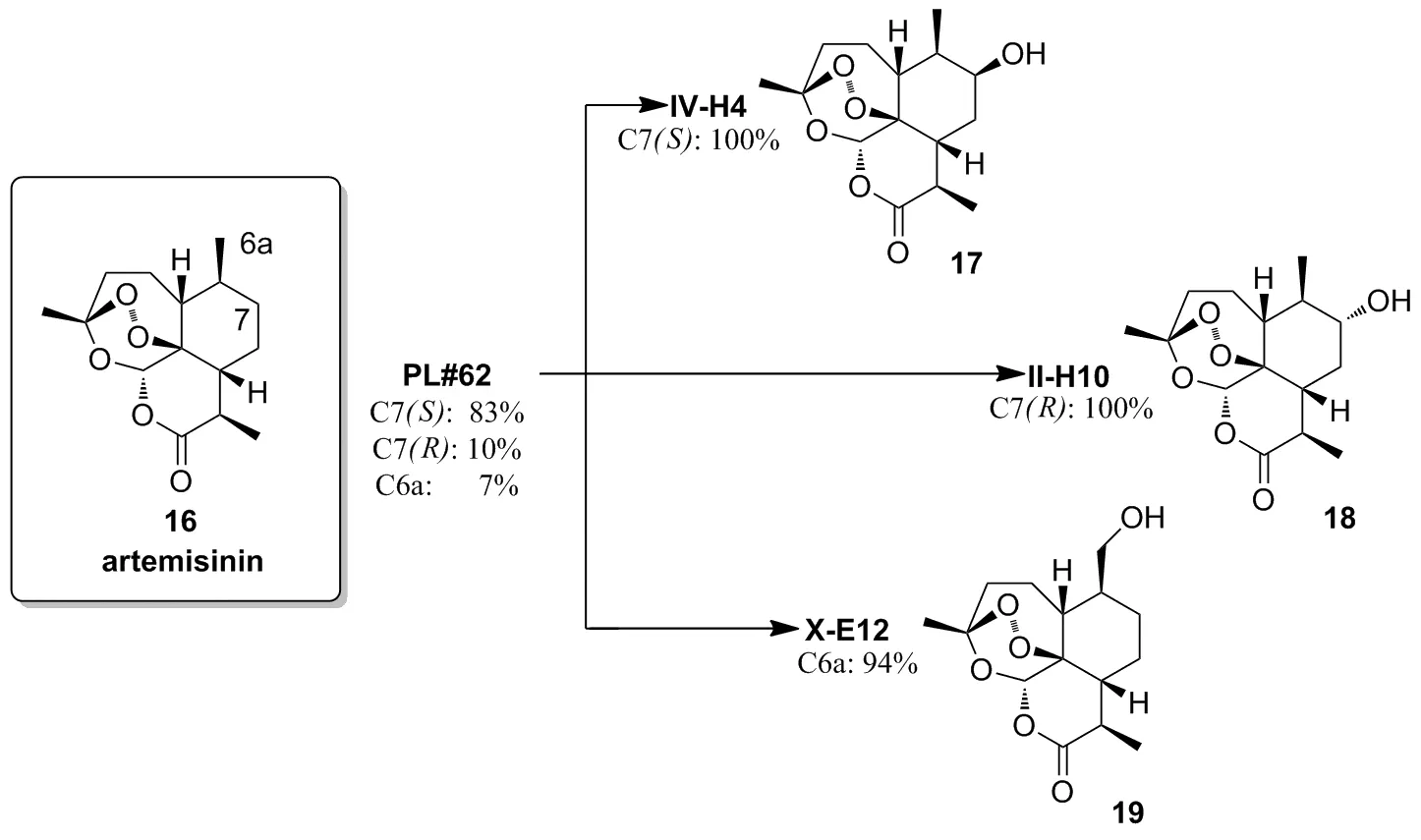
Scheme 6

Scheme 7
Reetz等[21]利用突变景观和分子动力学模拟合理设计迭代饱和突变,得到的突变体在兼顾活性的同时还可以实现类固醇C16的选择性羟基化(Scheme 5),其产物是糖皮质激素的组成部分,具有实用价值。
Fasan等[30]报道了利用P450酶调控天然产物青蒿素的不同位点的不对称羟基化,通过定向进化提高该酶的区域和立体选择性。以P450BM3突变体FL#62为该实验的模板菌株,通过定向进化并结合高通量P450酶的指纹识别筛选方法得到3株突变体IV-H4、II-H10和X-E12,对青蒿素实现高区域和立体选择性羟基化。模板菌株FL#62在该反应中选择性差,生成产物中有83%的C7(S),10%的C7(R),7%的C6a;而突变体IV-H4可催化青蒿素只转化为17;II-H10催化青蒿素只转化为18;X-E12催化该反应选择性生成的产物19比亲本高87%(Scheme 6)。

Scheme 8
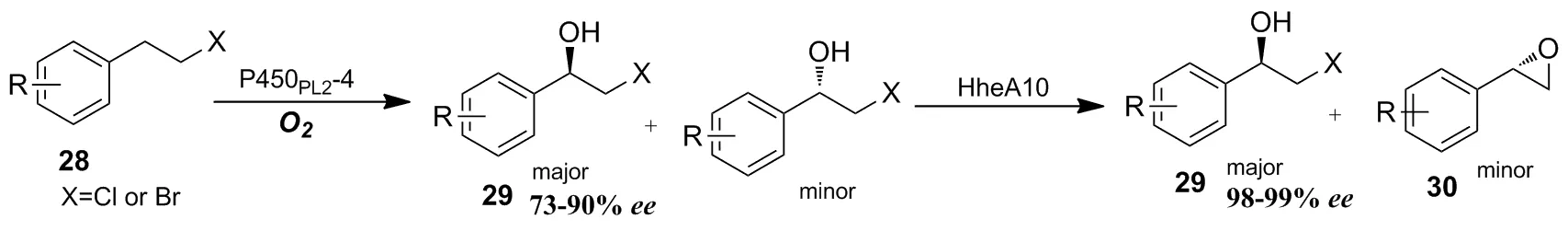
Scheme 9
Scheme 10
2014年,Fasan等[31]将P450突变体用于单萜内酯环(C9和C14)的高区域选择羟基化(Scheme 7)。在羟基化产物的基础上,通过化学法进一步合成一组新的小白菊内酯类似物,并且其中一些化合物具有抗原发性急性髓系白血病的能力。
2021年,Fasan等[32]利用高通量筛选方法筛选出P450突变体V-F10和V-H10,对具有抗白血病活性的天然产物(MCL)的C2和C14进行高选择性羟基化,生成产物26和27(Scheme 8),弥补了该类天然产物这两个位点C—H键羟基化的空白,再进一步采用化学法对该两个位点的羟基进行官能团化修饰,可显著提升该药物分子的抗白血病活性。
Scheme 11
Scheme 12

Scheme 13
Scheme 14
除了定向进化外,也有新的方法被开发用于弥补P450酶在催化羟基化过程中的不足,如构建级联催化体系、光酶催化体系和引入诱导/辅助小分子等。2019年,陈永正等[33]利用P450酶与卤醇脱卤酶级联反应,将卤代烷烃化合物28高选择性转化为R构型的卤代醇29,其ee值可以达到98%~99%(Scheme 9)。
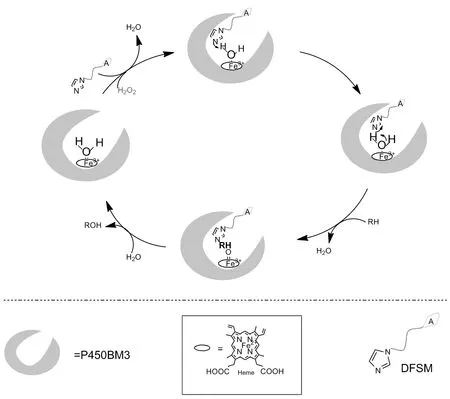
为了摆脱P450酶对辅酶NADPH复杂循环系统的依赖,Reetz等[34]报道了第一个使用光驱动P450酶实现C—H键的羟基化,该反应使用可溶性的去氮黄素(deazaflavin)介质代替昂贵的NADPH辅因子作为廉价的电子供体。2019年,丛志奇等[35]利用直接干预策略和分子工程技术结合,创造出一种由细胞色素P450BM3突变体与辅助双功能小分子DFSM组成的人工P450过氧酶系统,DFSM(一端含有可高效利用H2O2的咪唑,另一端含有可与P450BM3结合的酰基氨基酸碎片)在该系统中作为一种酸碱帮助催化剂激活H2O2(Scheme 10),实现小分子烷烃的选择性羟基化。
含氮化合物作为生物相关化合物、药物和天然产物中关键的基础结构,因此降低成本将化学原料转化为高价值的手性胺是非常有吸引力的策略。在众多的合成方法中,C—H键直接胺化因不需任何预官能团化而具有吸引力。酶因廉价、环保和催化选择性高而成为一种“明星”催化剂,并且Arnold等已证明,P450酶可以在实验室中被设计成为具有高催化效率和立体选择性的催化剂从而实现C—H键胺化。
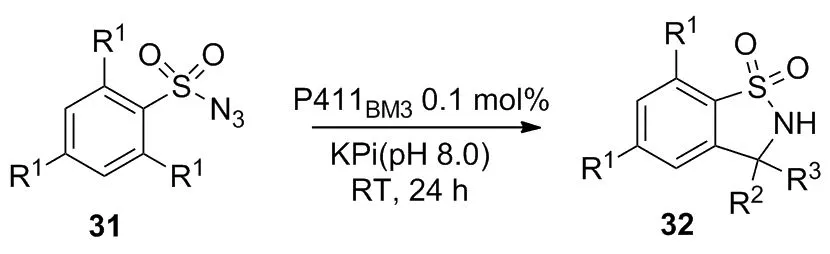
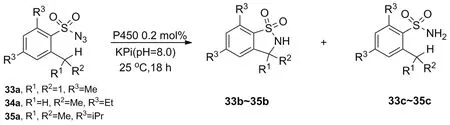
早在1985年,Breslow等[36]从肝微粒中提取了P450酶,并用于催化C—H键的氨基化,该报道证实了P450酶可用于催化C—H键胺化。直到2013年,Arnold等[37]利用定向进化技术得到P450BM3的突变体P411BM3(C404S),将其用于催化底物31转化为产物32(Scheme 11),再次证明P450酶具有催化C—H键氨基化的能力。Fasan等[38]以2,4,6-三取代苯磺酰33a~35a为底物考察了P450BM3及其不同突变体在催化分子内C—H键氨基化反应的能力(Scheme 12)。实验数据表明,不同突变体催化磺酸叠氮分子实现分子内氨基化的能力不同(表2)。

表2 不同P450突变体C-H键氨基化能力考察结果
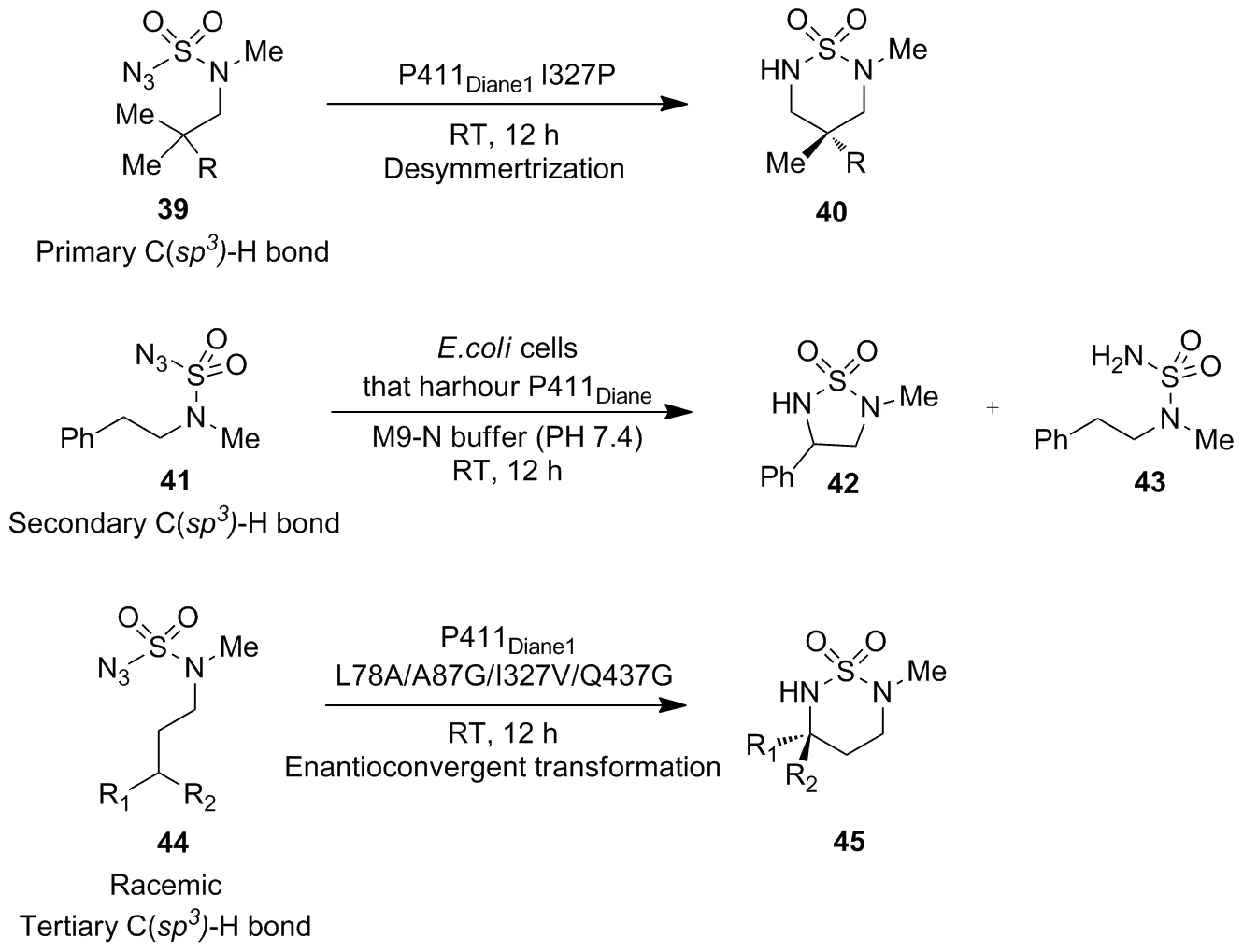
随后,Arnold等[39]又对P411BM3进一步改造得到两株突变体P411BM3-Variant A/-Variant B,可以对磺酸叠氮分子36进行选择性氨基化,并可选择性生成相应的五元环产物37和六元环产物38(Scheme 13)。除此之外,Arnold等[40]对P411为模板菌株进行分子改造,还得到一系列突变体(P411Diane)可催化伯、仲和叔C(sp3)—H键的对映选择性胺化,展现出优良的底物谱适性(Scheme 14)。
除了P450BM3外,Hartwig等[41]报道了一种源于嗜热生物中的P450酶(Ir(Me)-PIX),该P450酶含有铱卟啉环。Ir(Me)-PIX可以催化不同取代基磺酸叠氮化合物46的分子内立体选择性氨基化生成五元环产物47,通过定向进化可对其催化的活性和选择性进一步改善,生成产物的产率可达98%,ee值可达95%(Scheme 15)。

Scheme 15
上述文献报道的C—H键氨基化主要发生在含有磺酸叠氮结构的化合物中。2015年,Fasan等[42]进一步报道了P450BM3的突变体P411BM3可有效地催化碳酸盐叠氮化物48环化生成恶唑烷酮49(Scheme 16)。Wong等[43]利用细胞色素P450催化底物50分子内C—H胺化合成咪唑啉-4-酮51(Scheme 17)。
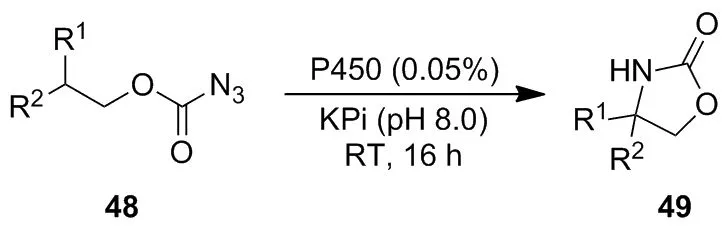
Scheme 16
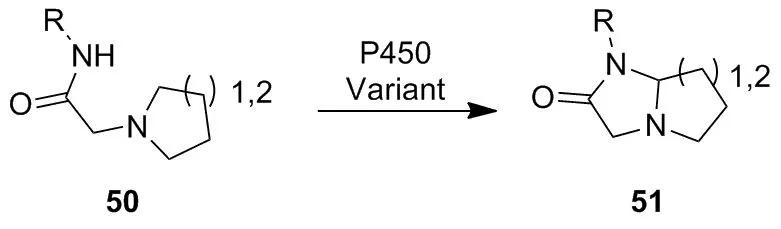
Scheme 17
上述研究报道中,P450酶的突变体P411只能实现分子内的C—H键氨基化,即要求分子内含有氮源。2017年,Arnold等[2]发表的论文表明,P411BM3突变体P411CHA(A82L/A78V/F263L/E267D)可用于催化分子间的氨基化,并且拥有较好的催化活性以及立体选择性(Scheme 18)。该工作为P450酶催化C—H键分子间胺化的研究做出了重大贡献。

Scheme 18
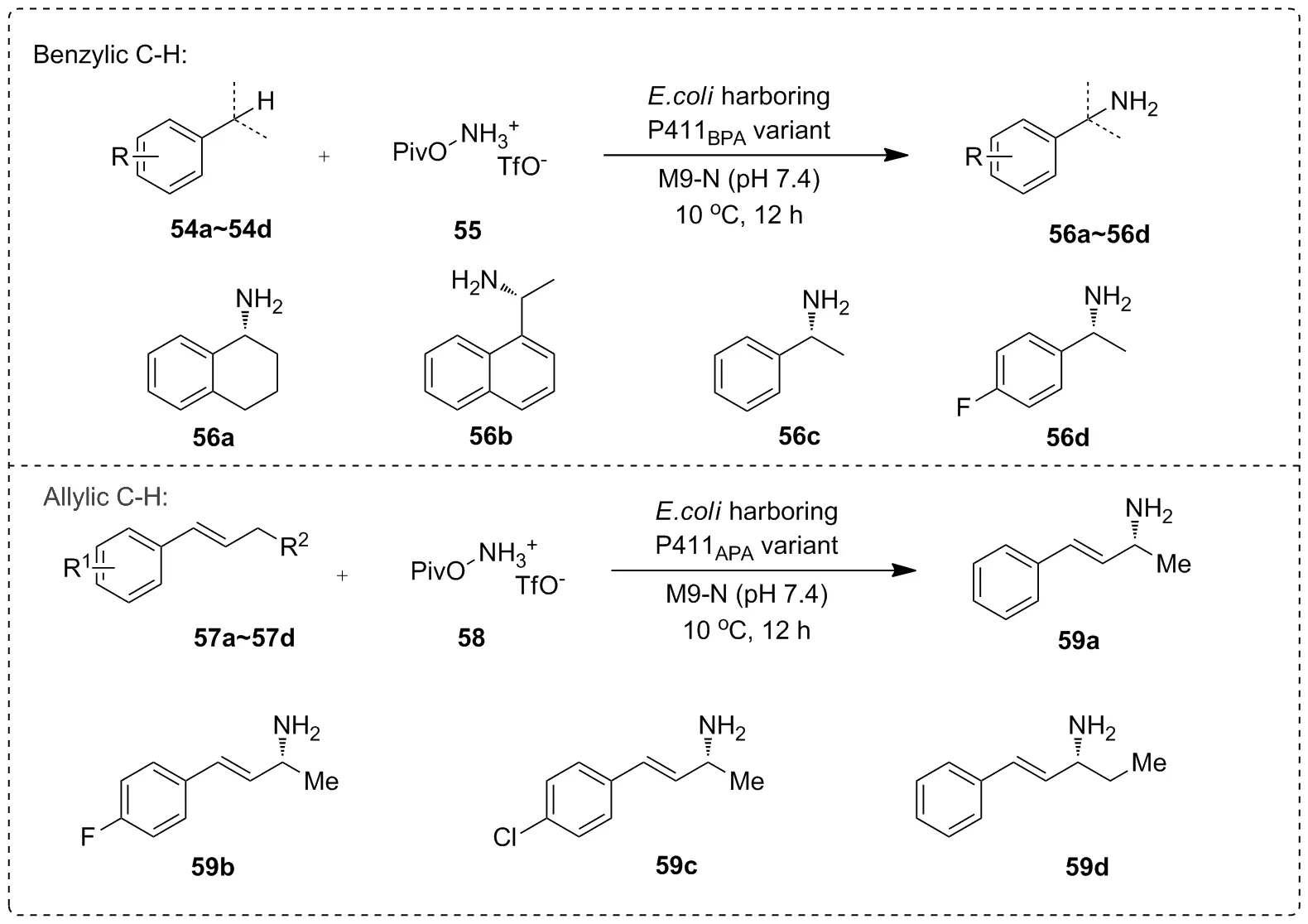
Scheme 19
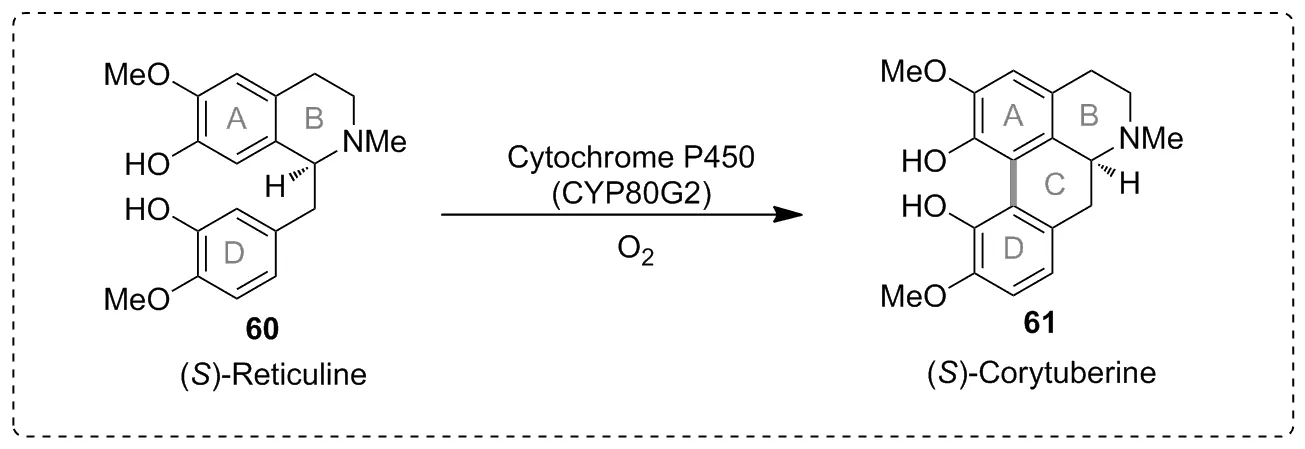
Scheme 20
2020年,Arnold等[44]通过对P450BM3进行改造后得到两株突变体,P411BPA和P411APA。P411BPA可有效实现底物苄位C—H键的氨基化,而P411APA主要用于催化底物烯丙位C—H键的氨基化(Scheme 19)。
C—C键是有机化合物的中心结构。在有机化合物中通过C—H键的烷基化引入不同烷基基团,可以得到具有不同性质的化合物衍生物。但有关P450酶催化C—H键形成C—C键的报道有限。2008年,Fumihiko Sato等[45]利用细胞色素P450酶CYP80G2催化分子内的C—H键烷基化,实现分子内C—C键偶联反应,将底物(S)-Reticuline转化为产物(S)-Corytuberine(Scheme 20)。
Scheme 21
Scheme 22

Scheme 23
2018年,Seyedsayamdost等[46]利用P450催化分子内C—C键的偶联反应,将P450酶OxyC与化学法级联实现万古霉素的合成。
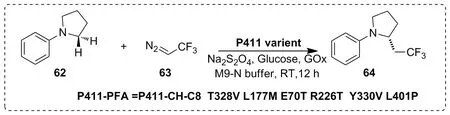
在有机化合物中引入氟烷基基团可以显著改变其药理特性[47]。2019年,Arnold等[48]通过定向进化技术获得P450突变体,可以催化氟烷基卡宾中间体插入底物C—H键中,可实现含氟烷基分子的对映异构体合成,ee值高达99%(Scheme 21)。该研究中开发的酶将为合成含氟生物活性分子开辟新的途径,提供一种可将P450酶用于催化C—H键官能团多样化的新思路。
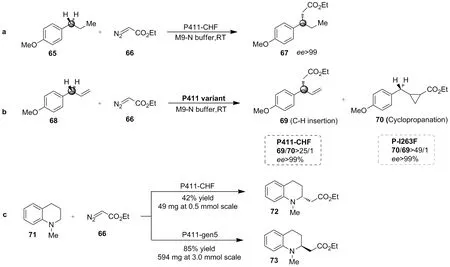
2019年,Arnold等[3]采用定向进化技术对P450BM3的突变体P411进一步研究发现,通过改造得到的P450突变体能完成多种底物(包括苯基、烯丙基或α-氨基)的C—H键功能化。探索发现,通过卡宾插入C—H键实现分子间的烷基化,能获得较高的转化率和优良的选择性(Scheme 22)。
2020年,Arnold等[49]通过对P411进行改造获得了突变体P411-C10,可高效和高立体选择性将内酯-卡宾转移到74α-氨基位置的C—H键上生成产物76或77(Scheme 23)。
C—H键直接官能团化是构建C—X键合成新化合物最简便的方法,具有较高的研究价值和广阔的应用前景。目前,P450酶在催化C—H键选择性官能团化中展现出巨大潜力,可高选择性的催化C—H键官能团化,并可用于药物分子中间体的合成,其中有关C—H键羟基化的研究较多,而通过C—H键的官能团化构建其他C—X键的研究相对有限。此外,P450酶因其活性低、稳定性差、辅酶依赖性等问题限制了其在实际中的应用,但是随着分子生物学技术和酶工程技术的大力发展,P450酶的应用瓶颈有望逐步被打破,其将成为未来绿色化学发展中最具潜力的生物催化剂之一。
