常春藤皂苷元-半酯-AZT衍生物的合成及抗病毒蛋白酶活性
2021-09-27郝永佳吴继春
郝永佳, 危 英, 周 英, 刘 青, 谌 芬, 向 琴, 张 华, 於 祥, 吴继春, 杨 虹
(贵州中医药大学 药学院,贵州 贵阳 550025)
由HIV(人类免疫缺陷病毒)、HCV(丙型肝炎病毒)等病毒引起的感染性疾病严重地威胁人类健康,并已造成全球范围内流行传播。病毒肆虐之下,开发、寻找高效、低毒的抗病毒药物是目前的当务之急。中药、民族药作为中华民族的瑰宝,在历史的实践过程中积累了诸多抗病毒药物经验。苗药榜榜加腔为忍冬科忍冬属药用植物(LonicerafulvotomentosaHsu et S.C.Cheng)的花蕾,具有抗菌、抗炎、抗病毒和保护肝脏等多种生物活性[1-3]。其主要的活性成分为五环三萜皂苷和酚性化合物,如黄褐毛忍冬苷、咖啡酸衍生物和绿原酸等[4]。笔者在前期研究中,发现苗药榜加腔酸水解产物含有丰富的常春藤皂苷元和咖啡酸等[5]。据报道齐墩果烷型五环三萜常春藤皂苷元具有抗艾滋病病毒蛋白酶、抗恶性细胞增生、抗癌、止痉、保肝、抗菌等生物活性[6-8],而对正常人肾小管上皮细胞(HK2)没有明显的细胞毒性[9]。现代研究表明,三萜类化合物A环C-3羟基导入C6内酸酐,所形成的三萜半酯类化合物抗HIV-1蛋白酶活性增强,三萜酸酐半酯类衍生物与第一个用于临床的艾滋病药物齐多夫定(azidothymidine,3′-叠氮-3′脱氧胸腺嘧啶脱氧核苷,AZT)复合,具有较好的抗HIV-1蛋白酶活性[10]。
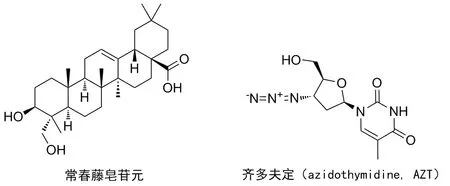
Chart 1
前期计算机模拟研究发现,采用二羧酸酯化三萜-3-羟基,能够增强三萜与艾滋病蛋白酶的结合[11]。为此,本文以具有抗HIV-1蛋白酶活性的常春藤皂苷元为原料,合成一系列常春藤皂苷元半酯类-AZT复合物(Scheme 1),采用荧光法考察目标分子抗HIV-1和HCV NS3/4A蛋白酶的活性,以期发现具有进一步开发潜质的抗病毒蛋白酶抑制剂。

Scheme 1
1 实验部分
1.1 仪器与试剂
BrukerAV 600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); Bruker Daltonics micro ToF-QII型质谱仪。
所用试剂均为分析纯或化学纯。
1.2 合成
(1)Ethyl(3β)-3,23-dihydroxyolean-12-en-28-oate(HES)[12]的合成
将常春藤皂苷元(1.0 g, 2.12 mmoL),碘乙烷(0.68 mL, 8.40 mmoL)和碳酸钾(1451.1 mg, 10.50 mmoL)溶于15 mL二甲基甲酰胺中,室温下反应12 h(TLC检测)。反应结束,用乙酸乙酯(2×100 mL)萃取,合并有机相,减压去除溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/0~1/1,V/V)纯化得白色无定形固体HES800 mg,收率76%;1H NMRδ: 5.28(t-like, 1H), 4.08(t,J=8.0 Hz, 16.0 Hz, 2H), 3.72(d,J=8.0 Hz, 1H), 3.63(dd,J=8.0 Hz, 16.0 Hz, 1H), 3.42(d,J=8.0 Hz, 1H), 1.23(s, 3H), 1.26(s, 3H), 1.26(s, 3H), 1.13(s, 3H), 0.92(s, 3H), 0.89(s, 3H), 0.74(s, 3H);13C NMRδ: 177.5, 143.5, 122.5, 76.8, 72.1, 60.2, 49.7, 47.7, 46.4, 46.1, 41.7, 41.7, 41.2, 39.3, 38.1, 36.9, 33.1, 32.4, 32.4, 30.6, 29.6, 29.6, 27.6, 26.6, 25.8, 25.8, 23.5, 18.3, 16.9, 15.8, 14.2, 11.0; HR-MS(EI)m/z: Calcd for C32H52O4Na{[M+Na]+}523.3763, found 523.3757。
(2)化合物1~5的合成通法
将常春藤皂苷元或常春藤皂苷元乙酯(500 mg, 1.06 mmol)和相应无水酸酐(10.6 mmol),DMAP(1015.20 mg, 8.31 mmol)置于50 mL圆底烧瓶,溶于6 mL无水吡啶中,120℃回流反应24 h(TCL监测)。反应完全后,用1 mol/L的硫酸调pH至6,用氯仿(2×100 mL)萃取,合并有机相,减压去除溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/0~1/1,V/V)纯化得常春藤皂苷元半酯类粗品600 mg,收率48%~70%。取半酯类粗品(100 mg, 0.143 mmol)置于50 mL圆底烧瓶,加入DCC(176.75 mg, 0.858 mmol)、AZT(152.84 mg, 0.572 mmol)和DMAP(104.85 mg, 0.858 mmol),溶解于6.0 mL混合溶剂(二氯甲烷/乙腈=4/1,V/V)中,避光反应15 h(TLC监测)。反应完全,用氯仿(2×100 mL)萃取,合并有机相,减压去除溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/0~1/1,V/V)纯化后以薄层板(展开剂:石油醚/丙酮=1/1,V/V)分离;再经半制备高效液相色谱仪纯化得无定形粉末状固体1~5。
1:白色固体,收率22.5%;1H NMRδ: 9.10(brs, 2H), 7.25~7.26(m, 2H), 6.07(dd,J=6.0 Hz, 12.0 Hz, 2H), 5.28(t-like, 1H), 4.73~4.77(m, 1H), 4.43~4.45(m, 2H), 4.28~4.33(m, 4H), 4.05~4.09(m, 4H), 3.86(d,J=12.0 Hz, 1H), 3.75(d,J=12.0 Hz, 1H), 2.87(dd,J=12.0 Hz, 1H), 2.63~2.69(m, 3H), 2.46~2.48(m, 3H), 1.92(d,J=12.0 Hz, 6H), 1.23(s, 3H), 1.14(s, 3H), 0.96(s, 3H), 0.93(s, 3H), 0.90(s, 3H), 0.83(s, 3H), 0.74(s, 3H);13C NMRδ: 177.7, 172.0, 171.9, 171.8, 171.6, 163.7, 163.7, 150.1, 150.1, 144.0, 135.9, 135.4, 122.1, 111.2, 111.2, 86.0, 86.0, 81.9, 81.9, 75.1, 65.7, 63.3, 63.3, 60.4, 60.4, 60.1, 47.9, 47.7, 46.4, 46.1, 45.8, 41.7, 41.3, 40.8, 39.3, 37.7, 37.5, 37.4, 36.8, 36.8, 33.9, 33.1, 32.4, 32.3, 30.8, 30.7, 29.2, 29.1, 29.0, 27.6, 25.8, 23.6, 23.4, 23.0, 18.0, 17.0, 15.8, 14.3, 13.1, 12.6, 12.6; MS(ESI)m/z: Calcd for C60H82N10O16{[M+H]+}1198.5910, found 996.6, 733.8, 697.0。
2: 白色固体,收率16.7%;1H NMRδ: 8.45(brs, 1H), 7.27~7.28(m, 1H), 6.14(t-like,J=8.0 Hz, 1H), 5.31(t-like, 1H), 4.75~4.80(m, 1H), 4.46~4.49(m, 1H), 4.31~4.37(m, 2H), 4.11~4.14(m, 3H), 3.93(d,J=12.0 Hz, 1H), 3.88(d,J=12.0 Hz, 1H), 3.77(d,J=12.0 Hz, 1H), 2.87(dd,J=12.0 Hz, 1H), 2.62~2.69(m, 2H), 2.41~2.50(m, 3H), 1.96(d,J=12.0 Hz, 3H), 1.25(s, 3H), 1.16(s, 3H), 0.98(s, 3H), 0.95(s, 3H), 0.92(s, 3H), 0.85(s, 3H), 0.77(s, 3H);13C NMRδ: 177.3, 173.1, 172.9, 171.9, 171.8, 171.7, 163.3, 149.9, 143.9, 135.3, 121.9, 111.1, 85.2, 81.5, 74.8, 63.3, 60.5, 52.0, 51.8, 47.8, 47.7, 46.5, 46.6, 45.9, 41.7, 41.3, 40.9, 39.3, 37.7, 37.5, 36.9, 33.9, 33.1, 32.4, 30.7, 30.1, 29.1, 29.0, 28.9, 27.7, 25.9, 23.5, 22.7, 18.0, 17.0, 15.8, 14.3, 13.1, 13.0, 12.7; MS(ESI)m/z: Calcd for C50H71N5O13Na2{[M+2Na]+}995.4844, found 995.7。
3: 白色固体,收率30.0%;1H NMRδ: 7.51(s, 2H), 6.18(dd,J=6.0 Hz, 12.0 Hz, 2H), 5.29(t-like, 1H), 4.76(dd,J=12.0 Hz, 1H), 4.44~4.50(m, 4H), 4.30~4.35(m, 2H), 4.08~4.41(m, 4H), 3.85(dd,J=12.0 Hz, 2H), 3.38(s, 1H), 2.90(dd,J=12.0 Hz, 1H), 2.37~2.85(m, 10H), 1.93(d,J=12.0 Hz, 6H), 1.27(s, 3H), 1.18(s, 3H), 1.04(s, 3H), 0.96(s, 3H), 0.94(s, 3H), 0.87(s, 3H), 0.80(s, 3H);13C NMRδ: 178.2, 172.8, 172.7, 172.6, 165.1, 165.1, 150.6, 150.6, 143.5, 136.5, 136.5, 122.5, 110.5, 110.5, 85.2, 85.2, 81.6, 81.6, 74.1, 64.4, 62.9, 62.9, 60.8, 60.8, 60.1, 48.2, 48.2, 46.5, 45.7, 41.6, 41.4, 40.6, 39.3, 37.7, 36.5, 36.4, 36.4, 36.3, 33.4, 32.8, 32.7, 32.6, 32.4, 32.3, 32.2, 32.1, 30.4, 27.3, 25.0, 23.1, 22.6, 22.5, 20.0, 19.9, 17.6, 16.3, 14.9, 14.9, 13.2, 12.1, 11.3, 11.2; MS(ESI)m/z: Calcd for C62H85N10O16{[M-H]-}1225.6145, found 1225.3。
4: 白色固体,收率11.1%;1H NMRδ: 7.51(s, 1H), 6.19(s, 1H), 5.32(t-like, 1H), 4.80(dd,J=12.0 Hz, 1H), 4.38~4.46(m, 4H), 4.10~4.11(m, 2H), 4.01(d,J=12.0 Hz, 1H), 3.74(dd,J=12.0 Hz, 2H), 2.94(dd,J=12.0 Hz, 1H), 2.48~2.50(m, 4H), 1.96(s, 3H), 1.35(s, 3H), 1.29(s, 3H), 1.27(s, 3H), 1.25(s, 3H), 1.25(s, 3H), 1.07(s, 3H), 1.00(s, 3H), 0.97(s, 3H), 0.91(s, 3H), 0.83(s, 3H);13C NMRδ: 178.2, 176.3, 172.5, 172.4, 171.0, 165.5, 151.1, 143.8, 136.3, 122.3, 110.5, 85.3, 81.4, 74.5, 64.9, 63.6, 61.1, 59.9, 51.1, 48.2, 48.2, 46.5, 45.8, 44.6, 43.8, 41.5, 41.4, 40.4, 40.3, 39.3, 37.6, 36.6, 36.4, 36.3, 33.5, 32.7, 32.6, 32.5, 32.3, 32.2, 32.1, 30.2, 29.4, 27.5, 27.5, 25.4, 25.2, 25.0, 24.9, 24.7, 24.5, 24.5, 23.2, 22.6, 22.6, 22.5, 17.7, 16.4, 14.9, 13.2, 12.3, 11.3; MS(ESI)m/z: Calcd for C54H78N5O13{[M-H]-}1004.5596, found 1004.5。
5: 白色固体,收率6.5%;1H NMRδ: 8.13(s, 2H), 7.54(s, 2H), 6.79(d,J=6.0 Hz, 2H), 6.19~6.22(m, 2H), 5.30(t-like, 1H), 4.80(dd,J=12.0 Hz, 1H), 4.33~4.45(m, 6H), 4.13~4.14(m, 3H), 3.67(dd,J=12.0 Hz, 2H), 2.93(dd,J=12.0 Hz, 1H), 2.41~2.58(m, 6H), 1.96(s, 6H), 1.31(s, 3H), 1.21(s, 3H), 1.06(s, 3H), 1.00(s, 3H), 0.95(s, 3H), 0.90(s, 3H);13C NMRδ: 179.1, 173.1, 172.8, 172.7, 172.0, 164.9, 164.9, 150.3, 150.3, 145.4, 136.7, 136.3, 135.7, 121.7, 110.5, 106.3, 85.0, 84.7, 82.0, 82.0, 78.1, 63.1, 63.1, 60.8, 60.8, 59.9, 56.9, 50.3, 48.2, 47.1, 46.8, 46.7, 46.2, 41.6, 41.6, 40.7, 39.1, 38.1, 38.1, 37.7, 36.5, 32.8, 32.8, 32.7, 32.7, 32.4, 30.3, 29.4, 27.4, 27.4, 25.0, 24.5, 22.6, 22.4, 19.7, 17.4, 16.9, 16.5, 15.1, 15.1; MS(ESI)m/z: Calcd for C60H82N10O16{[M-H-}1198.5910, found 1198.6。
1.3 活性测试
采用荧光法对常春藤皂苷元-半酯-AZT衍生物抑制HIV-1、HCV NS3/4A蛋白酶活性进行测试[13]。在384孔板中,先分别加入2 μL 溶于DMSO的样品和8 μL酶,再加入10 μL底物,每个浓度均为3个复孔,震荡混匀后,37 ℃下暖孵30 min;随后经Synergy II在激发波长485 nm和发射波长528 nm下测试荧光强度。选取已知的HIV-1蛋白酶抑制剂Pepstatin A、HCV蛋白酶抑制剂Embelin作为阳性对照。
2 结果与讨论
以常春藤皂苷元为母体结构合成的常春藤皂苷元-酸酐-AZT衍生物比其母体结构(IC50=42.3 μM)对HCV NS3/4A蛋白酶的抑制活性均有提高(见表1)。,其中化合物5比原料抗HCV蛋白酶活性提高了8倍,化合物5与化合物3均为3,23-双取代的戊二酸酐衍生物,但化合物3为常春藤皂苷元乙酯衍生物(28-COOC2H5),化合物5为常春藤皂苷元衍生物(28-COOH),两者抗HCV 蛋白酶活性相差近2倍,说明28-羧基具有增强抗病毒活性作用。3,23-二氧丁二酸酐-AZT衍生物(1)抗HCV蛋白酶活性略强于单取代取代衍生物(2)。化合物1与3相比,C5酸酐-AZT衍生物抗HCV蛋白酶活性比C4酸酐-AZT衍生物1强3倍。因该类衍生物过少,相关构效关系的明确,尚需更多衍生物的合成与活性的深入研究[14-15]。

表1 常春藤皂苷元-酸酐-AZT衍生物的抗病毒蛋白酶活性(n=3)
选取常春藤皂苷元为起始原料,经逐步酯化反应,合成了5个结构新颖的常春藤皂苷元-酸酐-AZT衍生物,其结构经1H NMR和13C NMR表征。此外,测试了目标产物体外对HIV-1和HCV NS3/4A蛋白酶的抑制活性。结果显示,5个衍生物对HCV NS3/4A蛋白酶均表现出一定的抑制活性,其中抑制活性最强的是5(IC50=5.8 μM),研究结果为抗病毒药物研究提供了理论基础。
