萌芽处理对鹰嘴豆蛋白组分及界面性质的影响
2021-09-26李学红郝楠楠高素利李文举
李学红 郝楠楠 张 露 高素利 李文举
(郑州轻工业大学食品与生物工程学院,郑州 450001)
鹰嘴豆(chickpea)属豆科鹰嘴豆属(CicerarietinumL.),一年生豆科草本植物,因具有尖如鹰嘴的突触而得名[1]。鹰嘴豆蛋白质含量平均为23.71%,且蛋白质成分非常接近牛乳、鸡蛋、鱼和肉等动物来源的优质蛋白;除此之外,氨基酸种类丰富,高达18种,包括人体必需的8种氨基酸[2,3]。因此,鹰嘴豆是一种很好的植物氨基酸补充剂,对儿童成长期间智力发育、骨骼生长及中老年人的身体健康有重要作用[4]。
蛋白质按照其溶解性不同一般可分为水溶性清蛋白(albumin)、盐溶性球蛋白(globulin)、溶于稀碱或稀酸的谷蛋白(glutelin)和溶于70%~80%醇溶液的醇溶蛋白(prolarmine)[5]。种子萌芽过程中,自身新陈代谢加强,一些营养物质不断被消耗和重新合成,蛋白质在酶的作用下发生降解,各蛋白质组分和氨基酸组成比例发生一定变化,且一些蛋白酶抑制剂和抗营养物质消失,使蛋白质消化吸收率增加[6-7]。有研究发现,小扁豆在萌芽过程中分子质量较大的酸性亚基降解,分子质量较小的亚基条带逐渐出现,但是一些原始亚基条带并未发生变化,例如35、30、12、11 ku[8]。绿豆在萌芽过程中蛋白质亚基条带也存在显著差异[9]。
关于鹰嘴豆的营养价值及理化特性的研究有很多,但是关于萌芽对鹰嘴豆蛋白质组分含量及亚基结构的影响却鲜有报道。本实验主要研究了鹰嘴豆4种组分蛋白在萌芽过程中含量的动态变化和亚基结构的变化,及分离蛋白亚基结构和界面性质变化,以期提高鹰嘴豆的利用率和经济价值,为鹰嘴豆蛋白的加工利用提供参考。
1 材料与方法
1.1 材料与仪器
鹰嘴豆:产自乌鲁木齐木垒县;大豆油:一级。
GHP-9080隔水式培养箱,多功能电泳仪,UV2800双光束紫外可见光分光光度计, FD-K-50冷冻干燥机, TDZ5-WS台式高速离心机,XHF-DY高速分散器。
1.2 实验方法
1.2.1 萌芽鹰嘴豆样品的制备
挑选颗粒饱满的干鹰嘴豆种子加入10倍体积的去离子水,于室温下浸泡过夜,后均匀平铺在发芽盘上,置于(23±1) ℃下萌芽,期间定时浇水保湿取样,共取8次。将所得样品去皮,冻干。粉碎过100目筛,-18 ℃冷冻保存,备用。
1.2.2 萌芽鹰嘴豆粉的脱脂处理
参照周丽卿等[10]的方法并稍做修改。将鹰嘴豆粉与石油醚(沸点60~90 ℃)按比例1∶2混合,连续搅拌60 min,静止至上层有机溶剂澄清,回收有机溶剂,重复上述操作至脱脂完全,后将鹰嘴豆粉自然风干12 h,置于4 ℃冰箱中保存,备用。
1.2.3 萌芽鹰嘴豆粉分离蛋白的提取
参照叶健明等[11]的方法并稍加修改。脱脂豆粉与去离子水以1∶10比例混合,用0.5 mol/L NaOH溶液将pH调至10,30 ℃搅拌82 min,4 000 r/min离心15 min,重复上述步骤三次,保留上清液。然后将上清液pH调至5(0.5 mol/L HCL),析出蛋白沉淀。用去离子水洗涤沉淀三次,最后将溶液调pH至中性(0.5 mol/L NaOH),溶液冻干后储存于干燥器皿,备用。
1.2.4 萌芽鹰嘴豆粉4种组分蛋白的提取
采用Osborne连续分级提取工艺提取萌芽鹰嘴豆粉4种组分蛋白,略作修改[12],具体操作步骤见图1。
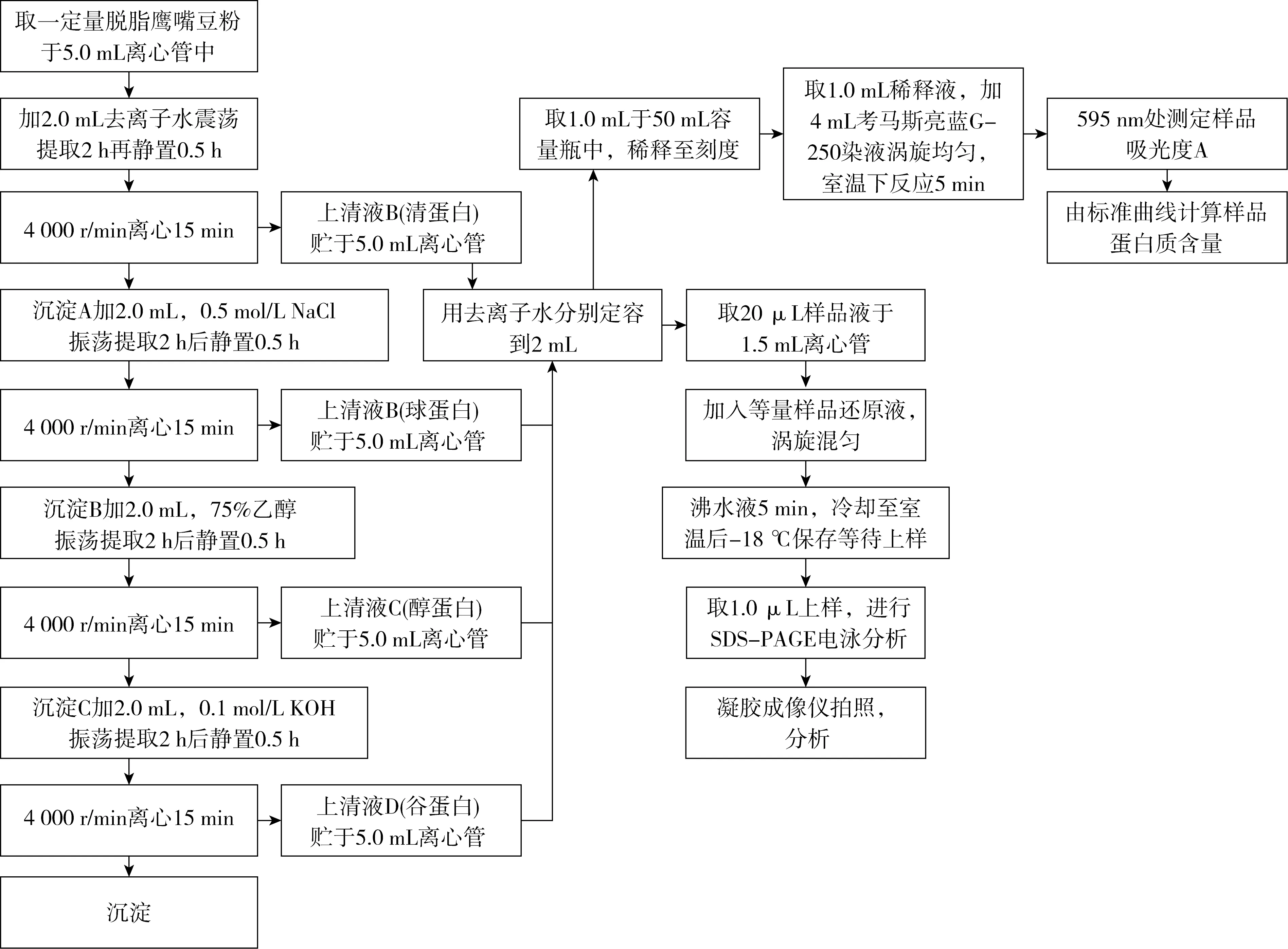
图1 4种组分蛋白(清蛋白、球蛋白、醇蛋白、谷蛋白)分离操作流程图
考马斯亮蓝法测定各蛋白组分含量[13],利用牛血清白蛋白(BSA)作为标准品,标准曲线测定步骤如下:
准确称取牛血清白蛋白(BSA)10 mg于100 mL容量瓶内,加去离子水溶解并定容,即得到浓度为0.1 mg/mL的标准溶液,按照表1配置不同浓度的标准蛋白质溶液,测定标准曲线。
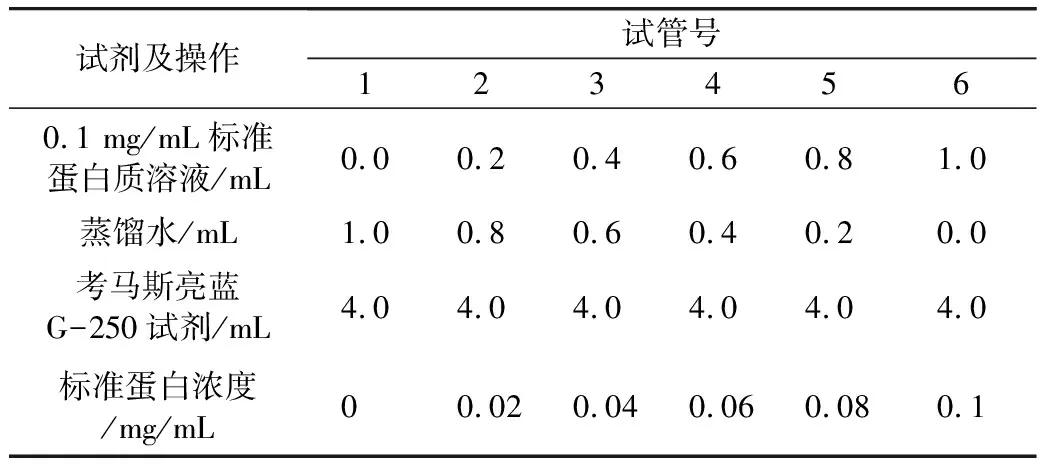
表1 牛血清白蛋白(BSA)标准曲线的测定
经测定得标准曲线y=5.235x+0.0241.R2=0.991 6。
1.2.5 SDS-PAGE电泳
参照Laemmli的方法[14],并稍做修改。采用12%分离胶,5%浓缩胶,凝胶厚度1.0 mm,上样量10 μL,垂直平板电泳仪进行恒压电泳,浓缩胶部分采用80 V电压电泳,分离胶采用120 V电压电泳,样品跑至距底部0.5~1.0 cm时关闭电源停止电泳,后用考马斯亮蓝R-250进行染色约0.5~1 h,脱色液脱色处理约1 h,最后用去离子水清洗至底部接近无色,用凝胶成像仪拍照分析。
1.3 鹰嘴豆分离蛋白界面性质的测定
1.3.1 乳化活性(EAI)及乳化稳定性(ESI)测定
取1%鹰嘴豆分离蛋白溶液15 mL,加入5 mL大豆油,8 000 r/min均质2 min,制备乳液。立即取100 μL乳液加入至5 mL 0.1% SDS溶液中,涡旋混匀,在500 nm处测定吸光度。乳液静置10 min,再次取100 μL乳液置5 mL 0.1% SDS溶液中,涡旋混匀,测定500 nm处吸光度。按照式(1)、式(2)分别计算乳化活性及乳化稳定性[15]。
(1)
(2)
式中:EAI为乳化活性/m2/g;ESI为乳化稳定性/min;N为稀释倍数;A0为0 min时吸光度;A10为10 min时吸光度;c为蛋白浓度/g/mL;θ为油体积分数。
1.3.2 起泡性(FA)及泡沫稳定性(FS)测定
取5%鹰嘴豆分离蛋白溶液15 mL,8 000 r/min均质2 min,然后快速转入量筒内,分别记录2 min,30 min的泡沫体积。按照式(3)、式(4)分别计算起泡性和泡沫稳定性[16]。
(3)
(4)
式中:FA为起泡性/%;FS为泡沫稳定性/%;V0为2 min时泡沫体积/mL;V30为30 min时泡沫体积/mL。
1.4 数据处理
各组实验均平行3次,运用Microsoft Excel整理各项指标的测定结果,结果均采用平均值±标准差的形式表示,利用Origin 2018软件绘图。
2 结果与讨论
2.1 鹰嘴豆在萌芽过程中各蛋白含量的变化
由图2可知,随着萌芽时间的延长鹰嘴豆分离蛋白含量呈现先增加后降低的趋势,萌芽96 h达到最大值,为25.22%,约是未萌芽鹰嘴豆种子的1.35倍。说明适当的萌芽可以增加鹰嘴豆种子中分离蛋白的含量,提高其营养价值。
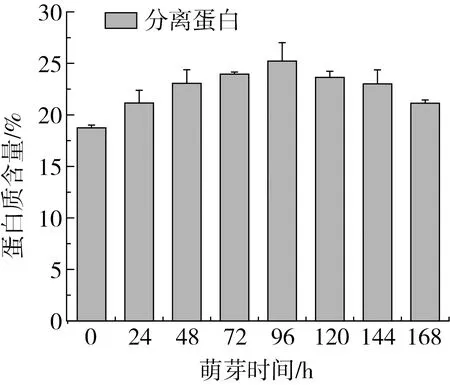
图2 萌芽过程中鹰嘴豆分离蛋白含量的变化
由图3可知,鹰嘴豆蛋白主要为清蛋白(albumin)和球蛋白(globulin),谷蛋白(glutelin)次之,醇溶蛋白(prolamin)含量最少。随着萌芽时间的延长,清蛋白含量先增加后减少,48 h质量分数最高为5.38%。球蛋白含量在萌芽前24 h变化不大,48 h急速下降且含量最低(2.85%),随萌芽时间的延长,球蛋白含量逐渐增加,144 h达到最大值4.23%。醇溶蛋白在鹰嘴豆种子中含量最低,随着萌芽时间的延长醇溶蛋白含量略有增加,96 h达到最大值1.87%。谷蛋白含量随萌芽时间的延长逐渐增加,其质量分数由未萌芽的2.32%增加至3.81%(168 h),约是未萌芽鹰嘴豆种子的1.64倍。
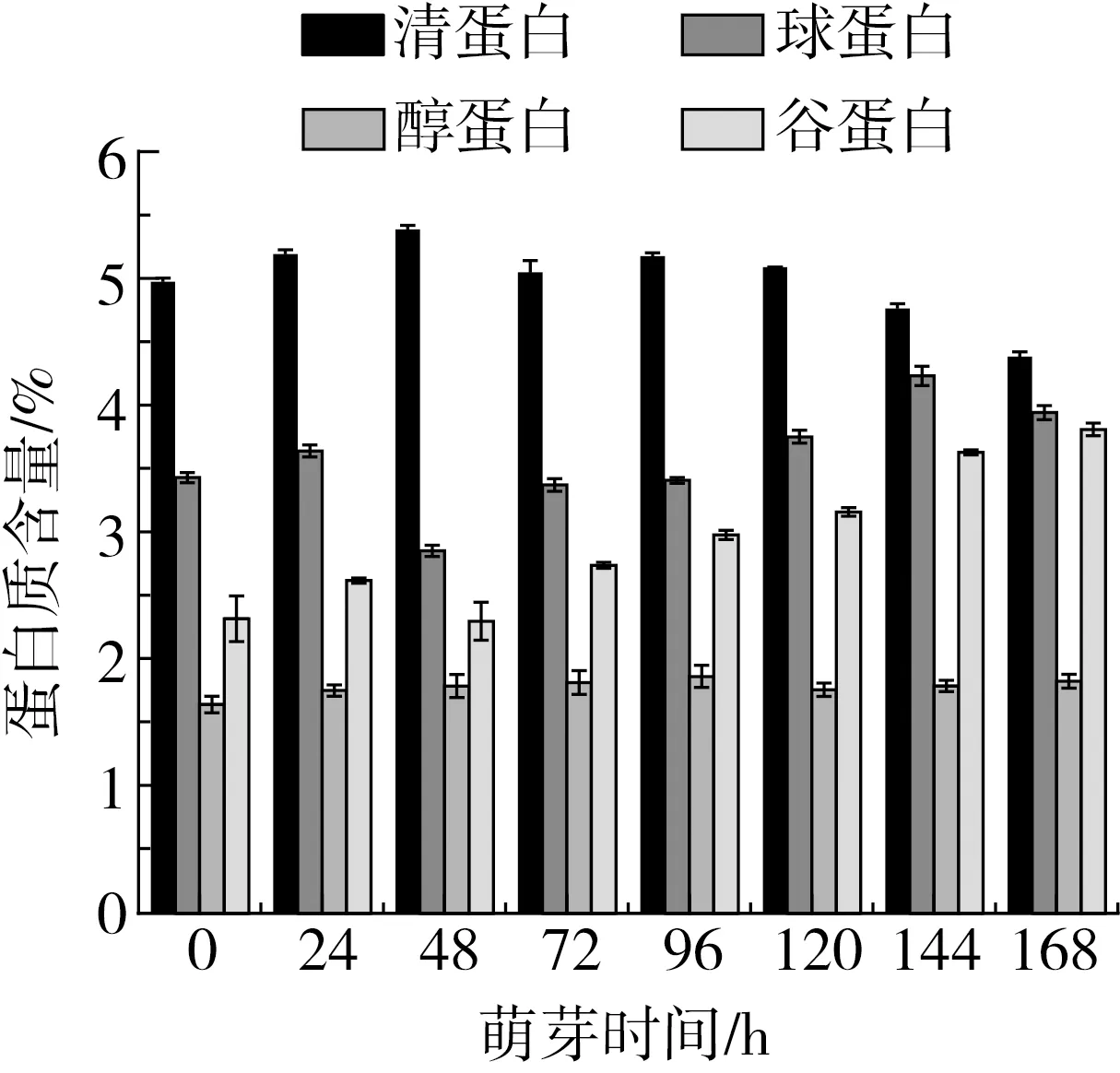
图3 萌芽过程中鹰嘴豆各组分蛋白含量的变化
鹰嘴豆种子经过萌芽后,对4种组分蛋白含量的影响从大到小依次是谷蛋白、球蛋白、清蛋白和醇溶蛋白。鹰嘴豆在萌芽过程中蛋白质含量变化主要是由谷蛋白和清蛋白含量变化引起的。种子萌芽过程中,一些水解酶(蛋白酶、淀粉酶和植酸酶等)被激活,其中也有新合成的酶类,与种子中的储存物质一起作用于幼苗的生长,这一过程导致蛋白质不断被水解和重新合成,进而导致蛋白质组分发生改变[17-19]。赵天瑶等[20]发现绿豆在萌芽过程中清蛋白含量降低,球蛋白含量先升高后降低,醇溶蛋白含量变化不大,谷蛋白含量整体也表现出上升趋势[9]。张美莉等发现荞麦在萌芽过程中清蛋白减少,谷蛋白增加,这与鹰嘴豆在萌芽过程中蛋白质含量变化结果相一致。然而Loureno等[21]研究发现鹰嘴豆在萌芽过程中清蛋白含量呈现下降趋势,球蛋白含量变化不大,盐溶蛋白含量增加,与本研究结果略有不同,这可能是因为采用的鹰嘴豆种子、实验方法不同导致的,研究证明种子萌芽过程中储藏蛋白的降解具有很大种间差异性[22]。鹰嘴豆清蛋白含量在萌芽过程中降低可能是因为清蛋白在种子萌芽过程中发生降解供胚芽生长发育[23]。且种子萌芽过程中清蛋白的降解可以代表球蛋白的储存功能[21],因此在鹰嘴豆萌芽48 h后清蛋白含量降低的同时球蛋白含量在逐渐升高,同样的现象在其他物种间也有表述[24]。鹰嘴豆种子在萌芽过程中呼吸作用更密集消耗了其他成分,导致谷蛋白的相对含量增加[25]。
研究表明面筋蛋白的主要成分是醇溶蛋白和谷蛋白,但醇溶蛋白和谷蛋白在豆类中的含量普遍较低,这是影响食品粘弹性的主要因素[26]。经过萌芽后鹰嘴豆中醇溶蛋白和谷蛋白含量的增加,可以改善鹰嘴豆种子的加工特性,提高其利用率。
2.2 鹰嘴豆在萌芽过程中各蛋白SDS-PAGE电泳分析
2.2.1 鹰嘴豆在萌芽过程中分离蛋白SDS-PAGE电泳分析
鹰嘴豆分离蛋白在萌芽过程中亚基结构变化如图4所示。未萌芽鹰嘴豆分离蛋白电泳图谱从上到下一共8个条带,亚基的相对分子质量分布较广,主要集中在约14.4~82.2 ku[27,28]。
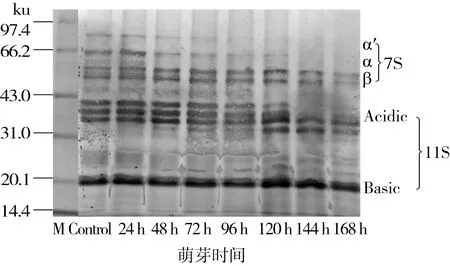
图4 鹰嘴豆分离蛋白在萌芽过程中SDS-PAGE电泳图谱
根据萌芽鹰嘴豆分离蛋白的SDS-PAGE电泳图谱可以发现,鹰嘴豆在萌芽过程中部分亚基条带可以抵抗蛋白酶的水解,即在鹰嘴豆萌芽过程中分离蛋白在SDS-PAGE电泳图谱上条带不发生任何改变。依据条带的宽度和强度可以发现,11 S碱性亚基和7 S β亚基在萌芽过程中始终保持完整,但条带稍有下移这可能是因为在萌芽过程中蛋白质被酶水解成分子质量稍低的多肽[25]。7 S α′和α亚基在萌芽48 h开始降解且随着萌芽时间的延长逐渐消失,同时在48 h时伴随着新的亚基(约35 ku)的出现,之后随萌芽时间的延长该条带含量增加。11 S酸性亚基在萌芽至72 h时含量减少,且随着萌芽时间的延长逐渐被降解。他们分解的同时伴随着新的亚基的产生,在14.4和35 ku处亚基含量增加。同样的蛋白质分解模式在小扁豆、绿豆、大豆和豌豆中均有发现[8,29,30],在种子萌芽初期,蛋白质降解以大分子为主且变化不明显,随着萌芽时间的延长,几乎所有的条带都发生变化,大分子质量的亚基含量减少,甚至在萌芽后期完全消失,小分子的亚基含量增加,甚至出现新的亚基条带,这一现象与前人研究的在萌芽过程中储藏蛋白在有限的区域内降解的研究相符[31]。
种子萌芽过程不仅包含蛋白质结构的变化,同时还伴随着蛋白质功能性质的变化。有研究发现萌芽可以降低大豆蛋白的过敏性,提高易过敏人群食用大豆的安全性,同时提高大豆的营养品质和加工特性[32,33]。如小扁豆在萌芽过程中溶解度、持水性等增加,加工性能得到显著改善[8]。
2.2.2 鹰嘴豆在萌芽过程中清蛋白SDS-PAGE电泳分析
图5所示为鹰嘴豆清蛋白在不同萌芽时间的电泳图谱。由图5可知鹰嘴豆清蛋白亚基分子量约在14~100 ku。根据亚基条带重量和组成成分可知,在萌芽前48 h鹰嘴豆清蛋白几乎不发生亚基条带的降解,且在48 h亚基条带较深,与清蛋白含量测定结果相一致。萌芽至72 h时,亚基条带颜色变浅,尤其是大分子亚基条带从72 h组成成分含量减少,且随着萌芽时间的延长,最大分子亚基条带逐渐消失,其他亚基含量减少,表明鹰嘴豆种子萌芽过程中清蛋白被降解,以供鹰嘴豆幼苗的生长发育。
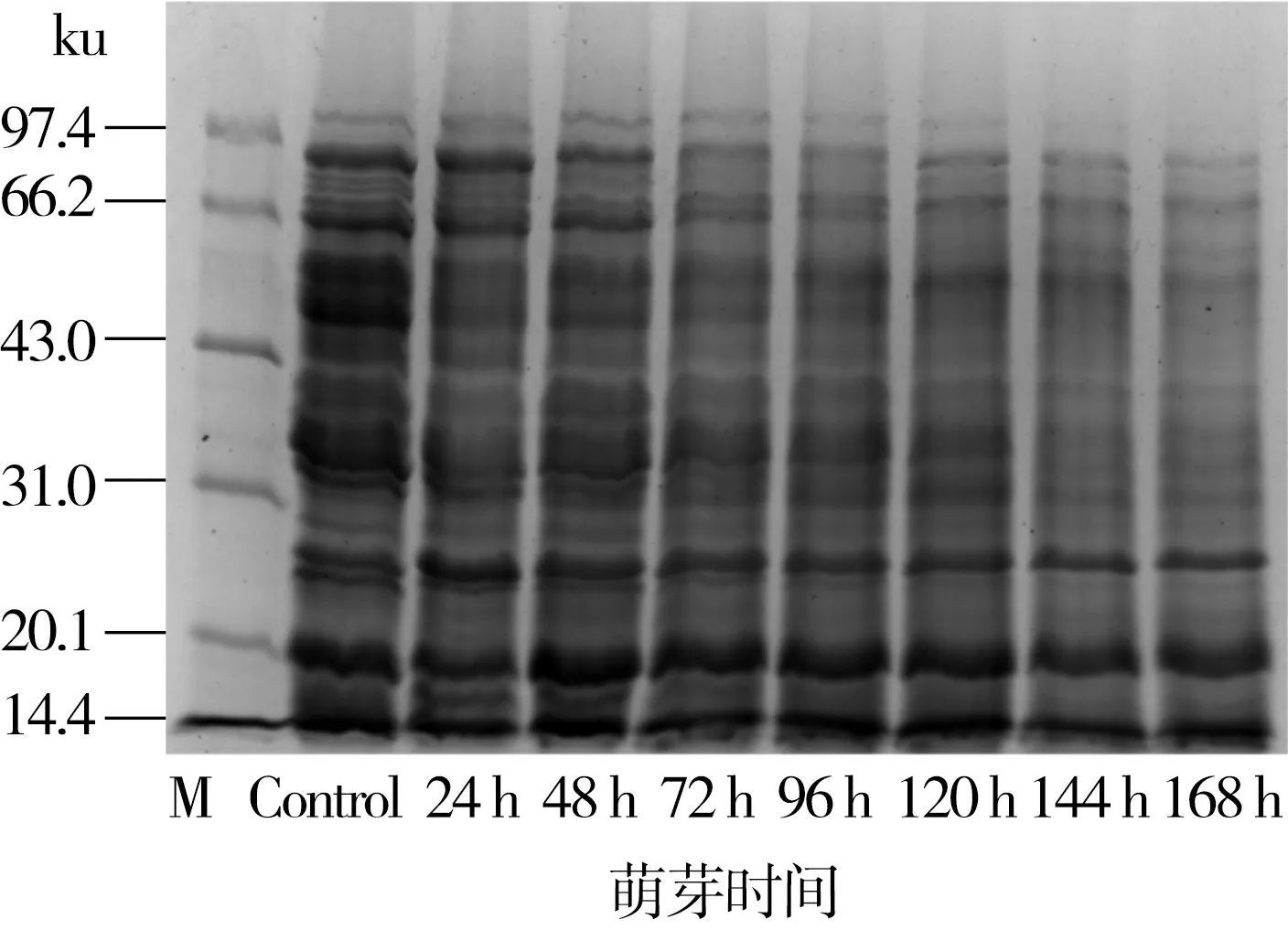
图5 鹰嘴豆清蛋白在萌芽过程中SDS-PAGE电泳图谱
鹰嘴豆清蛋白的SDS-PAGE电泳图谱的表达与鹰嘴豆粉在萌芽过程中清蛋白的含量测定结果相一致,在萌芽过程中清蛋白的含量先增加后降低。有研究发现绿豆清蛋白的消化率较低,因其对胃蛋白酶和胰蛋白酶不敏感,所以是较难消化的蛋白质,但是在萌芽后大分子亚基被降解,进而清蛋白的消化率会提高[9]。萌芽后鹰嘴豆清蛋白大分子亚基被降解,可能有利于鹰嘴豆清蛋白在人体内的消化吸收。
2.2.3 鹰嘴豆在萌芽过程中球蛋白SDS-PAGE电泳分析
图6所示为鹰嘴豆球蛋白在不同萌芽时间的电泳图谱。由图6可知鹰嘴豆球蛋白亚基分子质量约在17~90 ku,主要集中在约17~20.1 ku和31~43 ku,与鹰嘴豆分离蛋白主要亚基分子质量相似。鹰嘴豆萌芽至48 h时亚基组成成分含量基本不变,但在48 h减小,这与球蛋白含量测定结果在48 h时球蛋白含量降低相一致。其中7 S α'亚基自72 h始逐渐减少,α亚基在萌芽过程中先增加后减少,约52~55 ku处亚基含量减少。但约31 ku处亚基含量在萌芽过程中逐渐增加,可能是因为7 S α亚基及α'亚基含有二硫键,二硫键断裂后形成低分子质量的亚基[12],约在31 ku处显现,使该部分亚基含量增加。7 S β亚基及11 S酸性亚基和碱性亚基在萌芽过程中变化不大。根据亚基的组成成分含量变化,可判断鹰嘴豆球蛋白在萌芽过程中降解变化。

图6 鹰嘴豆球蛋白在萌芽过程中SDS-PAGE电泳图谱
2.2.4 鹰嘴豆在萌芽过程中醇蛋白SDS-PAGE电泳分析
图7所示为鹰嘴豆醇溶蛋白在不同萌芽时间的电泳图谱。鹰嘴豆醇溶蛋白主要是小分子亚基(14.4 ku),在萌芽过程中醇溶蛋白亚基组成成分几乎不变,这与萌芽鹰嘴豆粉中醇溶蛋白含量测定结果相一致。有研究显示14.4 ku的亚基中含硫氨基酸含量较高,在萌芽过程中一般很少被植物自身利用,因而在萌芽过程中得以积累[34]。
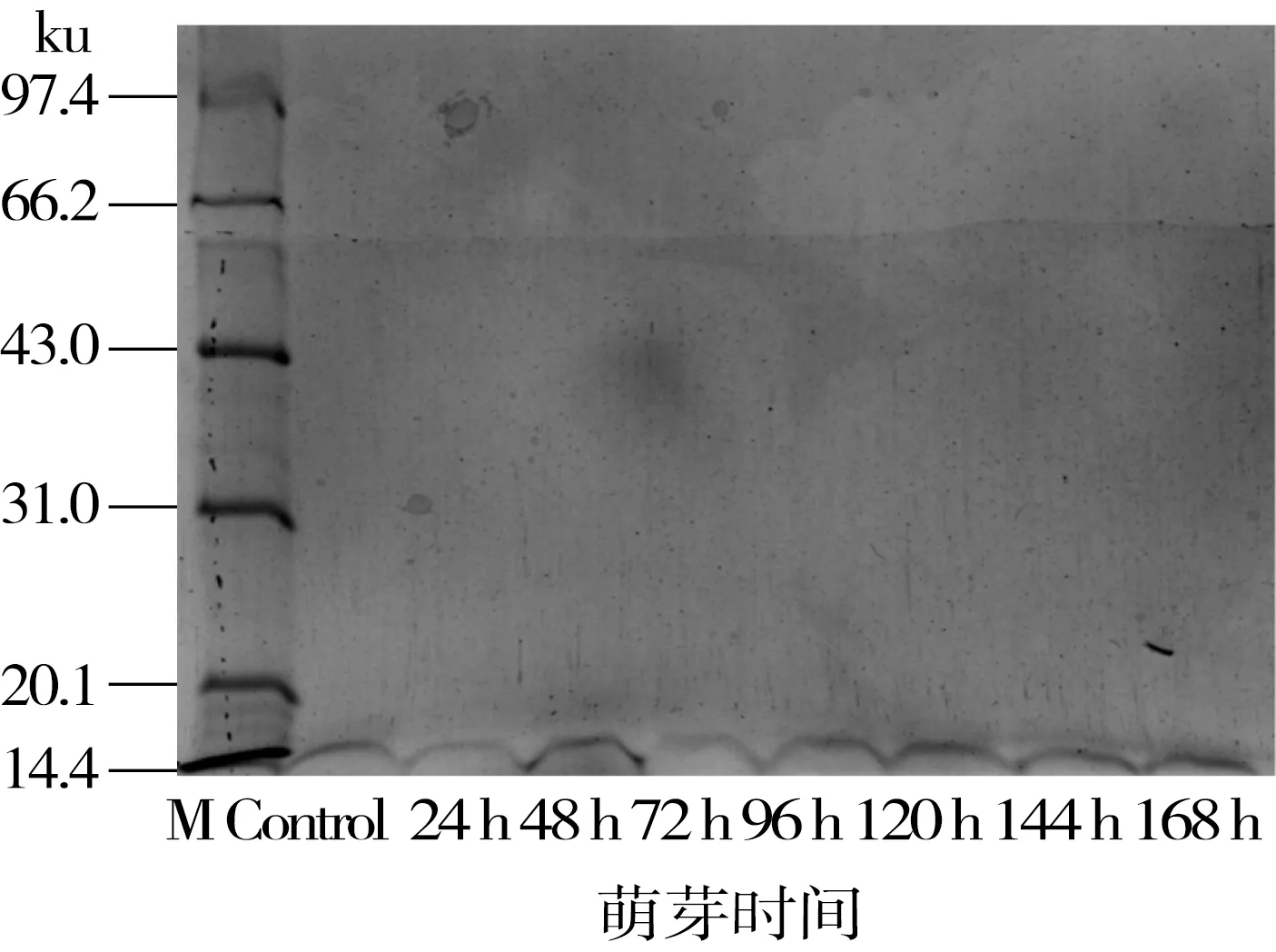
图7 鹰嘴豆醇溶蛋白在萌芽过程中SDS-PAGE电泳图谱
2.2.5 鹰嘴豆在萌芽过程中谷蛋白SDS-PAGE电泳分析
图8所示为鹰嘴豆谷蛋白在不同萌芽时间的电泳图谱。鹰嘴豆谷蛋白亚基分子质量约在17~80 ku,主要亚基分布在约35~41 ku(酸性亚基)和17 ku(碱性亚基)处,这与大多数豆谷种子中谷蛋白主要亚基分布相一致[12,35]。萌芽24 h时各亚基组成成分含量增加,这与谷蛋白含量测定在萌芽24 h时增加相一致。可能是因为萌芽初期蛋白酶等酶类活性被激活,导致24 h亚基含量较高。之后随萌芽时间的延长其中一些大分子亚基不断被降解消耗,另外,出现一些新的小分子亚基(32 ku),且含量不断增加。在整个萌芽过程中,约26 ku处的亚基组成成分含量先减小后增加,可能是因为在萌芽过程中大分子亚基的降解弥补了小分子亚基的缺失。
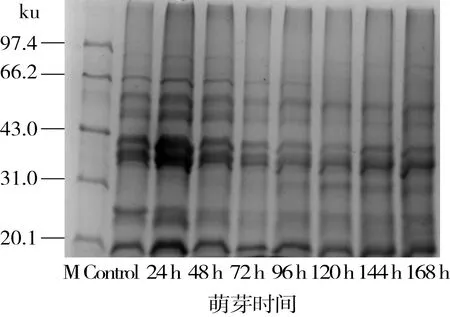
图8 鹰嘴豆谷蛋白在萌芽过程中SDS-PAGE电泳图谱
有研究表明谷蛋白含量与种子加工特性(粘弹性)有密切关系[26],萌芽后谷蛋白含量提高,有助于改善鹰嘴豆蛋白的加工特性,提高其利用率。
2.3 萌芽时间对鹰嘴豆分离蛋白界面性质的影响
2.3.1 萌芽时间对鹰嘴豆分离蛋白乳化性的影响
图9所示为不同萌芽时间鹰嘴豆分离蛋白乳化活性变化。由图可知萌芽使鹰嘴豆乳化活性发生改变,在萌芽初期乳化活性及乳化稳定性逐渐降低,72 h乳化活性最低为13.92 m2/g,之后随萌芽时间的延长逐渐升高,在120 h达到最大值为17.55 m2/g,约是未萌芽鹰嘴豆分离蛋白的1.08倍。与此同时,乳化稳定性也达到最值103.12 min,约是未萌芽的2.27倍。有研究证明分离蛋白乳化活性随7 S/11 S比例增大而增大[36]。根据分离蛋白SDS-PAGE电泳结果来看,在萌芽至72 h前7 S蛋白含量略有降低,因此乳化活性下降;随着萌芽时间的延长,新的小分子亚基产生,促进了乳化活性增强;但随着萌芽时间的持续增加,7 S蛋白含量显著下降,致使乳化活性再次下降。
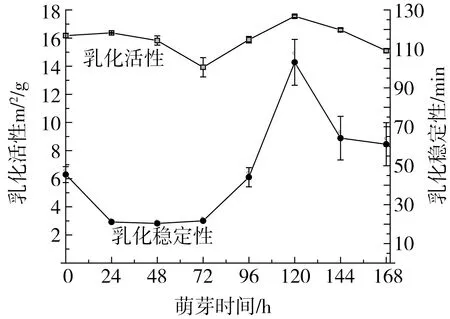
图9 萌芽时间对鹰嘴豆分离蛋白乳化性的影响
2.3.2 萌芽时间对鹰嘴豆分离蛋白起泡性的影响
图10所示为不同萌芽时间鹰嘴豆分离蛋白起泡性变化。由图可知鹰嘴豆分离蛋白起泡性在萌芽前96 h内随萌芽时间的增加逐渐降低,120 h时升高,后又逐渐下降。总体而言,萌芽使鹰嘴豆分离蛋白起泡性降低。分离蛋白的起泡性主要是可溶性蛋白吸附于水-空气界面而降低界面张力的结果[36]。萌芽初期可溶性蛋白含量降低,使鹰嘴豆分离蛋白起泡性降低。在120 h新的小分子亚基条带的出现可能致使起泡性增加。但在萌芽后期,分离蛋白被不断降解,疏水基团持续暴露,致使起泡性下降。
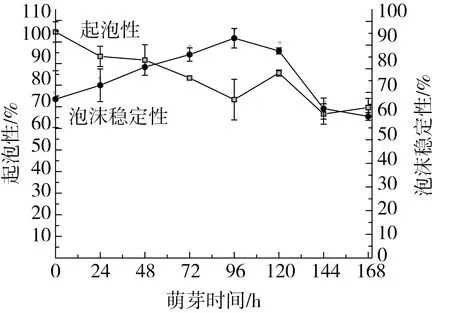
图10 萌芽时间对鹰嘴豆分离蛋白起泡性的影响
萌芽使鹰嘴豆分离蛋白泡沫稳定性先增加后下降,在96 h泡沫稳定性最强(92.92%)。泡沫稳定性主要取决于蛋白质分子内和分子间共价键和非共价键的作用。在萌芽初期,肽链间的作用力增强,致使泡沫稳定性增加。但随着萌芽时间的延长,肽链间的作用力逐渐下降,使其稳定性下降[37]。
3 结论
鹰嘴豆分离蛋白和清蛋白的含量随萌芽时间的延长呈现先增加后降低的趋势,球蛋白含量在48 h最低(2.85%),48 h后随萌芽时间的延长逐渐增加,醇溶蛋白含量略有增加,谷蛋白含量呈现增加的趋势。萌芽不同时期蛋白条带呈现差异性,鹰嘴豆分离蛋白7 S α′和α亚基在萌芽过程中发生降解含量减少,11 S碱性亚基和7 S β亚基基本不变,11 S酸性亚基在萌芽后期减少,48 h出现新的亚基且含量不断增加;鹰嘴豆清蛋白随萌芽时间的延长亚基含量减少;鹰嘴豆球蛋白大分子亚基减少,小分子亚基增加;鹰嘴豆醇溶蛋白亚基含量变化不大;鹰嘴豆谷蛋白各亚基含量在24 h增加,后大分子亚基降解,小分子亚基增加。鹰嘴豆分离蛋白乳化活性和乳化稳定性均先降低后增加之后又逐渐降低,在120 h达到最大值17.55 m2/g和103.12 min;鹰嘴豆起泡性先降低后增加后又降低,泡沫稳定性先增加后降低,在96 h达到最大值(92.92%)。适当萌芽可以提高鹰嘴豆蛋白的加工特性,提高蛋白的消化吸收率,有利于鹰嘴豆蛋白功能性食品的开发与应用。
