基于网络药理学及分子对接探讨“藿香-佩兰-大黄”角药治疗慢性肾衰竭的作用机制
2021-09-26郭建仪马铭悦张春辉庄晓岩张忠胜
郭建仪,吕 静,马铭悦,张春辉,庄晓岩,张忠胜
1.辽宁中医药大学(辽宁 沈阳 110847)
2.辽宁中医药大学附属医院(辽宁 沈阳 110032)
慢性肾脏疾病在发展中国家非常普遍,对国家和社会造成很大负担[1]。慢性肾衰竭(chronic renal failure,CRF)指疾病迁延发展所致的慢性肾脏病,会有肾脏纤维化和萎缩的表现,最终水、电解质、酸碱平衡紊乱,周身脏器受损,危及患者生命[2]。
郭恩绵教授认为CRF发病机制是湿浊毒邪内蕴,损伤肺脾肾三脏,之后侵及心肝,导致五脏虚损,气血阴阳不足,元气虚衰,因此命名为“虚劳水气病”[3]。以“肾虚毒蕴”的病机理论,提出补脾益肾,祛湿化浊,活血散瘀利水的治法,并归纳出角药、药对,分期而治[4]。本文所论“藿香-佩兰-大黄”是郭老治疗CRF常用角药,临床效果显著。“角药”是三味中药协同应用,源于《黄帝内经》“一君二臣,奇之制也”的理论,始见于《伤寒杂病论》[5]。通过分析中药特性,将三味中药合理地配伍,功效变化无穷,如三足鼎立,互为犄角[6]。
“藿香-佩兰-大黄”作为郭恩绵教授治疗CRF常用角药,可有效改善CRF的症状,临床应用非常广泛,但缺少细胞和分子水平阐述。网络药理学是一门综合学科,能够揭示各类药物对机体的调控原理[7]。本文运用网络药理学方法,探析“藿香-佩兰-大黄”角药治疗CRF的核心成分、核心靶点、关键通路及其作用机制,为后续实验研究提供依据与思路。
1 资料与方法
1.1 收集筛选“藿香-佩兰-大黄”活性成分及其作用靶点通过中医药系统药理学平台(TCMSP)寻找三味中药化学组成成分,本文所论藿香为广藿香。以口服利用度≥30%且类药性≥0.18对药物活性成分进行ADME属性筛选以获得活性化合物。筛选出的活性成分,进一步在TCMSP平台筛选其相关作用靶点。查询Uniprot数据库,明确各靶点蛋白相对应的基因名称。
1.2 收集筛选CRF靶点基因以“chronic renal failure”“慢性肾衰竭”为关键词,分别在Genecards数据库、Drugbank数据库、TTD数据库收集与CRF有关的靶点基因。Genecards数据库有Relevance score值表示靶点与疾病关联程度。Genecards数据库得到疾病靶点过多,筛选Relevance score>中位数的疾病靶点纳入分析,若还是过多,再次用此法筛选,最后将3个数据库的靶点基因合并去重。
1.3 获取药物与疾病的共同靶点将得到的“藿香-佩兰-大黄”活性成分靶点基因和CRF靶点基因输入Venny平台,得到交集靶点,构建韦恩图。
1.4 构建蛋白质相互作用(PPI)网络将1.3获取其交集靶点基因提交STRING 11.0数据库,构建初步蛋白质相互作用模型,下载tsv文件,利用Cytoscape对PPI网络进一步分析构图,得到高级PPI网络,再通过Metascape平台得到潜在蛋白质功能模块。
1.5 GO功能、KEGG通路富集分析将交集靶点提交Metascape平台,进行GO和KEGG富集分析。GO包括生物过程(BP)、分子功能(MF)和细胞组成(CC)。各筛选前20个结果,用Bioinformatics作气泡图。
1.6 构建“药物活性成分-疾病靶点-通路”网络筛选与93个交集靶点有关系的活性成分,藿香-佩兰-大黄初步纳入的19个活性成分中排除表1中的DH4。录入角药活性成分、交集靶点、20条KEGG富集通路,在cytoscape 3.7.1中,绘制“药物活性成分-靶点-通路”网络图。
1.7 分子对接验证在Pubchem数据库检索核心成分结构,保存mol格式。利用PDB蛋白质结构数据库,查询并下载核心靶点蛋白的3D结构,保存PDB格式。使用PyMol软件去掉蛋白结构的水分子和小分子配体,然后导入AutoDockTools进行加氢处理,将有效成分和核心蛋白均转成pdbqt格式文件。运行AutoDockTools对核心成分和核心靶点分别进行对接,记录最低结合能数值。
2 结果
2.1 药物活性成分及靶点筛选在TCMSP初步收集藿香化学成分94种,佩兰化学成分60种,大黄化学成分92种,ADME筛选之后得到藿香化学成分11种,佩兰化学成分7种,大黄化学成分10种。再次经过对相关文献及数据库的查询,最终纳入化学成分藿香8种,佩兰7种,大黄7种,藿香成分靶点165个,见表1。佩兰成分靶点84个,大黄成分靶点64个,去掉3者重复值,角药成分靶点共204个。

表1 “藿香-佩兰-大黄”角药活性成分
2.2 药物与疾病交集靶点的获取Genecards数据库收集疾病靶点基因8 258个,数目过多,将score从大到小排列,取中位数,按照Relevance score>中位数加以筛选,反复3次,获得CRF靶点基因1035个,合并Drugbank、TTD数据库去重,共获1 064个靶点基因。利用Venny平台,获取成分和疾病交集靶点,有93个,见图1。
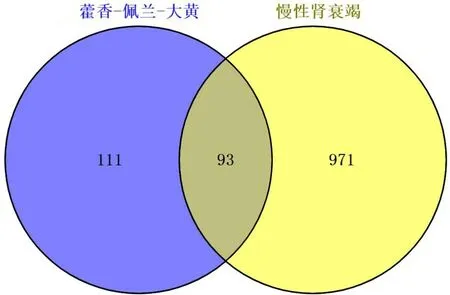
图1 药物-疾病靶点韦恩图
2.3 药物治疗CRF的PPI网络的构建角药与CRF交集靶点共93个,在STRING平台得到初级PPI网络(图2)。下载tsv数据,导入Cytoscape 3.7.1,构建更加清晰的高级PPI网络(图3)。此PPI网络由93个节点和1801条连线构成,节点面积越大,颜色越深,则越重要。Degree值排名前7的节点为AKT1、IL6、TNF、VEGFA、TP53、CASP3、MAPK1,分别是81、75、75、75、73、72、70,这些靶点可能是药物治疗CRF的关键靶点。
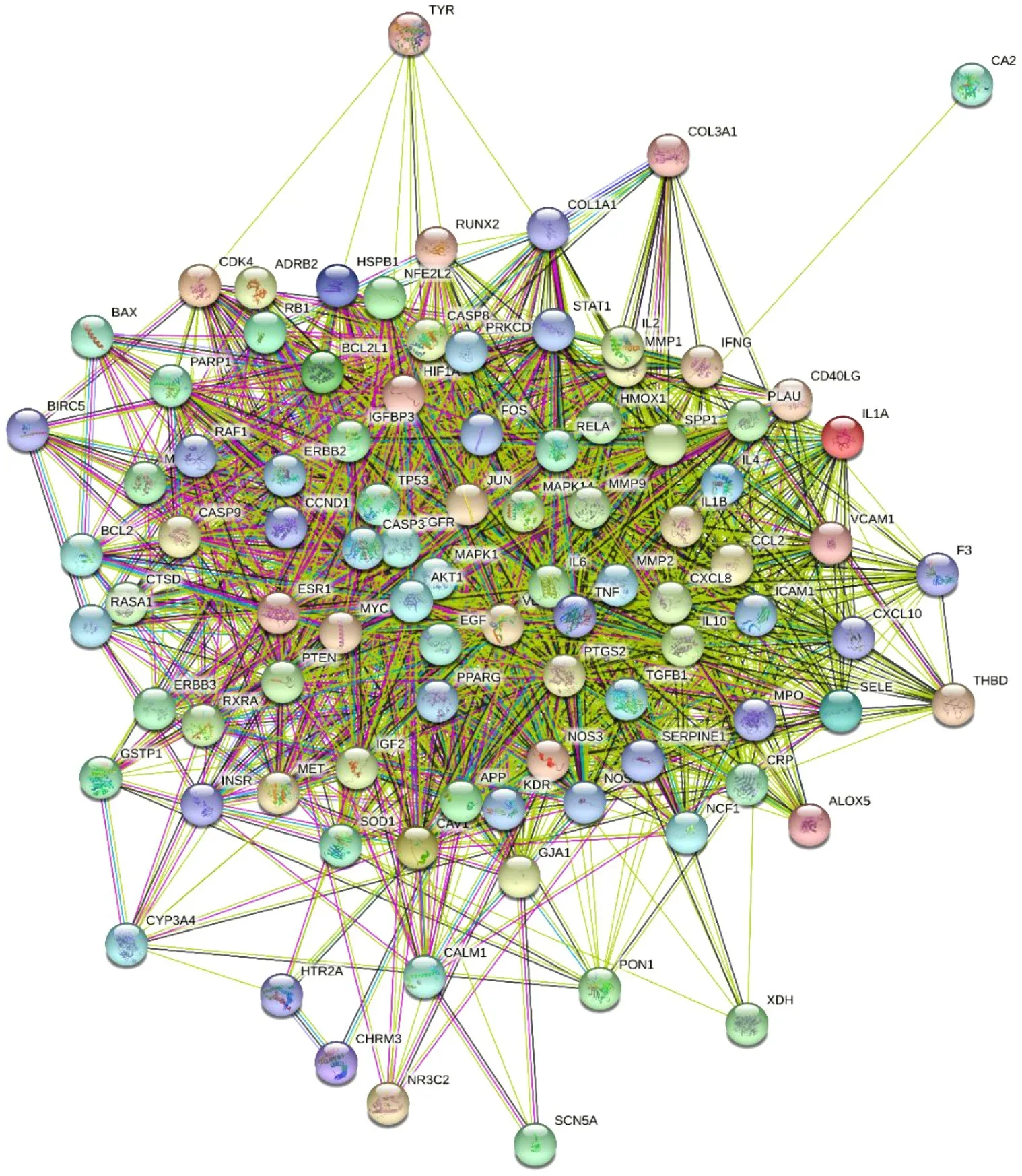
图2 初级PPI图
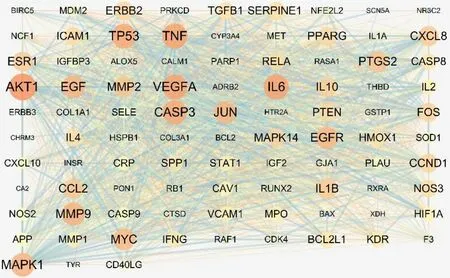
图3 高级PPI图
通过Metascape平台分子复合物检测算法(MCODE)识别其内在module,见图4。根据Log10(P)值,各保留3个最佳生物学进程,见表2。
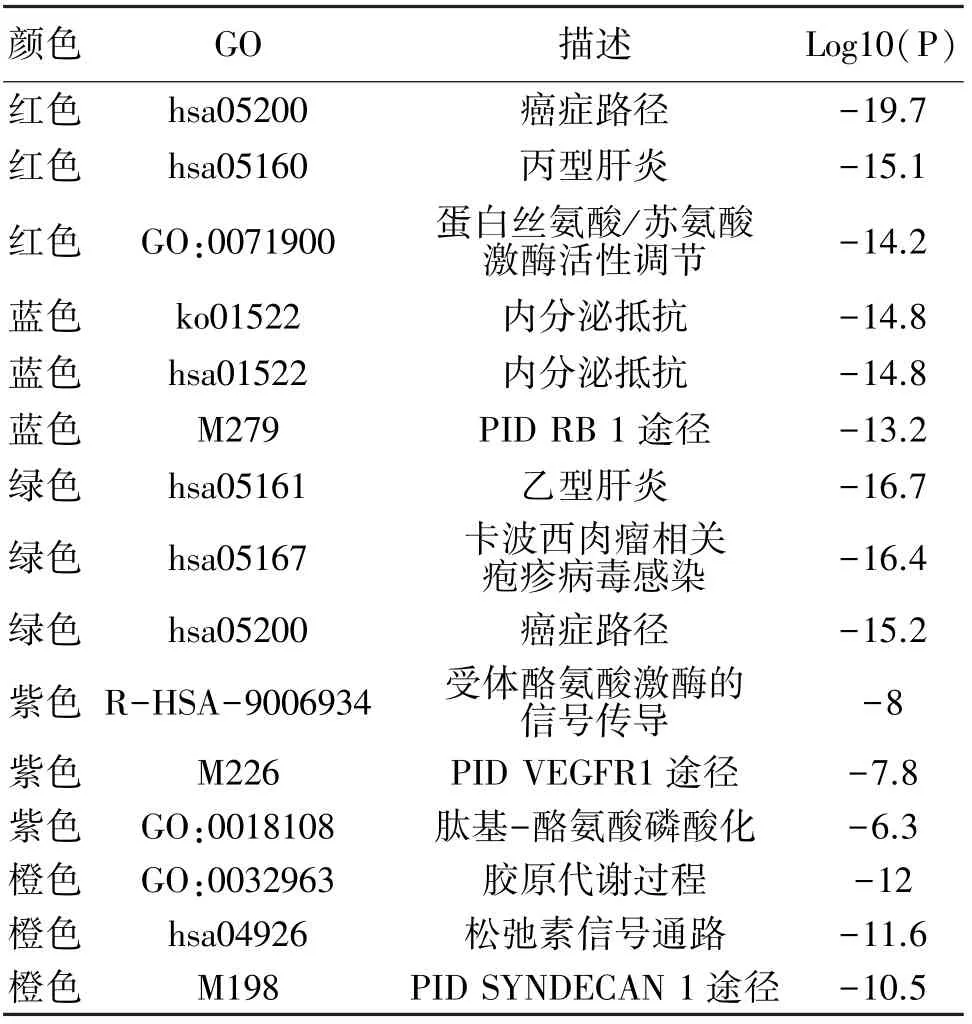
表2 PPI网络module功能描述
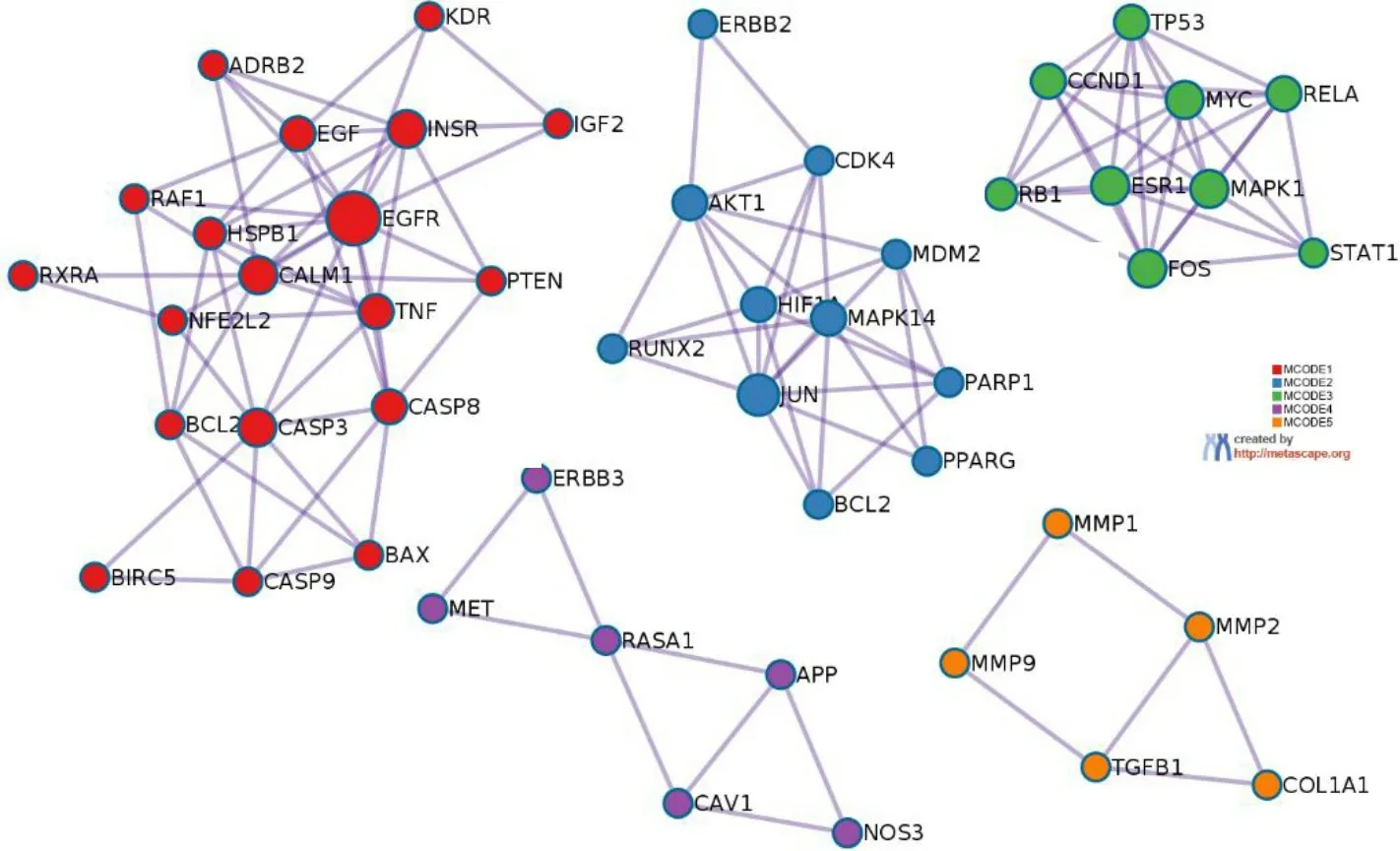
图4 PPI网络的module
2.4 GO功能和KEGG通路富集分析Metascape作GO功能分析,其中CC427个,MF611个,BP5292个;KEGG富集412条通路。分别取前20个,在Bioinformatics平台绘制GO、KEGG气泡图,见图5。图左侧为富集名称,气泡颜色由红到绿代表P值由大到小,气泡越大代表该通路的基因计数越多,横轴代表输入基因占该通路基因的比率。
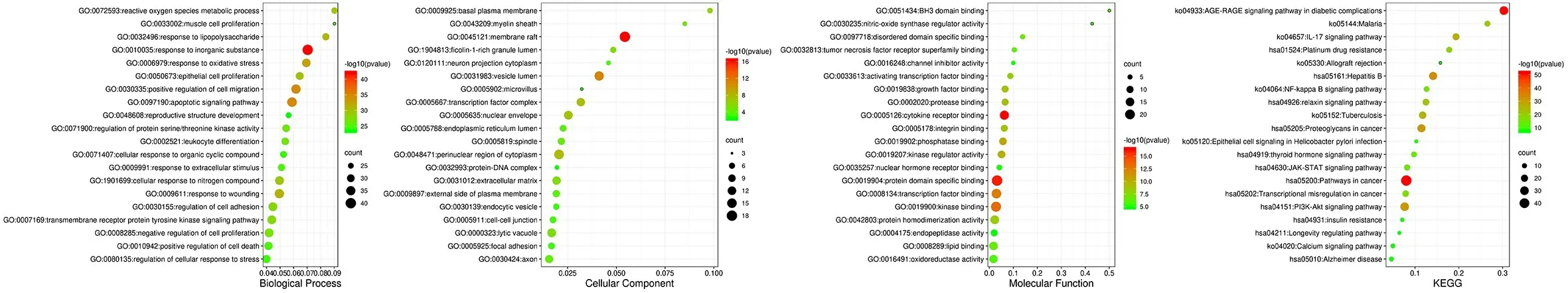
图5 GO、KEGG气泡图
GO富集分析结果:BP主要集中在对无机物的反应、凋亡信号通路、细胞迁移的正向调控等;CC主要膜筏、囊泡腔、细胞质核周区域等;MF主要在激酶结合、细胞因子受体结合、蛋白域特异性结合。
KEGG富集分析结果显示:PI3K-Akt信号通路、糖尿病并发症中的AGE-RAGE信号通路、乙型肝炎、癌症途径等。
2.5 “药物活性成分-疾病靶点-通路”网络图将“藿香-佩兰-大黄”药物活性成分、交集靶点基因、20条KEGG富集通路,上传到Cytoscape,绘制网络图,见图6。其中方形表示关键靶点基因,V形表示通路,圆形表示活性成分。网络图反映出角药治疗CRF有“多成分、多靶点、多通路”的机制。
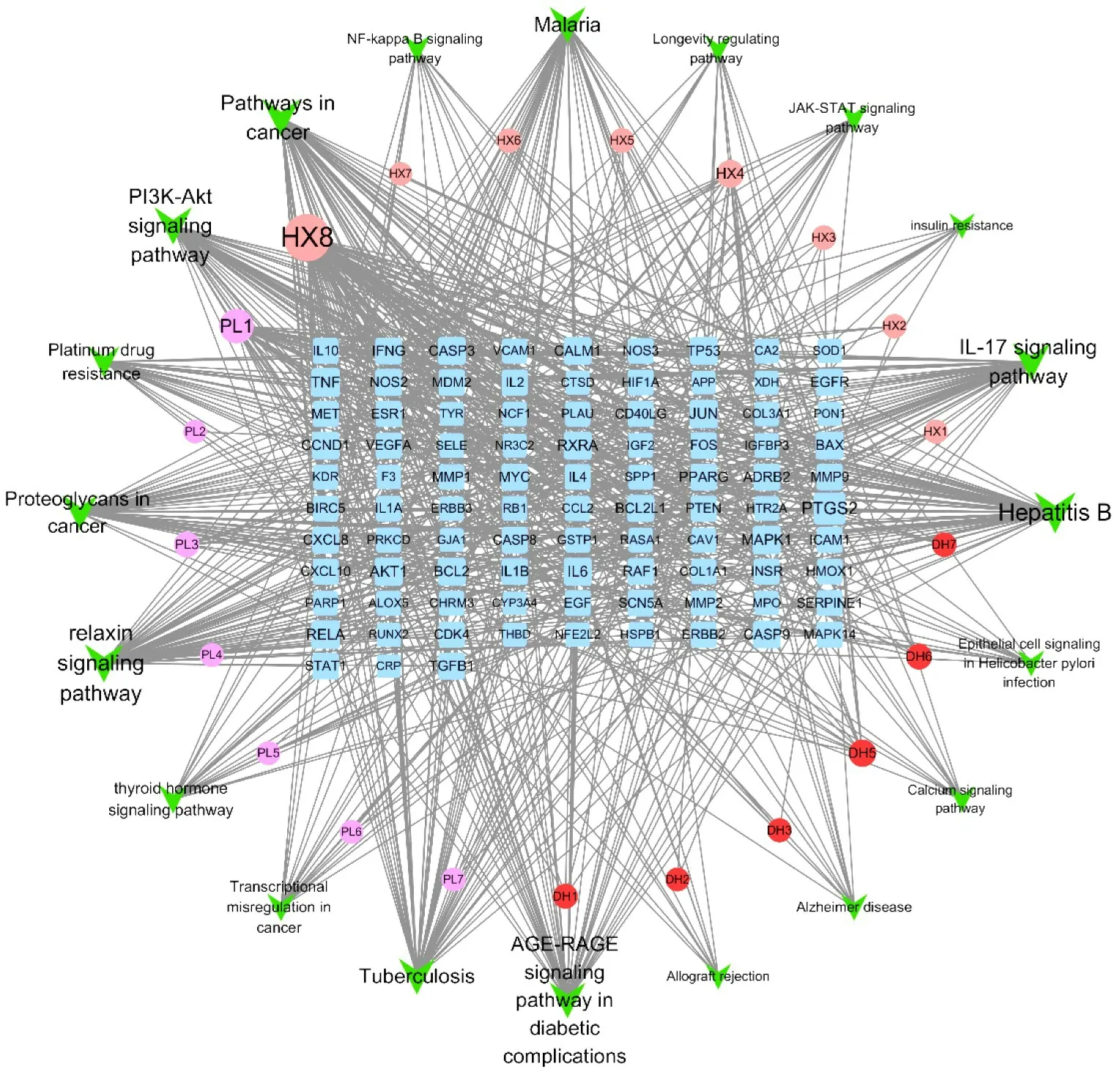
图6 药物-疾病靶点-通路网络图
通过Cytoscape内置的NetworkAnalyzer插件分析角药治疗CRF的网络拓扑学参数,获取核心成分及靶点。槲皮素、木犀草素为核心成分,Degree值分别为76、35。尼泊尔鸢尾异黄酮、β-谷甾醇、豆甾醇、芦荟大黄素为重要成分,Degree值分别为15、13、8、8。PTGS2、RELA、TNF为核心靶点,Degree值为28、17、17。MAPK1、JUN、AKT1、RXRA、IL6为重要靶点,Degree值分别为16、16、16、15、15。
2.6 分子对接根据2.5中获得的核心成分及核心靶点,选择核心成分槲皮素、木犀草素与前3名靶点蛋白进行分子对接,验证作用机制。两者结合自由能越小,表明亲和力越大,越稳定,见表3。

表3 核心成分与靶点蛋白最低结合能
将核心成分与各靶点蛋白结合的化合物,可视化处理,见图7、图8、图9。以上分子对接结合能数值<-7.0,说明核心成分和靶点蛋白结合很稳定,验证了研究结果的准确性。
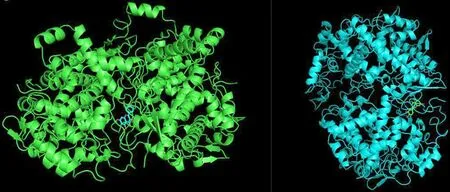
图7 槲皮素、木犀草素与PTGS2的分子对接
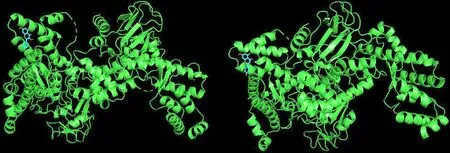
图8 槲皮素、木犀草素与RELA的分子对接
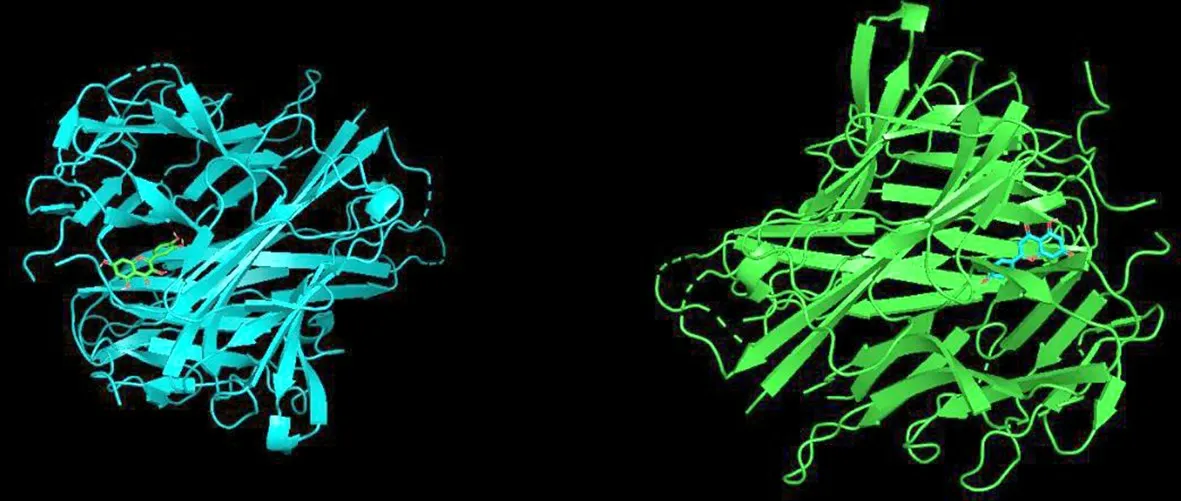
图9 槲皮素、木犀草素与TNF的分子对接
3 讨论
中医并无CRF的直接记载,目前都是依据临床表现,将其归于“癃闭”“关格”“腰痛”“虚劳”等范畴[8]。CRF是肾脏疾病发展的最终结局,表现为五脏皆虚,气血阴阳不足,其中元气虚衰为核心。水气病,首见于《金匮要略·水气病脉证并治》,多指水液代谢类的疾患,以水肿为主要表现[9]。郭老认为CRF源于水气病,又有虚劳之本质,独创将其命名为“虚劳水气病”[3]。认为关键病机是肾虚毒蕴,治疗上以甘温扶阳、补益脾肾为本,再针对浊毒、瘀毒、水毒、湿毒的不同来用药,泄浊解毒是基本治法。临床常用藿香、佩兰配伍大黄芳香化浊、通腑泄毒。藿香振奋脾胃之气,佩兰重在行气,大黄入血分可泄血中之热,化血中之瘀毒;入气分则燥湿攻积,泻火解毒,如此“溺毒”可从血中解,从胃肠中除。三药协作,祛中焦湿气,振脾胃阳气,使邪有所出,体现“魄门亦为五脏使”的理论[10]。
“藿香-佩兰-大黄”角药治疗CRF有效成分中核心成分是槲皮素、木犀草素,核心靶点是PTGS2、RELA、TNF。有研究发现槲皮素可能通过调节氧化应激和iNOs/p38MAPK通路对腺嘌呤诱导的CRF衰竭大鼠有缓解作用[11],还可降低CRF大鼠肾组织及血清EPO值,改善其铁代谢紊乱[12-13];抑制CRF大鼠肾间质炎性细胞浸润[14];防治泌尿功能衰竭[15]。木犀草素目前没有直接对CRF的相关研究,但是CRF与糖尿病肾病有一定联系。木犀草素有抗氧化作用,研究显示[16-17]通过降低肾组织内PAI-1、TGF-β1等表达;上调Nrf2激活抗氧化酶HO-1、SOD、γ-GCS的表达,保护STZ引发的糖尿病大鼠的肾脏功能。尼泊尔鸢尾异黄酮、β-谷甾醇、豆甾醇、芦荟大黄素等重要成分都有抗氧化、抗炎作用。PTGS2又叫做环氧化酶2(cyclooxygenase-2,COX-2),在血管、肾小球、肾小管等表达。有研究显示[18]COX-2在肾血流动力学和电解质稳态中起着至关重要的作用,与肾小球硬化以及肾功能恶化有关。抑制COX-2的过度表达是预防和治疗CRF的有效途径之一[19]。
富集分析显示PI3K-AKT通路、IL-17通路、AGE-RAGE通路、NF-κB通路等。IL-17信号通路在急慢性炎症中发挥着重要作用,有效靶点TNF、PTGS2富集在IL-17信号通路上。有研究显示[20-21]螺内酯和有氧运动都可抑制AGE-RAGE信号通路,减少细胞内氧化应激。RELA是NF-κB家族重要成员,通过乙酰化、甲基化等形式来调节细胞增殖、分化和凋亡相关基因表达,涉及肿瘤、炎症、免疫反应等众多生理和病理活动[22],可调控NF-κB通路抑制细胞凋亡和炎症反应[23]。AKT位于PI3K-AKT通路上,激活后介导多种生物学效应。CRF主要病理改变便是肾脏纤维化,多个研究[24-26]表明土茯苓、抗纤灵水煎剂可以通过抑制PI3K-AKT通路来抑制肾间质纤维化。分子对接结果显示两个核心成分槲皮素、木犀草素与PTGS2、RELA、TNF亲和力很好,结构稳定。
综上所述,通过网络药理学分析,“藿香-佩兰-大黄”角药治疗CRF通过槲皮素、木犀草素等多个成分,作用于PTGS2、RELA等多个靶点,调控PI3K-AKT通路、IL-17通路等多个信号通路,调节免疫及炎症反应、减少氧化应激、改善细胞异常增殖及凋亡,延缓肾纤维化进程,起到保护肾脏作用。对于临床用药提供了理论支持,后期会进一步实验验证。
