蒺藜总皂苷对LPS 诱导的巨噬细胞分泌IL-1β、IL-6、TNF-α、IL-2、NO 的影响和机制①
2021-09-25朱克春
朱克春 马 萍
(成都中医药大学,成都611130)
炎症是一个复杂的过程,是机体对组织损伤或感染而产生的防御反应,炎症反应的发生与机体内炎症相关细胞有关,并伴随多种化学物质的合成和释放[1]。研究表明,多种疾病如心脏病、关节炎、糖尿病、脓毒症等都与炎症有关[2]。炎症反应过程中,巨噬细胞作用广泛,巨噬细胞是一种固有免疫细胞,其可以通过模式识别受体介导天然免疫应答,影响宿主相关炎症因子如IL-1β、IL-6、TNF-α、IL-2和炎症介质NO 的分泌,促进NO 合酶诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达[3]。脂多糖(lipopolysaccharides,LPS)是细胞内毒素的有效成分,是激活机体炎症反应的重要诱导因子[4]。蒺藜又名白蒺藜、刺蒺藜,是植物蒺藜的干燥成熟果实,其含有多种有效成分,其中以皂苷类研究最多[5]。蒺藜总皂苷有抗衰老、调节血脂、抗肿瘤等功效[6]。研究显示,蒺藜总皂苷还具有消炎作用,其可以抑制心肌缺血再灌注、动脉粥样硬化等疾病发生中炎症因子的释放[7]。Toll 样受体4(toll-like receptor-4,TLR4)是一个与炎症有关的调控因子,其是LPS激活诱导的炎症信号转导受体,TLR4表达水平升高后促进炎症反应[8]。目前对蒺藜总皂苷在LPS诱导的巨噬细胞炎症因子释放中的作用还不十分明确。本次实验以巨噬细胞RAW264.7 作为实验对象,探讨蒺藜总皂苷对LPS 条件下巨噬细胞炎症反应中的作用和机制,为明确蒺藜总皂苷抗炎作用提供参考。
1 材料与方法
1.1 材料 Lipofectamine 2000购自美国Invitrogen;巨噬细胞RAW264.7 购自上海复祥生物科技有限公司;蒺藜总皂苷购自西安昌岳生物科技有限公司;IL-6 检测试剂盒、IL-1β 检测试剂盒购自深圳市科润达生物工程有限公司;pcDNA3.1-TLR4 由汉恒生物科技(上海)有限公司构建;TNF-α检测试剂盒、IL-2 检测试剂盒购自广东体必康生物科技有限公司;LPS 购自北京索莱宝科技有限公司;NO 含量检测试剂盒购自上海索桥生物科技有限公司。
1.2 方法
1.2.1 CCK-8 方法检测蒺藜总皂苷对巨噬细胞增殖活性影响 巨噬细胞按照1×106个/孔接种到96孔细胞培养板内,每个孔内添加100 µl 的细胞悬浮液,培养2 h 后,把上清溶液弃掉,加入含有蒺藜总皂苷浓度为0、10、20、40、80、160 µg/ml 的细胞培养液各100 µl,放在37℃的培养箱内孵育培养24 h后,取出培养板,在每个孔内分别加入10 µl的CCK-8溶液,放在37℃继续培养2 h。酶标仪测定450 nm的OD 值。计算细胞存活率。细胞存活率(%)=实验组OD值/对照组OD值×100%。
1.2.2 实验分组处理 巨噬细胞分成Control、LPS、GSTT-L、GSTT-M、GSTT-H 组,Control 组为空白对照细胞;LPS 组在实验开始时用含有LPS 浓度为1 µg/ml 的细胞培养液处理培养;CCK-8 结果表明,10、20、40 µg/ml浓度的蒺藜总皂苷对巨噬细胞无毒性,因此选择10、20、40 µg/ml浓度的蒺藜总皂苷处理巨噬细胞。GSTT-L、GSTT-M、GSTT-H组细胞在实验开始时以含有蒺藜总皂苷浓度为10、20、40 µg/ml和LPS浓度为1 µg/ml的细胞培养液培养。
1.2.3 ELISA 法检测IL-1β、IL-6、TNF- α、IL-2 水平 取已经培养24 h 后的Control、LPS、GSTT-L、GSTT-M、GSTT-H组细胞,连同培养液一起转移到离心管内,以4℃、12000 g离心10 min,收集上清溶液,用ELISA方法检测培养液上清中IL-6、IL-1β、TNF-α、IL-2 含量,步骤完全参照IL-6、IL-1β、TNF-α、IL-2 检测试剂盒说明书进行。
1.2.4 Griess 法检测NO 含量 取已经培养24 h 后的Control、LPS、GSTT-L、GSTT-M、GSTT-H 组细胞,连同培养液一起转移到离心管内,以4℃、12000 g离心10 min,收集上清溶液,按照NO 含量检测试剂盒测定NO的含量。
1.2.5 Western blot 检测iNOS、TLR4 蛋白表达 取已经培养24 h 后的Control、LPS、GSTT-L、GSTT-M、GSTT-H 组细胞,在细胞内添加RIPA 试剂(含有PMSF),12000 g 离心10 min,吸取上清用于BCA 蛋白定量检测。按照20 µg/孔的蛋白上样量进行SDS-PAGE 电泳,选择10% 的分离胶以及5% 的浓缩胶进行电泳,首先以90 V 的电压电泳约30 min 后,此时可观察到溴酚蓝染料进入到分离胶,把电压调整为110 V 继续电泳,肉眼观察溴酚蓝进入到凝胶的底部以后,关闭电源。取出分离胶,将NC 膜裁剪成合适大小,浸泡在转移缓冲液中平衡10 min。以50 V 的电压转膜,转膜放在冰上进行。将NC 膜取出,放在5% 脱脂奶粉溶液中封闭2 h,然后将NC 膜置于TBST 溶液中漂洗3 次,放在一抗稀释液(iNOS抗体以1∶800 稀释,TLR4 抗体以1∶1000 稀释)中,在4℃过夜反应,经TBST 漂洗以后,放在1∶2000 稀释的二抗溶液中,室温结合2 h。ECL显色试剂盒显色,以ScnImage 分析条带的灰度值。GAPDH 作为参照,分析计算iNOS、TLR4蛋白表达水平。
1.2.6 TLR4对蒺藜总皂苷影响LPS条件下巨噬细胞分泌炎症因子和NO 的作用检测 巨噬细胞密度为60% 时,用Lipofectamine 2000将pcDNA3.1-TLR4和pcDNA3.1分别转染到细胞内,以含有蒺藜总皂苷浓度为20 µg/ml 和LPS 浓度为1 µg/ml 的细胞培养液培养,命名为GSTT-M+TLR4和GSTT-M+Vector组。细胞培养24 h后,CCK-8检测增殖,ELISA法测定IL-1β、IL-6、TNF-α、IL-2 水平,Griess 法检测NO 含量,Western blot 检 测iNOS、TLR4 蛋 白 表 达,步 骤 同1.2.5。
1.3 统计学分析 实验数据用SPSS21.0 软件分析,计量资料用±s表示,两组数据间比较用t检验,多组差异比较用单因素方差,P<0.05为差异有统计学意义。
2 结果
2.1 蒺藜总皂苷对巨噬细胞增殖活性影响 见表1,与0 µg/ml 蒺藜总皂苷处理的细胞比较,10、20、40 µg/ml 的蒺藜总皂苷处理后巨噬细胞存活率无显著性变化;80、160 µg/ml 蒺藜总皂苷处理后的巨噬细胞存活率降低。综合考虑,选择对巨噬细胞无毒性的蒺藜总皂苷作后续实验,因此选择10、20、40 µg/ml浓度的蒺藜总皂苷处理巨噬细胞。
表1 蒺藜总皂苷处理后巨噬细胞存活率变化(±s,μg/ ml,%)Tab.1 Changes of survival rate of macrophages treated with gross saponins of tribulus terrestris (±s,μg/ ml,%)
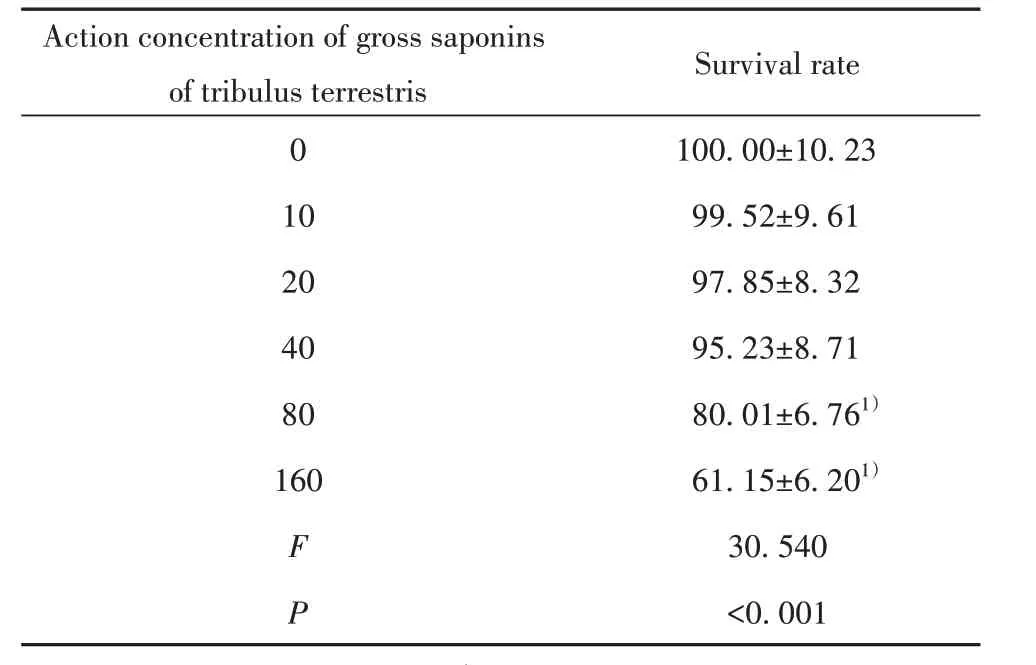
表1 蒺藜总皂苷处理后巨噬细胞存活率变化(±s,μg/ ml,%)Tab.1 Changes of survival rate of macrophages treated with gross saponins of tribulus terrestris (±s,μg/ ml,%)
Note:Compared with 0 µg/ ml,1)P<0.05.
Action concentration of gross saponins of tribulus terrestris 010204080160 F P Survival rate 100.00±10.2399.52±9.6197.85±8.3295.23±8.7180.01±6.761)61.15±6.201)30.540<0.001
2.2 蒺藜总皂苷对LPS 条件下巨噬细胞增殖活性影响 见表2,与Control 组比较,LPS 组巨噬细胞存活率下降(P<0.05);与LPS组比较,GSTT-L、GSTT-M、GSTT-H 组巨噬细胞存活率逐渐升高(P<0.05)。蒺藜总皂苷提高LPS条件下巨噬细胞增殖活性。
表2 蒺藜总皂苷处理后LPS 条件下巨噬细胞存活率(±s,%)Tab.2 Survival rate of macrophages treated with gross saponins of tribulus terrestris induced by LPS(±s,%)
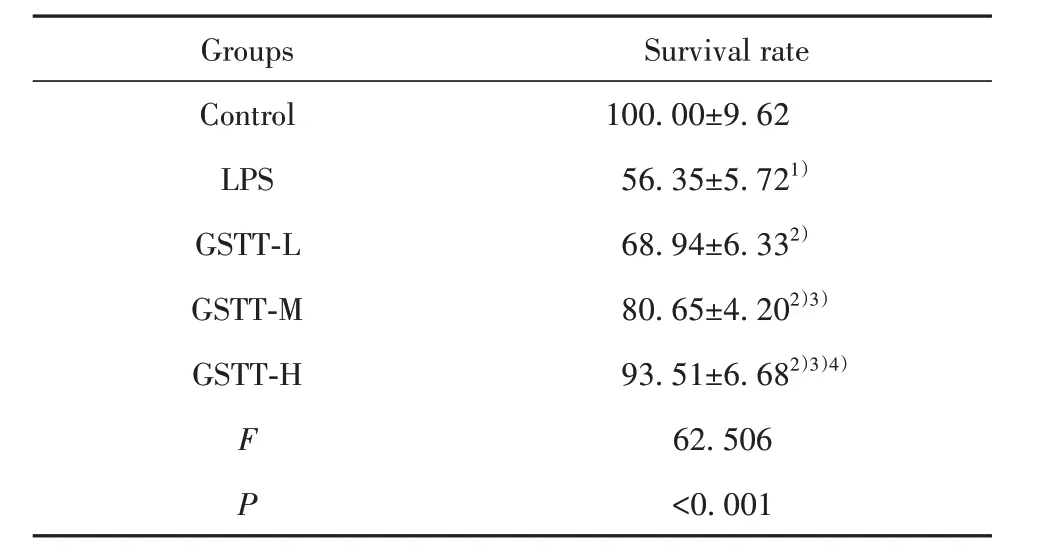
表2 蒺藜总皂苷处理后LPS 条件下巨噬细胞存活率(±s,%)Tab.2 Survival rate of macrophages treated with gross saponins of tribulus terrestris induced by LPS(±s,%)
Note:Compared with control,1)P<0.05;compared with LPS,2)P<0.05;compared with GSTT-L,3)P<0.05;compared with GSTTM,4)P<0.05.
Groups Control LPS GSTT-L GSTT-M GSTT-H F P Survival rate 100.00±9.6256.35±5.721)68.94±6.332)80.65±4.202)3)93.51±6.682)3)4)62.506<0.001
2.3 蒺藜总皂苷对LPS 条件下巨噬细胞分泌IL-1β、IL-6、TNF-α、IL-2 影响 见表3,与Control 组比较,LPS 组巨噬细胞分泌IL-1β、IL-6、TNF-α、IL-2水平升高(P<0.05);与LPS组比较,GSTT-L、GSTTM、GSTT-H组巨噬细胞分泌IL-1β、IL-6、TNF-α、IL-2水平逐渐降低(P<0.05)。蒺藜总皂苷抑制LPS条件下巨噬细胞分泌炎症因子。
表3 蒺藜总皂苷处理后LPS条件下巨噬细胞分泌IL-1β、IL-6、TNF-α、IL-2水平(±s,pg/ ml)Tab.3 Levels of IL-1β,IL-6,TNF-α and IL-2 secreted by macrophages under LPS condition after treatment with gross saponins of tribulus terrestris(±s,pg/ ml)

表3 蒺藜总皂苷处理后LPS条件下巨噬细胞分泌IL-1β、IL-6、TNF-α、IL-2水平(±s,pg/ ml)Tab.3 Levels of IL-1β,IL-6,TNF-α and IL-2 secreted by macrophages under LPS condition after treatment with gross saponins of tribulus terrestris(±s,pg/ ml)
Note:Compared with control,1)P<0.05;compared with LPS,2)P<0.05;compared with GSTT-L,3)P<0.05;compared with GSTT-M,4)P<0.05.
Groups Control LPS GSTT-L GSTT-M GSTT-H F P TNF-α 128.62±12.54246.53±15.581)193.51±12.032)163.87±12.912)3)135.22±10.462)3)4)127.552<0.001 IL-1β 203.61±20.87376.98±22.691)301.78±20.132)256.30±15.472)3)211.34±16.832)3)4)122.738<0.001 IL-635.20±2.69120.84±11.631)89.67±7.222)62.95±5.202)3)40.16±2.252)3)4)254.178<0.001 IL-28.25±0.9635.14±3.201)26.54±2.252)17.46±1.362)3)9.87±0.942)3)4)307.176<0.001
2.4 蒺藜总皂苷对LPS条件下巨噬细胞iNOS和NO水平影响 见图1和表4,与Control组比较,LPS组巨噬细胞NO含量和iNOS蛋白水平均升高(P<0.05);与LPS组比较,GSTT-L、GSTT-M、GSTT-H组巨噬细胞NO含量和iNOS蛋白水平逐渐降低(P<0.05)。蒺藜总皂苷抑制LPS条件下巨噬细胞合成NO。
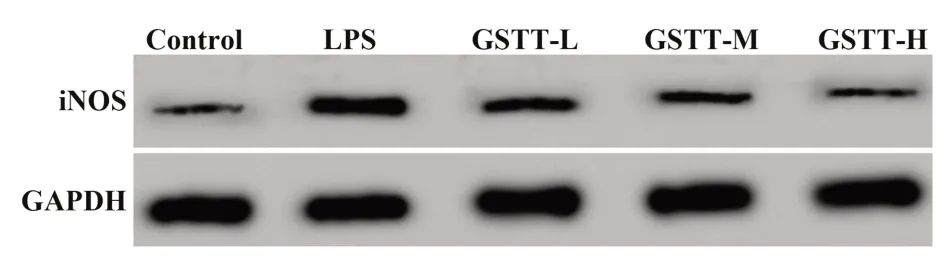
图1 Western blot检测蒺藜总皂苷对LPS条件下巨噬细胞中iNOS蛋白表达影响Fig.1 Western blot was used to detect effect of gross sapo⁃nins of tribulus terrestris on iNOS protein expres⁃sion in macrophages under LPS condition
表4 蒺藜总皂苷处理后LPS条件下巨噬细胞NO含量和iNOS蛋白水平(±s)Tab.4 Contents of NO and iNOS protein in macrophages treated with gross saponins of tribulus terrestris(±s)
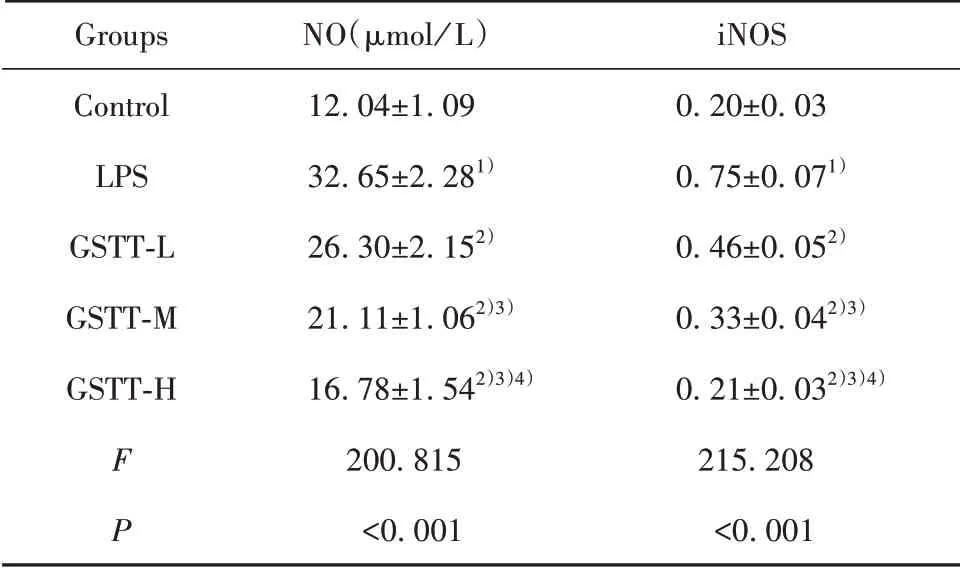
表4 蒺藜总皂苷处理后LPS条件下巨噬细胞NO含量和iNOS蛋白水平(±s)Tab.4 Contents of NO and iNOS protein in macrophages treated with gross saponins of tribulus terrestris(±s)
Note:Compared with control,1)P<0.05;compared with LPS,2)P<0.05;compared with GSTT-L,3)P<0.05;compared with GSTTM,4)P<0.05.
Groups Control LPS GSTT-L GSTT-M GSTT-H F P NO(µmol/L)12.04±1.0932.65±2.281)26.30±2.152)21.11±1.062)3)16.78±1.542)3)4)200.815<0.001 iNOS 0.20±0.030.75±0.071)0.46±0.052)0.33±0.042)3)0.21±0.032)3)4)215.208<0.001
2.5 蒺藜总皂苷对LPS条件下巨噬细胞中TLR4表达影响 见图2和表5,与Control组比较,LPS组巨噬细胞TLR4蛋白水平升高(P<0.05);与LPS组比较,GSTT-L、GSTT-M、GSTT-H组巨噬细胞TLR4蛋白水平逐渐降低(P<0.05)。蒺藜总皂苷抑制LPS条件下巨噬细胞中TLR4表达。
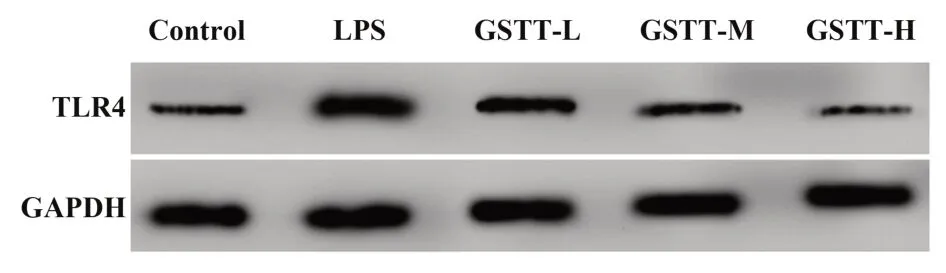
图2 Western blot检测蒺藜总皂苷对LPS条件下巨噬细胞中TLR4蛋白表达影响Fig.2 Western blot was used to detect effect of gross sapo⁃nins of tribulus terrestris on TLR4 protein expres⁃sion in macrophages under LPS condition
表5 蒺藜总皂苷处理后LPS条件下巨噬细胞TLR4蛋白水平(±s)Tab.5 TLR4 protein levels of macrophages treated with gross saponins of tribulus terrestris under LPS condition(±s)
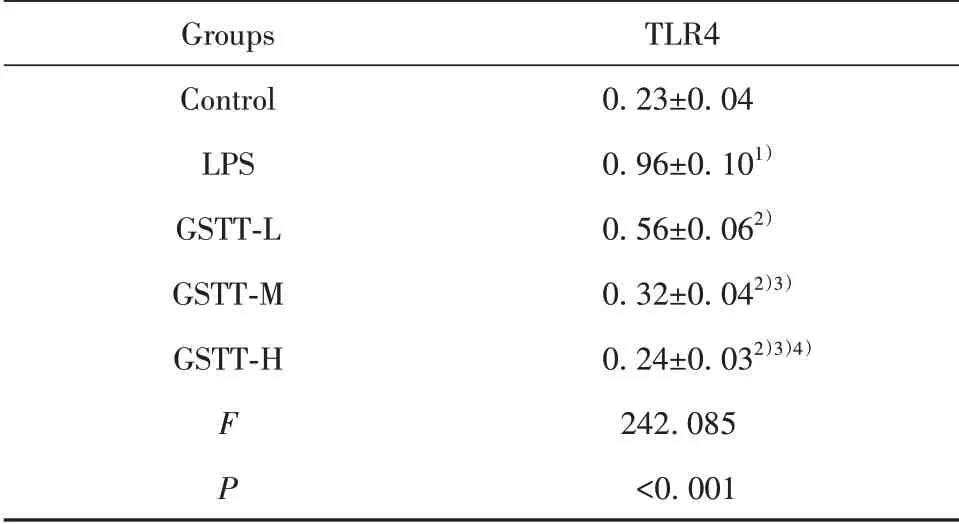
表5 蒺藜总皂苷处理后LPS条件下巨噬细胞TLR4蛋白水平(±s)Tab.5 TLR4 protein levels of macrophages treated with gross saponins of tribulus terrestris under LPS condition(±s)
Note:Compared with control,1)P<0.05;compared with LPS,2)P<0.05;compared with GSTT-L,3)P<0.05;compared with GSTT-M,4)P<0.05.
Groups Control LPS GSTT-L GSTT-M GSTT-H F P TLR40.23±0.040.96±0.101)0.56±0.062)0.32±0.042)3)0.24±0.032)3)4)242.085<0.001
2.6 TLR4对蒺藜总皂苷影响LPS条件下巨噬细胞炎症因子和NO合成作用 见图3和表6,与GSTTM+Vector组比较,GSTT-M+TLR4组巨噬细胞TLR4、iNOS蛋白水平升高,细胞增殖活性下降,细胞分泌的IL-1β、IL-6、TNF-α、IL-2增多,细胞合成的NO增多(P<0.05)。TLR4逆转蒺藜总皂苷对LPS条件下巨噬细胞炎症因子和NO合成影响。
表6 蒺藜总皂苷处理后LPS条件下巨噬细胞存活率和分泌IL-1β、IL-6、TNF-α、IL-2水平以及NO水平和TLR4、iNOS蛋白水平(±s)Tab.6 Survival rate and secretion levels of IL-1β,IL-6,TNF-α,IL-2,NO level and TLR4,iNOS protein levels with TLR4 up-regulated in gross saponins of tribulus terrestris treated macrophages under LPS condition(±s)
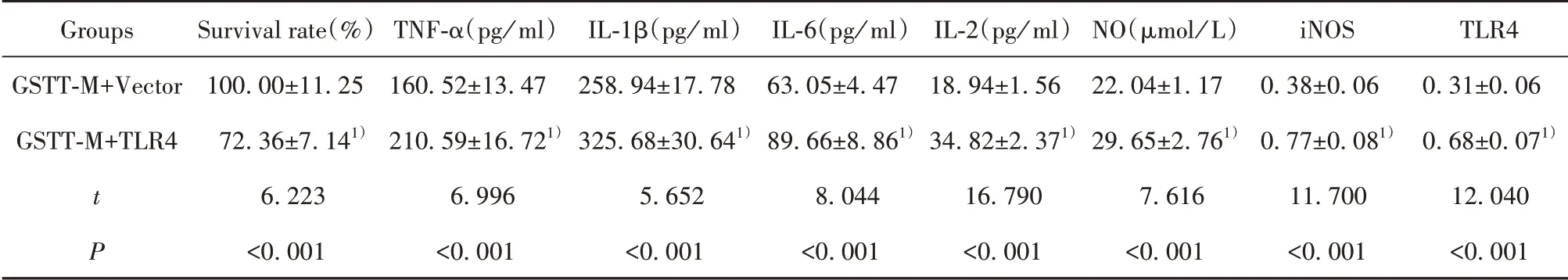
表6 蒺藜总皂苷处理后LPS条件下巨噬细胞存活率和分泌IL-1β、IL-6、TNF-α、IL-2水平以及NO水平和TLR4、iNOS蛋白水平(±s)Tab.6 Survival rate and secretion levels of IL-1β,IL-6,TNF-α,IL-2,NO level and TLR4,iNOS protein levels with TLR4 up-regulated in gross saponins of tribulus terrestris treated macrophages under LPS condition(±s)
Note:Compared with GSTT-M+Vector,1)P<0.05.
Groups GSTT-M+Vector GSTT-M+TLR4 t P Survival rate(%)100.00±11.2572.36±7.141)6.223<0.001 TNF-α(pg/ml)160.52±13.47210.59±16.721)6.996<0.001 IL-1β(pg/ml)258.94±17.78325.68±30.641)5.652<0.001 IL-6(pg/ml)63.05±4.4789.66±8.861)8.044<0.001 IL-2(pg/ml)18.94±1.5634.82±2.371)16.790<0.001 NO(µmol/L)22.04±1.1729.65±2.761)7.616<0.001 iNOS 0.38±0.060.77±0.081)11.700<0.001 TLR40.31±0.060.68±0.071)12.040<0.001
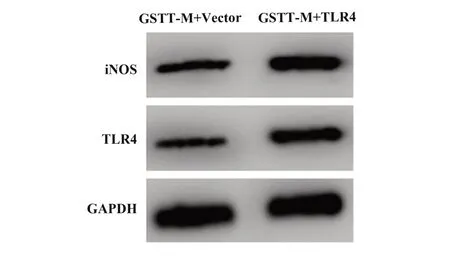
图3 Western blot检测上调TLR4对蒺藜总皂苷影响LPS条件下巨噬细胞中TLR4、iNOS蛋白表达作用Fig.3 Western blot analysis TLR4 and iNOS levels with TLR4 up-regulated in gross saponins of tribulus terrestris treated macrophages under LPS condition
3 讨论
巨噬细胞参与人体免疫反应,其在受到外界因素刺激以后,可以产生并释放大量的炎症因子,这些炎症因子参与机体免疫应答和炎症反应过程,巨噬细胞本身具有多种功能,能够影响各种感染性原因引起的炎症性疾病,巨噬细胞通过引起免疫-炎症反应将病原体排除,调控机体问题[9]。LPS是常见的炎症诱导因子,其可以激活组织和细胞炎症反应,诱导炎症因子释放[4]。NO是存在于机体内的炎症介质,其在炎症反应中发挥重要作用[10]。iNOS是机体内合成NO的重要蛋白酶,主要在巨噬细胞中表达,当巨噬细胞受到LPS等刺激以后,iNOS水平会大大增加,进而合成大量的NO,介导炎症反应[11]。研究表明,LPS处理以后的巨噬细胞增殖活性下降,细胞炎症因子释放水平增加[12-13]。本实验结果显示,LPS刺激以后的巨噬细胞增殖能力下降,细胞分泌的IL-1β、IL-6、TNF-α、IL-2增多,细胞合成的NO增多,细胞中iNOS水平增加,提示LPS诱导巨噬细胞炎症损伤,这为后续实验奠定基础。
蒺藜被称为“草中名药”,是蒺藜科植物蒺藜的干燥果实,具有名目止痒、活血祛风等功效,蒺藜有多种活性成分,如生物碱、黄酮类、皂苷类、无机盐、脂肪酸等等,其中皂苷类的研究最为广泛[6]。现代医学研究发现,蒺藜总皂苷有心血管保护作用,其可以软化血管、调节血脂,对动脉粥样硬化有治疗和预防作用[7]。蒺藜总皂苷还具有消炎、抗菌、抗氧化等功效[14]。蒺藜总皂苷处理后的脑缺血大鼠脑组织中炎症因子表达水平明显下降[15]。本实验用蒺藜总皂苷处理LPS条件下巨噬细胞,结果发现,蒺藜总皂苷能够提高LPS条件下巨噬细胞增殖活性,减少细胞释放IL-1β、IL-6、TNF-α、IL-2,抑制细胞产生NO,提示蒺藜总皂苷具有抗巨噬细胞炎症的作用。
TLR4是Toll样受体家族成员之一,其是Ⅰ型跨膜受体蛋白,包含胞内区、跨膜段、胞外区共3个部分,其基因定位在9q染色体上,在巨噬细胞、单核细胞、中性粒细胞等多种细胞中表达[16-17]。TLR4有多种生物学作用,与免疫反应、炎症、细胞生长等有关,参与脓毒症、糖尿病、肿瘤等多种疾病进展[18-20]。TLR4参与LPS介导的细胞炎症,其是LPS激活信号的转导受体,能够调控TNF-α、IL-6等炎症因子的表达[21-22]。本实验显示,LPS处理后的巨噬细胞中TLR4的表达水平升高,并且蒺藜总皂苷可以降低LPS条件下巨噬细胞中TLR4的表达水平,提示蒺藜总皂苷作用机制可能与TLR4有关。本课题组进一步通过细胞转染的方式提高巨噬细胞中TLR4的表达,结果发现,上调TLR4可以逆转蒺藜总皂苷对LPS条件下巨噬细胞炎症因子分泌和NO合成的影响,这充分证明,蒺藜总皂苷通过下调TLR4的表达抑制LPS诱导的巨噬细胞炎症因子表达。
总而言之,蒺藜总皂苷可以减轻LPS诱导的巨噬细胞炎症,其通过下调TLR4的表达发挥抗炎症作用,这为研究蒺藜总皂苷的药理学作用提供了参考,为研究蒺藜总皂苷在炎症反应中的作用机制提供了资料。后续会继续研究蒺藜总皂苷的具体靶向调控机制。
