诱导性支气管相关淋巴组织(iBALT)在COPD中作用的研究进展①
2021-09-25蔡星璇林娇娇贾俊青
蔡星璇 林娇娇 贾俊青
(山西医科大学附属汾阳医院,汾阳032200)
慢性阻塞性肺疾病(chronic obstructive pulmo‐nary disease,COPD)是一种气流受限为特征的慢性气道炎症性疾病,免疫炎症反应在其中发挥重要作用[1-3]。研究证实,在COPD患者的支气管、肺血管旁以及肺实质中存在以B细胞(B lymphocyte,B)为主的淋巴滤泡,它的结构还包括T细胞(T lymphocyte,T)、树突状细胞(dendritic cell,DC)、滤泡树突状细胞、高内皮小静脉(high endothelial venule,HEV)、淋巴管等。这种淋巴滤泡为异位淋巴组织,属于三级淋巴组织(tertiary lymphoid organ,TLO),现被称为诱导性支气管相关淋巴组织(inducible bronchus-asso‐ciated lymphoid tissue,iBALT)[4],见图1。iBALT是COPD慢性炎症发展的标志之一,其数量与COPD患者肺功能的严重程度成正比[1]。BRACKE等[5]发现健康的吸烟人群中也有iBALT的形成。因此,COPD发生与发展可能与iBALT密切相关,但其产生机制及临床意义尚未完全明确。目前大多数学者认为,在炎症早期,iBALT作为保护性因素能够控制炎症反应,如若炎症反应没有被完全控制,长期的慢性炎症刺激将导致iBALT成为病理性因素,加重COPD患者的免疫炎症反应[2-4]。因此,找到COPD患者中与iBALT相关的标志物及对应靶向药物可以为COPD患者的精准化治疗提供新思路。
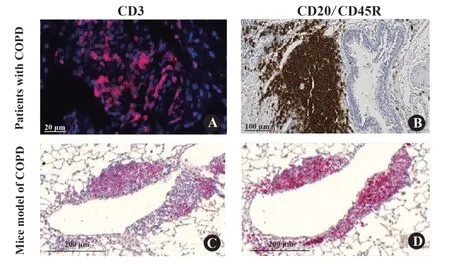
图1 香烟烟雾暴露小鼠模型和COPD患者肺组织中诱导性支气管相关淋巴组织(iBALT)病理学表现图[6-7]Fig.1 Histopathology of inducible bronchus-associated lymphoid tissue(iBALT)in chronic cigarette smoke exposed to mice and patients with COPD[6-7]
1 iBALT的形成过程
支气管相关淋巴组织(bronchus associated lym‐phoid tissue,BALT)是嵌入大气道壁上的次级淋巴组织,分布于各肺叶的支气管上皮下,是发生黏膜免疫的主要场所[8]。与经典的BALT不同,iBALT不是固有存在的,仅在诱导的情况下产生。iBALT的诱导因素包括抗原(antigen,Ag)暴露类型和时间、早期细胞因子信号、下游炎症介质以及Ag诱导的辅助T细胞的反应类型[4,9]。iBALT的形成过程为免疫细胞的模式识别受体(pattern recognition receptor,PRR)识别病原体的相关分子模式(pathogen-associ‐ated molecular patterns,PAMP),从而诱导特定的趋化因子及细胞因子发生级联反应,它们募集B细胞、T细胞为主的免疫细胞发生局部免疫反应,并且上述免疫细胞通过C-X-C趋化因子配体(chemokine CX-C motif ligand,CXCL)(CXCL13)、C-C趋化因子配体(chemokine C-C motif ligand,CCL)(CCL19/CCL21)和HEV上独特的黏附分子促使外周血B细胞、T细胞进一步聚集,形成iBALT的生发中心(ger‐minal center,GC)。GC进一步诱导免疫细胞分泌细胞因子如IL-23、IL-22、IL-17、TNF-α、IL-13、IL-6等,它们在肺部感染期间驱动和维持iBALT的形成,并且还诱导幼稚T细胞向特定的T辅助亚群分化。iBALT通过白细胞和基质细胞(包括上述炎症细胞、免疫细胞等)之间的相互作用维持动态平衡。当急性炎症发生时,iBALT可快速有效诱导免疫反应[4,10]。
2 COPD患者iBALT的标志物及相关药物靶点
目前参与iBALT形成的标志物分为三类:①B细胞相关的标志物:B细胞活化因子(BAFF)/增殖诱导配体(APRIL)、CXCL13/CXCR5;②T细胞相关的标志物:Th2/Th17、IL-1;③T细胞和B细胞共相关的标志物:病毒诱导的受体2(EBI2)/7α,25-二羟基胆固醇(7α,25-OHC)、中性粒细胞,它们均在iBALT的形成中发挥重要作用,见图2。
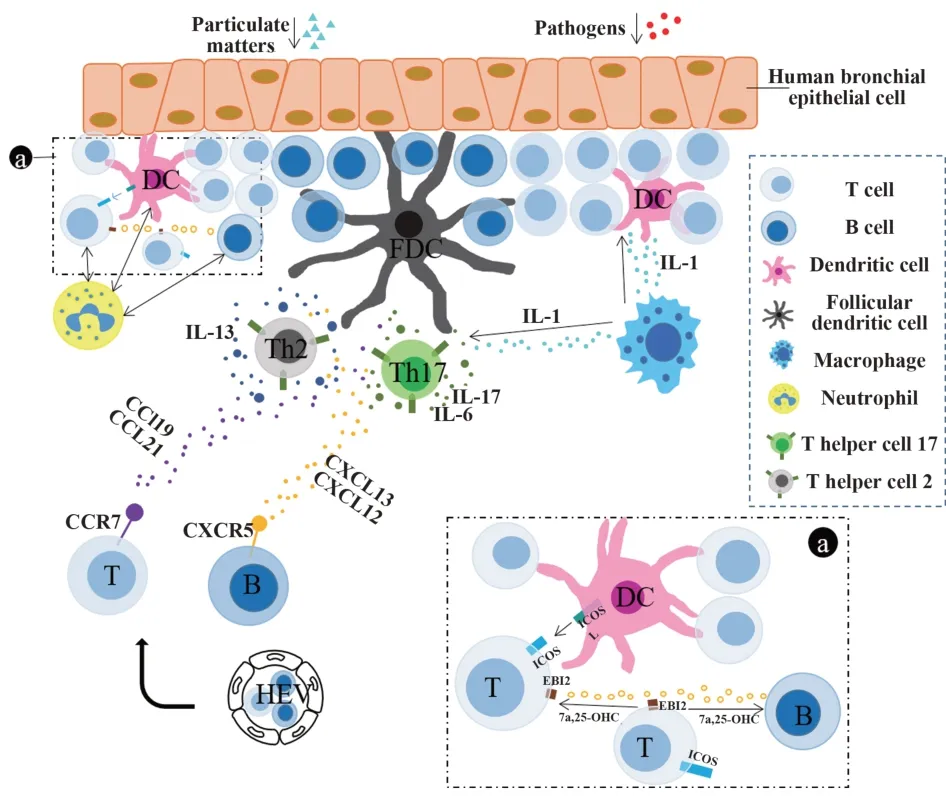
图2 标志物与iBALT关系图Fig.2 Relationship between biomarkers and iBALT
2.1 B细胞相关的标志物
2.1.1 BAFF/APRIL iBALT的结构主要以B细胞为主,B细胞通过IL-10诱导巨噬细胞活化和基质金属蛋白酶12(MMP12)的上调参与COPD的发病,所以B细胞可作为探测及治疗iBALT的靶细胞,从而为COPD患者的治疗提供了新的机制[4-5,7]。BAFF通过结合B细胞受体激活B细胞,并且促进B细胞的增殖、分化和成熟[1,11],见图3。SEYS等[12]发现,小鼠模型中应用可溶性融合蛋白拮抗BAFF减少了肺中B细胞数量,阻止了香烟烟雾诱导iBALT的形成,减轻了肺部炎症和肺泡壁的破坏,同时阻止抗体滴度的增加。上述发生机制可能是拮抗BAFF阻止了B细胞在T细胞群中的定位,同时也减少T细胞的数量及抑制T细胞分泌细胞因子,从而阻止肺组织被破坏[13]。APRIL和BAFF具有高度的同源性,参与支气管黏膜的抗感染免疫,APRIL增多会促进自身抗体产生,发生自身免疫反应,因此推测,APRIL也可 能 参 与iBALT的 形 成[10,14]。APRIL和BAFF同iBALT的作用相似,一方面控制急性炎症发展,一方面在慢性炎症的刺激下导致局部免疫炎症的发生和自身抗体滴度的增加,所以对于COPD患者的治疗,必须更好地把握APRIL及BAFF的免疫激活和免疫抑制之间的平衡[15]。同时最新研究发现,血清中羰基修饰蛋白可作为自身抗体形成的标志物,且羰基修饰蛋白抗体的效价与COPD的病情程度成正比,因此自身抗体可作为预测稳定期或进展期COPD临床表型的生物学标志物[2]。目前与iBALT相关的自身抗体包括抗核抗体、抗环瓜氨酸肽抗体、抗内皮细胞抗体、类风湿因子、抗支气管上皮细胞抗体等[2,14,16]。药物治疗方面,靶向药物共同抑制BAFF和APRIL并没有减弱靶器官中自身抗体沉积的炎症反应,而单独抑制BAFF却可以,并且会影响iBALT的形成[2,11]。目前抑制BAFF的药物在合并间质性肺炎的类风湿性关节炎患者、COPD合并肺癌患者中取得了很好的疗效,例如:抗CD20单抗(Rituximab)、BAFF抑制剂(Belimumab),但是还未在无合并症COPD患者中应用[2,17]。
2.1.2 CXCL13/CXCR5 CXCL13是BALT的B细胞区域基质细胞分泌的信号蛋白,CXCL13与其受体CXCR5结合,诱导B细胞定向趋化形成iBALT。此外,CXCL13还通过上调B细胞上的淋巴毒素参与GC的形成,GC进一步诱导B细胞分泌CXCL13形成iBALT。LITSIOU等[18]证实,COPD患者中CX‐CL13水平与iBALT的密度呈正相关,但是RAN‐GEL-MORENO等[19]研究发现,肺中不表达CXCL13不会影响iBALT的形成,仅影响其维持,EDDENS等[9]证实上述差别的原因是CXCL13的表达与病原体的类型相关。目前发现可引起CXCL13产生并导致iBALT形成的病原体包括:真菌(肺孢子虫)、蠕虫、细菌(铜绿假单胞菌、金黄色葡萄球菌、肺炎克雷伯菌)、病毒(流感、改良痘苗病毒安卡拉、腺病毒、SARS冠状病毒、呼吸道冠状病毒)、特殊菌(结核分枝杆菌、支原体)、微生物产品、颗粒污染物和其他炎症刺激等[9,20]。因此,CXCL13参与iBALT的形成与病原体的种类相关。此外,FRIJA-MASSON等[21]发现,在重复吸入热灭活的铜绿假单胞菌诱导了淋巴滤泡聚集后,并没有发现iBALT的GC结构以及CXCL13的表达,由此证明iBALT的形成与刺激类型相关。因此,未来应该研究免疫细胞诱导的趋化因子在不同病原体或不同刺激类型的影响下对淋巴组织形成的作用,从而进一步了解CXCL13/CXCR5与iBALT的关系。目前CXCL13/CXCR5的靶向药物:抑制Ⅰ型干扰素信号的药物(通过抑制Ⅰ型干扰素可直接抑制CXCL13):抗干扰素α单克隆抗体(Sifalimumab、Rontalizumab)[19],这类药物在自身免疫性疾病的TLO中已取得较好的临床疗效,但是应用于COPD患者,其安全性及有效性还需进一步研究。
2.2 T细胞相关的标志物
2.2.1 Th2/Th17 COPD患者1秒用力呼气容积占预计值百分比与Th17呈负相关,并且COPD患者Th17细胞占总CD4+T细胞的比例(中位数1.90%)显著升高[22],因此Th17可能为COPD的致病因素。目前研究已经证实IL-17(Th17分泌)通过CXCL12介导B细胞的聚集,刺激趋化因子的产生(CXCL13,CCL21/CCL19),同时刺激局部基质细胞的分化,上述细胞因子共同参与iBALT的形成[11,22]。此外,与Th17相关的细胞因子IL-22调节CXCL13的产生,并参与呼吸道及肠道上皮修复以及结肠、肺中TLO的形成[9];IL-6(Th17分泌)和IL-13(Th2分泌)联合诱导CXCL13表达;γδT细胞促进IL-17A和IL-13的分泌,CXCL13、IL-17A、IL-13进一步又促进iBALT形成[9]。综 上 所 述,Th2/Th17细 胞 可 能 协 同 参 与iBALT的形成,但事实上,IL-17主要参与iBALT的启动,其对已建立的iBALT结构几乎没有影响[6]。因此,Th2、Th17亚群对iBALT的促进作用及机制还需进一步明确。Th2/Th17的共同靶向药物包括:维生素D,OX40/OX40L阻断剂(GBR 830单克隆抗体、KHK4083),组胺4受体抑制剂(ZPL-3893787)等。Th17的靶向药物包括:IL-17A阻断剂(bimeki‐zumab),IL-17C阻断剂(MOR106),IL-6阻断剂(sil‐tuximab、tocilizumab)等。Th2的靶向药物包括:JAK抑制剂(baricitinib、upadacitinib),IL-13阻断剂(leb‐rikizumab)等。上述药物在免疫疾病的治疗中起至关重要的作用,其中,维生素D可以改善COPD患者的肺功能及炎症指标[23-24];Lebrikizumzb可以轻度改善哮喘患者1秒用力呼气容积;OX40/OX40L调节CD4+T细胞活化,阻断它的活性对哮喘及COPD的患者均有疗效[25]。其余药物在其他免疫性疾病的临床试验中也取得一定疗效,但还需进一步验证。
2.2.2 IL-1 IL-1过度活跃于各种疾病(如类风湿性关节炎、COPD)中,驱动炎症细胞因子,并且参与TLO的形成[26]。可能的机制包括:①IL-1诱导内皮黏附分子的表达从而产生CXCL13,IL-1还诱导γδT细胞和Th17产生IL-17,CXCL13、IL-17参与形成iBALT级联反应的一部分。②IL-1受体(IL-1R)驱动单核细胞分泌为DC样表型的细胞因子,DC的耗尽会导致现有iBALT的消失[16]。IL-1的靶向药物有:IL-1拮抗剂(IL-1RA)、IL-1β拮抗剂(Canakinum‐ab),不过上述药物对于COPD患者的临床疗效一般[27],但是IL-1对于iBALT的启动至关重要,因此未来对于IL-1在COPD患者中的应用还需进一步研究。
2.3 B细胞和T细胞共相关的标志物
2.3.1 EBI2/7α,25-OHC胆固醇与EBI2在25-羟化酶(CH25H)、胆固醇25α7羟化酶(CYP7B1)的作用下合成7α,25-OHC,然后7α,25-OHC被3β羟基delta5类固醇脱氢酶(HSD3B7)代谢成3-氧代衍生物。CH25H、CYP7B1在香烟烟雾诱导的小鼠模型和COPD患者中显著表达,它们主要定位于气道上皮。其次,缺乏CH25H、CYP7B1、EBI2表达的COPD小鼠模型不会形成iBALT,并且进一步阻止COPD的 发 展[28]。目 前 可 能 的 机 制 如 下:①CH25H、CYP7B1、HSD3B7在淋巴样基质细胞中大量表达,同时CH25H、CYP7B1产生7α,25-OHC的浓度梯度会影响B细胞运动[29];②EBI2/7α,25-OHC介导活化的CD4+T细胞在淋巴滤泡-T区界面定位,并且与DC相互作用促进辅助性T细胞与诱导性协同共刺激分子结合,进而促进GC的形成[30]。因此,EBI2/7α,25-OHC与iBALT息息相关。目前影响EBI2/7α,25-OHC轴途径的药物包括:维生素D(抑制CH25H)、克霉唑(抑制CYP7B1)、二甲双胍(影响胆汁酸的代谢)、他汀类(影响胆固醇水平)[28,31-33],这些药物近年来在COPD患者中的应用也取得一定疗效[24,34]。所以EBI2/7α,25-OHC代谢轴中与iBALT相关的标志物可能是未来有效治疗COPD的靶目标。
2.3.2 中性粒细胞 中性粒细胞被认为是急性炎症反应的最终效应细胞,同时也是固有免疫和适应性免疫效应器的关键组成部分,参与感染、自身免疫、慢性炎症和癌症等。LIEW等[26]证明,在COPD患者中,中性粒细胞维持B细胞的活化和增殖,从而促进iBALT的形成,同时中性粒细胞的耗竭显著减少了鼻内注射脂多糖后iBALT区域的大小和数量。此外,急性全身性炎症期间,中性粒细胞可抑制T细胞的增殖和激活,反之调节性T细胞的耗竭又会减少诱导的中性粒细胞数目,上述两种情况均会影响iBALT的形成,这可能与中性粒细胞的亚群相关[8,26]。因此,中性粒细胞与iBALT的相关性还需要进一步深化到中性粒细胞亚群。中性粒细胞与iBALT相关的可能机制有:①COPD患者气道中凝血酶的表达常升高,它激活中性粒细胞和内皮细胞上的蛋白酶受体,并促进中性粒细胞趋化和触发炎症趋化因子(如:IL-22、IL-17、IL-17A)分泌,这可能是iBALT形成的重要途径[35];②中性粒细胞大量产生BAFF和APRIL,它们激活B细胞,从而有利于促进iBALT的形成;③激活的中性粒细胞还会产生中性粒细胞外陷阱,它有助于捕获和杀灭细菌,但也会导致炎症反应从而造成组织损害,这也促进iBALT的形成[21,26];④B细胞激活中性粒细胞释放各种细胞因子,如:IL-17、IL-8、干扰素-γ、粒-巨噬细胞集落刺激因子,同时激活的中性粒细胞还可以暴露或产生新的表位,这些表位有可能打破免疫耐受导致自身抗体的产生,释放的细胞因子和产生的自身抗体与iBALT密切相关[8,36]。目前影响中性粒细胞的药物包括:糖皮质激素、非甾体抗炎分子、他汀类(介导IL-17减弱中性粒细胞的数目),但是它们长期治疗效果不佳[2,26,32]。此外,重组人可溶性血栓调节蛋白可抑制中性粒细胞与内皮的黏附,减少黏附分子的表达,增强内皮屏障功能,不良反应小,在特发性肺纤维化的患者中已见疗效,但还未应用于COPD患者[37]。因为中性粒细胞有不同的亚群,不同亚群对急慢性炎症反应不同,因此确定药物对中性粒细胞不同亚群及其触发炎症细胞因子的靶向治疗可能是iBALT的精准治疗的关键。
3 小结
iBALT在COPD的免疫炎症反应中发挥关键作用,但是iBALT形成的细胞分子机制复杂,所以明确参与机制的细胞分子可以为COPD的免疫炎症治疗提供基础。同时参与iBALT的细胞分子可能在COPD的发展过程中诱导病态反应的发生,导致自身抗体的产生[3]。因此,确定自身抗体形成的种类有利于进一步确定参与iBALT的细胞分子及精准COPD患者的治疗策略。此外,未来应该致力于阻断iBALT在慢性炎症中的致病性作用,发挥iBALT在急性炎症中的保护性作用,但是如何在治疗中平衡两者的关系值得进一步研究。