凝血酶原国际标准化比值/白蛋白对失代偿期肝硬化患者预后的预测价值
2021-09-25孟淑慧邹松龙吴杰芳
孟淑慧, 胥 莹, 邹松龙, 张 雪, 吴杰芳
昆明医科大学第二附属医院 消化内科, 昆明 650101
肝硬化失代偿期是肝硬化的终末阶段,病死率高,严重影响患者的生存质量,造成巨大的医疗负担[1-2],其预后评估受到国内外研究学者广泛关注,肝脏储备功能与失代偿期肝硬化预后密切相关。吲哚菁绿清除试验15 min滞留率(15-minute retention rate of indocyanine green clearance test, ICGR15)、终末期肝病模型(model of end-stage liver disease, MELD)评分是目前评估肝脏储备功能的常用方法[3-4],有研究[5]结果显示ICG清除试验及MELD评分可为失代偿肝硬化患者的短期和中期预后提供可靠的死亡率预测,但因其各自存在一定的局限性,故新型优化的失代偿期肝硬化患者预后模型仍在不断探索中。2018年,日本学者Haruki等[6]首次提出凝血酶原国际标准化比值与白蛋白比值(international normalized ratio to albumin ratio, PTAR),已有研究[7]表明PTAR能够有效预测重症肝硬化患者的预后。本研究旨在探讨PTAR预测失代偿期肝硬化患者的预后价值,为临床早期识别和判断失代偿期肝硬化的预后转归提供相关依据。
1 资料与方法
1.1 研究对象 选取2016年4月—2017年4月本院消化内科收治的失代偿期肝硬化患者,诊断均符合2019年版《肝硬化诊治指南》[8],即在肝硬化基础上,出现门静脉高压相关并发症如腹水、食管胃静脉曲张破裂出血、脓毒症、肝性脑病、肝肾综合征等。所有患者均经病史、临床表现、实验室检查、影像学检查或病理组织学检查确诊。排除标准:(1)急性、亚急性肝衰竭;(2)合并血液系统疾病、肝癌及严重心、肺、肾脏疾病;(3)行肝移植术者;(4)使用糖皮质激素或免疫抑制剂。
1.2 研究方法
1.2.1 临床资料及实验室指标 收集患者性别、年龄、病因、并发症、入院后首次的实验室检查资料,如Alb、ALT、AST、GGT、ALP、TBil、SCr、TC、血清Na、PT、INR、WBC、Hb、中性粒细胞计数,检测均由本院检验科完成。以患者首次入院确诊为失代偿期肝硬化为随访起点,以死亡为终点事件,随访2年死亡患者为死亡组,生存患者纳入生存组。相关公式计算方法:PTAR=INR/Alb(g/L);MELD评分=3.8×ln[TBil(mg/dl)]+9.6×ln[SCr(mg/dl)]+11.2×ln[INR]+6.4×病因(胆汁性或酒精性肝硬化为0,其他原因为1)。
1.2.2 ICG清除试验检测ICGR15 仪器型号为日本光电DDG-3300K;注射药品为吲哚菁绿25 mg/支(丹东医创药业有限责任公司)。检查过程:(1)碘过敏试验,确定阴性并签署知情同意书;(2)患者空腹至少4 h;(3)测定体质量,按照每公斤体质量0.5 mg用药来计算ICG给药量,以灭菌注射用水将ICG稀释成5 mg/ml;(4)启动DDG分析仪及数据分析软件,将身高、体质量、Hb、ICG用量等输入仪器;(5)在静息状态下,患者取平卧位,将鼻感光探头正确连接于鼻翼部;(6)由肘静脉缓慢注入,同时观察患者反应,在10 s内注射完毕。然后经DDG分析仪绘制ICG曲线,得出ICGR15数据。
1.3 伦理学审查 本研究方案经由昆明医科大学第二附属医院伦理委员会审批,批号: PJ-2020-119。
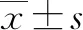
2 结果
2.1 一般资料 共纳入172例失代偿期肝硬化患者,男124例,女48例,平均(52.36±13.10)岁。其中乙型肝炎肝硬化77例,丙型肝炎肝硬化3例,酒精性肝硬化35例,原发性胆汁性肝硬化34例,药物性肝炎肝硬化6例,非酒精性脂肪性肝硬化1例,隐源性肝硬化16例。随访2年内死亡74例,男58例,女16例,平均(54.81±13.64)岁;存活98例,男66例,女32例,平均(50.51±12.44)岁。死亡组与生存组患者年龄、Alb、ALT、AST、ALP、TBil、TC、SCr、血清Na、PT、INR、Hb、PTAR、ICGR15、MELD评分、是否发生静脉曲张破裂出血、是否有腹腔积液比较,差异均有统计学意义(P值均<0.05)(表1)。
2.2 PTAR、ICGR15、MELD评分预测失代偿期肝硬化患者2年内死亡的诊断价值比较 PTAR、ICGR15、MELD评分预测失代偿期肝硬化患者2年内死亡的AUC分别为0.849(95%CI:0.791~0.906,P<0.001)、0.651(95%CI:0.569~0.733,P<0.001)、0.724(95%CI:0.646~0.802,P<0.001),敏感度分别为 0.797、0.770、0.568,特异度分别为0.786、0.561、0.827;三者联合的AUC可提高至0.851,敏感度为0.784,特异度为0.796(图1,表2)。
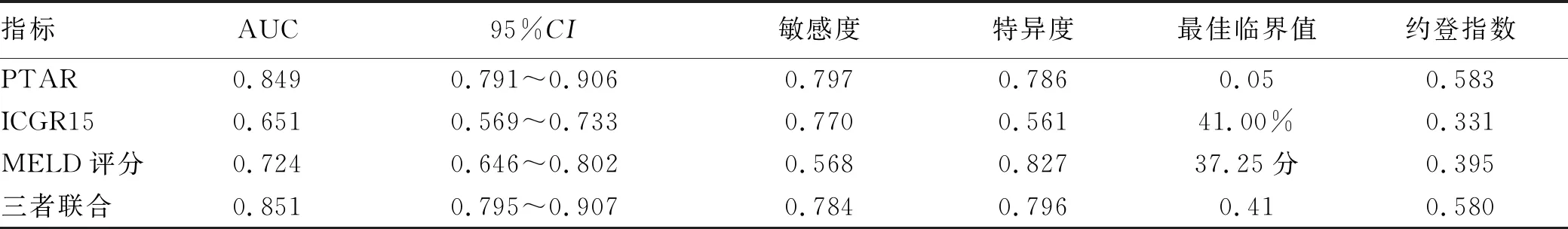
表2 3种指标预测失代偿期肝硬化患者2年内死亡的诊断效能比较
2.3 PTAR、ICGR15、MELD评分对失代偿期肝硬化患者2年预后评价的生存分析 PTAR最佳临界值为0.05,将所有患者分为高水平PTAR组(PTAR≥0.05组,n=80)和低水平PTAR组(PTAR<0.05组,n=92),结果显示高水平PTAR组患者生存率明显下降(χ2=60.07,P<0.001)(图2a);ICGR15最佳临界值为41.0%,将所有患者分为高水平ICGR15组(ICGR15≥41.0%,n=100)和低水平ICGR15组(ICGR15<41.0%,n=72),结果显示高水平ICGR15组患者生存率明显下降(χ2=17.848,P<0.001)(图2b);MELD评分最佳临界值为37.25分,将所有患者分为高水平MELD评分组(MELD评分≥37.25,n=113)和低水平MELD评分组(MELD评分<37.25,n=59),结果显示高水平MELD评分组患者生存率明显下降(χ2=33.01,P<0.001)(图2c)。

图2 不同PTAR、ICGR15、MELD评分患者的Kaplan-Meier生存曲线
2.4 失代偿期肝硬化患者2年预后分析 单因素Cox分析中影响预后的因素有ICGR15、MELD评分、PTAR≥0.05、Alb、Hb、ALT、AST、ALP、TBil、TC、PT、INR、是否静脉曲张破裂出血、是否有腹腔积液(P值均<0.05);运用容忍度、方差膨胀因子检验自变量之间的多重共线性,排除了ICGR15、MELD评分、Hb、ALT、ALP、TBil、TC、PT、INR、是否静脉曲张破裂出血、是否有腹腔积液,最终纳入Cox比例风险模型的是Alb、AST、PTAR≥0.05。多因素Cox回归分析显示,PTAR≥0.05、Alb、AST是患者预后的独立影响因素(P值均<0.05)(表3)。
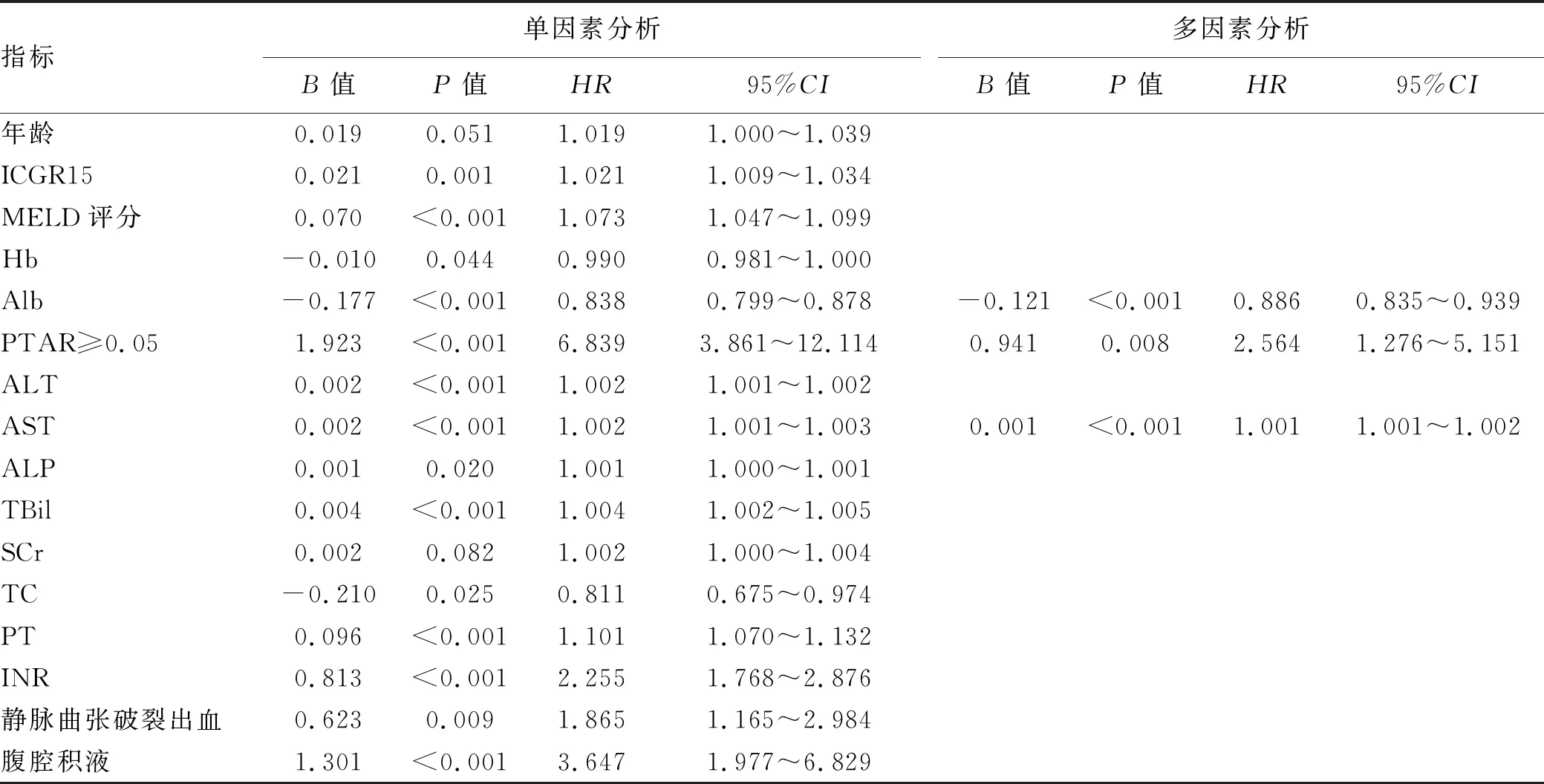
表3 单因素及多因素Cox回归分析
3 讨论
失代偿期肝硬化以肝功能减退和门静脉高压为主要表现,常出现消化道出血、肝性脑病、肝肾综合征、继发感染等严重并发症,患者预后差,据报道5年生存率仅为14%[9]。国内外许多学者针对肝硬化发生、发展的影响因素进行了大量研究,并建立评估失代偿期肝硬化预后模型,以进行早期预测。传统的CTP评分体系具有经典、简单、实用的优点,其包含的Alb和PT反映了肝脏合成功能,但该评分也存在固有缺陷,如腹水及肝性脑病等指标评价的主观性,以及尚未考虑肝硬化病因,评分范围窄,区分力低等[10]。2001年Kamath等[11]提出了新的评价体系MELD评分,采用客观的实验室检查指标替代了CTP评分中腹水、肝性脑病等主观性指标,避免了不同判定者的主观误差[12],TBil、Scr、INR与肝硬化病因(胆汁性、酒精性或其他原因)4项客观变量对生存率有显著影响[10]。翟永贞等[13]研究发现MELD评分是失代偿期肝硬化患者1年内死亡的独立预测因素,AUC为0.853(95%CI:0.805~0.901),敏感度为0.810,特异度为0.786。Jiang等[14]对198例失代偿期肝硬化患者的生存分析显示,MELD评分≥18可有效预测失代偿期肝硬化患者死亡。然而,Scr和TBil可能会受到治疗干预措施(特别是利尿剂)、败血症或溶血的影响[10],从而导致MELD评分对肝脏疾病严重程度的误判[11]。
另一项被广泛用于评估终末期肝病患者的预后指标是ICG。ICG清除试验是目前国内外学者公认的动态反映肝脏储备功能较敏感的方法[15],能反映肝硬化的功能障碍,秦华等[16]研究认为ICGR15可以预测肝硬化失代偿期及慢性肝衰竭的发生,AUC分别为88.3%、83.9%。Stauber等[17]通过对90例失代偿期肝硬化患者的研究显示,与ICG血浆清除速率相比,MELD评分在预测90 d生存率方面具有更高的诊断准确率(AUC:0.89 vs 0.71),MELD评分最佳临界值为22,为预测90 d生存率提供了最佳区分。Cheng等[5]对98例失代偿期乙型肝炎肝硬化患者的研究亦显示MELD评分的预测能力优于ICG。尽管ICGR15用于评估失代偿期肝硬化具有一定价值,但TBil升高会影响ICGR15评估的准确性[18],TBil在代谢过程中会与ICG竞争血浆蛋白,当TBil达30 mg/L时,ICG检测的准确性将大大降低[19],因此,需要新的评价指标弥补其受TBil影响的不足。
PTAR由Alb及INR计算得出,二者反映肝脏的合成功能,作为预测患者死亡风险的重要因素[20],Haruki等[6]通过对199例因肝细胞癌而接受择期肝切除术的患者进行回顾性分析显示,PTAR可作为肝细胞癌切除术后预测远期预后不良的新指标,是影响总生存率的独立预后因素,AUC为0.712(95%CI:0.617~0.806,P<0.001),HR为2.797(95%CI:1.556~5.030)。肝硬化患者同肝细胞癌切除术后患者一样,也存在肝功能异常和储备减少。Gao等[7]对865例重症肝硬化患者进行的一项大型回顾性研究中,首次从外部验证了PTAR是重症肝硬化患者不良预后独立且重要的影响因素,AUC为0.72(95%CI:0.68~0.75),HR为2.71(95%CI:1.99~3.68),PTAR越高,患者预后越差。康宁等[21]研究显示PTAR是影响乙型肝炎肝硬化患者发展为慢加急性肝衰竭(ACLF) 的独立危险因素,PTAR及MELD评分是影响酒精性肝硬化患者发展为ACLF的独立危险因素。其另一项研究[22]纳入195例乙型肝炎肝硬化患者,并联合ICG与PTAR建立PTAR-ICGR15模型,该模型AUC为0.860(95%CI:0.803~0.905),对乙型肝炎肝硬化患者ACLF的发生具有较好的预测价值,当PTAR-ICGR15≥-1.71时,提示ACLF发生风险较高。
本研究发现失代偿期肝硬化患者随访2年死亡组的PTAR明显高于生存组,PTAR、ICGR15及MELD评分预测患者2年预后的最佳临界值分别为0.05、41.00%、37.25分,AUC分别为0.849、0.651、0.724,三者联合时AUC仅提高至0.851,故单独使用PTAR其诊断效能很高(敏感度为0.797,特异度为0.786)。生存分析提示高水平PTAR组(PTAR≥0.05组)和高水平ICG组(ICGR15≥41.0%)患者生存率明显降低。多因素Cox回归分析显示PTAR≥0.05及AST是患者2年死亡的独立危险因素,而Alb可作为失代偿期肝硬化患者的保护性因素。
本研究尚存在一定的局限性。首先,作为单中心回顾性研究,随访病例数较少,尚需多中心、大样本、前瞻性的研究进一步验证。其次,纳入病例中乙型肝炎肝硬化占比较大,其他病因肝硬化分布较为分散且样本量偏少,因不同病因肝硬化患者的自然病程并不完全相同,将不同病因肝硬化患者纳入总体分析可能存在一定偏倚。由于此次纳入病例数较少,本研究未能针对PTAR在不同病因肝硬化患者中的分布及预测价值进行分层分析,尚需进一步设计相关研究探明不同病因肝硬化患者PTAR及其对预后的影响。
综上,以实验室指标为基础的PTAR其优势是简单、客观、方便,能够快速评估失代偿期肝硬化患者的病情严重程度及预后,单独用以预测失代偿期肝硬化患者预后的准确性仍较高,PTAR≥0.05提示死亡发生风险较高。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:胥莹、孟淑慧负责课题设计,资料分析;孟淑慧负责收集数据,撰写论文;邹松龙、张雪、吴杰芳参与数据采集及工作支持;胥莹负责拟定写作思路,指导撰写文章,修改论文,并最后定稿。
