抗病毒治疗慢性乙型肝炎合并非酒精性脂肪性肝病的效果观察
2021-09-25黄伟强李晓鹤刘映霞
卿 玲, 黄伟强, 李晓鹤, 陈 凤,4, 刘映霞
1 南华大学 临床医学院, 湖南 衡阳 421000; 2 深圳市第三人民医院 感染科, 广东 深圳 518112;
3 萍乡市第二人民医院 超声科, 江西 萍乡 337000; 4 中山大学附属第七医院 消化医学中心, 广东 深圳 518107
HBV感染是我国流行最为广泛、危害性最严重的疾病之一,全国约有9300万人为慢性HBV感染,占全世界慢性HBV感染总数的1/3[1]。近几十年来,随着生活水平的提高和生活方式的改变,非酒精性脂肪性肝病(NAFLD)的发病率逐年升高,在世界范围内的平均发病率约为25.24%,其中中东(31.79%)和南美洲地区(30.45%)最高[2],NAFLD现已成为发达国家慢性肝病的主要原因。据估计,目前亚洲地区NAFLD的总体发病率为29.6%,可能已经超过了西方国家[3]。在亚洲国家中,NAFLD发病率迅速增长且呈低龄化发展趋势,1999年—2005年为25.28%,2006年—2011年为28.46%,2012年—2017年为33.9%,亚洲国家中印度尼西亚患病率最高(51.04%),日本最低(22.28%),中国大陆患病率为29.81%[4],且存在地域差异,2015年我国武汉健康体检人群中脂肪肝发病率已高达40.4%[5]。目前,NAFLD和慢性乙型肝炎(CHB)已分列我国慢性肝脏疾病的第一、第二大原因,临床上两种疾病合并存在的情况也越来越常见,但对于两种疾病合并感染后的关系知之甚少[6]。有研究[7]表明,NAFLD是影响CHB患者抗病毒治疗应答不佳的重要原因,虽然目前对CHB抗病毒治疗已有明确指南[1],但对合并NAFLD患者如何治疗尚无共识。因此,本研究通过病例对照,并进行临床随访,分析合并NAFLD对CHB患者的抗病毒疗效影响,以期为此类患者抗病毒治疗提供临床参考。
1 资料与方法
1.1 研究对象 本研究以2011年1月—2017年12月于深圳市第三人民医院就诊的CHB和/或NAFLD患者为调查对象,根据患者肝组织病理检查和临床诊断结果,共入组了187例未进行过抗病毒治疗的患者。其中,41例NAFLD患者、103例CHB合并NAFLD患者、43例CHB患者。
1.2 纳入与排除标准 CHB组患者诊断依据《慢性乙型肝炎防治指南(2015年更新版)》[1];NAFLD组患者诊断依据《非酒精性脂肪性肝病诊疗指南》[8],入组患者的肝组织病理检查均提示脂肪肝;CHB合并NAFLD患者诊断标准要求同时符合CHB组和NAFLD组的入组标准;排除符合下列一项或多项条件的患者:年龄<18岁和>65岁;男性饮酒超过30 g/d,女性超过20 g/d;存在肝硬化、肝癌等;合并酒精性肝病、药物性肝病、自身免疫性肝病、肝豆状核变性和全胃肠外营养等可影响肝功能或导致脂肪肝的疾病;合并甲状腺疾病及其他自身免疫系统疾病;合并其他病毒性肝病(如甲型、丙型、丁型、戊型肝炎)和/或HIV感染;曾行抗HBV治疗和/或免疫调节剂;精神病、糖尿病、妊娠及哺乳者;伴有其他脏器重大损伤疾病者;正在参与其他干预性研究者。
1.3 研究方法 所有患者入组时均行身高、体质量、ALT、AST、血脂四项、肝纤维化四项、APRI、HBsAg、HBeAg、抗-HBe、HBV DNA定量等检查。本研究中,CHB组患者均为需进行抗病毒治疗的初治患者;CHB合并NAFLD组患者在研究之初未进行过抗病毒治疗,根据患者的转氨酶水平(是否大于正常值2倍)、HBV DNA载量(是否大于105IU/ml),以及结合患者发病情况将他们分为抗病毒治疗组(63例)和不需进行抗病毒治疗组(40例)。所有需进行抗病毒治疗的患者均在专业医师的指导下使用药物。CHB合并NAFLD组中,分别有44、3、5、4、2、5例患者使用恩替卡韦、阿德福韦酯、替比夫定、拉米夫定、替诺福韦、干扰素进行抗病毒治疗。CHB组中,分别有35、5、1、2例患者使用恩替卡韦、阿德福韦酯、替比夫定、干扰素进行抗病毒治疗。定期对以上患者进行随访观察,检测他们在使用抗病毒药物12、24、48、72、96周时与血清学、病毒学、生化学相关指标的表达水平。
本研究中,采用全自动血液分析仪(型号HST-N201)检测血常规,采用全自动生化分析仪(型号ADVIA2400)检测肝功能、血糖、血脂水平等;采用化学发光微粒子免疫法(Abbott GmbH & Co. KG)检测患者血清中HBsAg、HBeAg、抗-HBe的滴度,结果的判定以雅培公司生产的试剂盒说明书中的参考值为标准;采用速率法定量测定患者血清中ALT的水平,正常值为0~45 U/L;采用核酸纯化试剂盒和PCR荧光探针法(凯杰生物工程有限公司)定量检测患者血液中HBV DNA水平,<100 IU/ml 时判为阴性。
1.4 伦理学审查 本研究已获得深圳市第三人民医院伦理委员会批准,批号: 2018-038。
1.5 统计学方法 所有数据采用SPSS 26.0统计软件进行分析处理,非正态分布的计量资料以M(P25~P75)表示,多组间比较采用Kruskal-WallisH检验,两组间比较采用Wilcoxon秩和检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者基线资料比较 3组患者均以男性为主,男性比例在3组间差异无统计学意义(P>0.05),CHB组和CHB合并NAFLD组的PLT、ALT、GGT、ALP水平和右叶斜径均显著低于NAFLD组患者(P值均<0.05);CHB合并NAFLD组的BMI、TC、TG水平显著高于CHB组(P值均<0.05),其脾脏厚度显著低于CHB组(P<0.05),两组中的其他指标水平在基线期差异无统计学意义(P值均>0.05),因此在抗病毒治疗疗效上具有可比性(表1)。

表1 3组患者临床基线资料比较
2.2 抗病毒治疗不同随访时间点病毒学和临床生化指标的变化 抗病毒治疗48周,CHB组及CHB合并NAFLD组的HBV DNA水平均较治疗前显著降低(P值均<0.001),且CHB组的降低程度更明显(表2)。CHB合并NAFLD组在抗病毒治疗12周时,与CHB组相比,肝纤维化和炎症相关的指标均没有显著差异(P值均>0.05)(表3);24、48周时,CHB组的ALT和GGT水平显著低于CHB合并NAFLD组(P值均<0.05);48周时CHB组的HBV DNA水平显著低于CHB合并NAFLD组(P<0.05)(表4、5)。

表2 治疗前及抗病毒治疗48周时HBV DNA的表达水平

表4 24周抗病毒治疗不同随访时间点病毒学和临床生化指标的变化
2.3 抗病毒治疗不同随访时间点HBV DNA转阴率、HBeAg转阴率、ALT复常率的变化 CHB合并NAFLD组在12、24、48、72、96周时的HBVDNA转阴率显著低于CHB组相同时间点的HBV DNA转阴率(P值均<0.05)(表6)。CHB合并NAFLD组在48周时的HBeAg转阴率显著低于CHB组(P<0.05),96周时两组间的转阴率差异无统计学意义(P>0.05)(表7)。在抗病毒治疗12周时,CHB合并NAFLD组与CHB组的ALT复常率差异无统计学意义(P>0.05),但CHB合并NAFLD组在24、48、72、96周时的ALT复常率均显著低于CHB组相同时间点的ALT复常率(P值均<0.05)(表8)。

表5 48周抗病毒治疗不同随访时间点病毒学和临床生化指标的变化

表6 抗病毒治疗不同随访时间点HBV DNA转阴率的变化
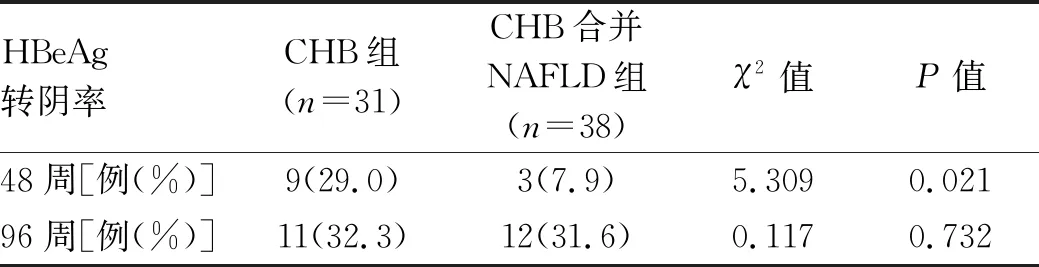
表7 抗病毒治疗不同随访时间点HBeAg转阴率的变化
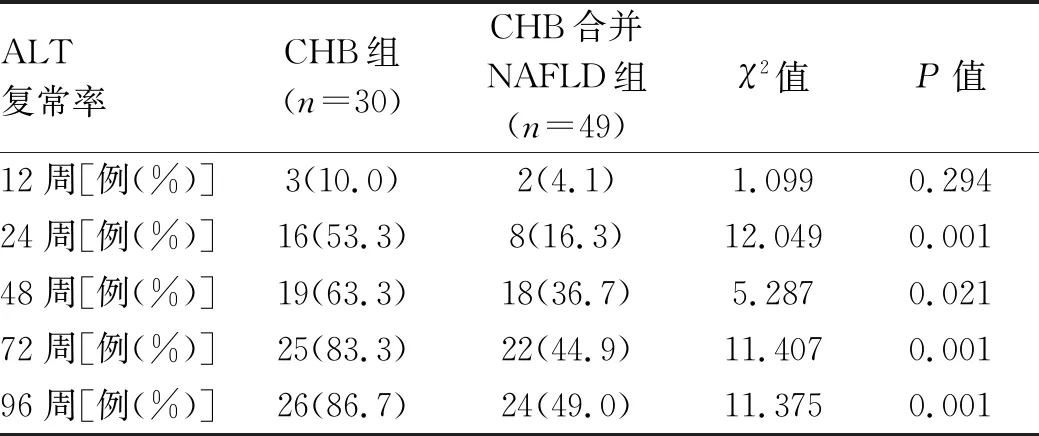
表8 抗病毒治疗不同随访时间点ALT复常率的变化[例(%)]
3 讨论
NAFLD和CHB虽然是两个独立疾病,但临床上往往合并出现,相互影响,给临床治疗带来困难。随着临床上CHB合并NAFLD患者的日益增多,对于此类患者如何进行抗病毒治疗,目前国内外相关研究逐渐增多,但尚未达成共识。最近北美和欧洲的大型回顾性多种族的队列研究[9-11]表明,CHB合并NASH比单纯CHB患者具有更高的肝脏相关结局和总体死亡率,他们认为“二次打击理论”是CHB合并NASH患者的发病机制过程,HBV被认为是诱导肝细胞损伤的第一次打击,叠加的NASH作为第二次打击导致进行性肝脏炎症和纤维化。相反,有研究[12]认为,NAFLD的合并不会协同HBV影响肝病的进程或结局,两者之间相互如何影响,目前尚未研究清楚。本研究分别以单纯CHB患者、单纯NAFLD患者、CHB合并NAFLD患者为研究对象,基线时临床资料的比较分析表明不同小组患者在临床表型上具有差异性,NAFLD患者具有更明显的肥胖症状,与肝功能相关的临床指标在CHB和CHB合并NAFLD组中没有显著性差异,但由于NAFLD本身也会引起肝功能异常,由此是否直接导致合并组使用CHB治疗药物效果不佳尚不清楚。因此,本研究在比较两组患者的疗效时,很难具有一致的基线资料,存在一定的局限性。
临床上,主要通过ALT、GGT、TBil等肝功能指标和HBV DNA、HBeAg等病毒学指标的表达来判定CHB的治疗效果。本研究结果显示抗病毒治疗24、48周时,CHB组的ALT和GGT水平均显著低于CHB合并NAFLD组;从12周开始,CHB合并NAFLD组的HBV DNA转阴率显著低于CHB组,且48周时CHB组的HBV DNA水平较CHB合并NAFLD组降低更明显;另外,CHB合并NAFLD组的ALT复常率从24周开始也显著低于CHB组;可见合并NAFLD可能影响了CHB患者的抗病毒治疗效果,这一结果与肖春花等[13]的研究结果类似,他们采用阿德福韦酯对CHB及CHB合并NAFLD的患者进行治疗,结果显示治疗48、96周时,CHB合并NAFLD组的HBV DNA清除率以及ALT复常率均显著低于单纯CHB组。CHB合并NAFLD组中ALT复常率低于CHB组,也可能是合并组中NAFLD引起的ALT升高导致抗病毒效果不佳。目前,关于NAFLD导致抗病毒疗效下降的机制暂不清楚,有学者推测NAFLD降低CHB抗病毒疗效的原因可能为:其一,肝细胞脂肪变性致使细胞水肿,从而改变肝脏微循环,脂肪的沉积引起肝脏功能的改变,使抗病毒药物的接触面积减少,从而降低其抗病毒疗效[14-15];其二,肝细胞脂肪变可诱导自然杀伤T淋巴细胞活化,并使其功能紊乱,阻碍HBV清除,并加剧肝组织炎症、免疫耐受及纤维化[16];其三,NAFLD患者体内特定Toll样受体水平异常,非特异性免疫应答强度下降,影响HBV清除[17-18]。总的来看,本研究提示合并NAFLD的患者抗病毒疗效不如单纯CHB患者好,证明NAFLD是影响CHB抗病毒疗效的因素之一,此类患者在进行抗病毒治疗的同时加强脂肪肝综合治疗(包括药物、运动、控制饮食等干预措施),疗效可能更佳。
综上所述,合并NAFLD可影响CHB患者的抗病毒治疗,基于我国慢性HBV感染人群基数较大,加上人们生活习惯的改变,必须重视两种疾病合并发生的临床表现和病理机制复杂性的研究。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:卿玲、黄伟强负责收集数据;李晓鹤、陈凤负责资料分析、拟定写作思路、撰写论文;刘映霞负责指导撰写文章。
