N6-甲基腺苷在肝细胞癌发生发展中的作用
2021-09-25赵礼金
马 可, 赵礼金
遵义医科大学附属医院 肝胆胰外科, 贵州 遵义 563000
肝癌是全球最常见的消化系统肿瘤之一,也是癌症死亡的第四大原因,每年约有841 000例新发病例和782 000例死亡,肝癌的死亡人数占总病例数的8.2%,而肝细胞癌(HCC)在肝癌中所占比例高达75%~85%,中国更是HCC的高危地区,占全球新发病例的50%,且呈明显的上升趋势[1]。虽然多学科综合治疗及个性化的治疗方案使HCC患者的5年生存率得以提高,但HCC的筛查、复发和转移仍是今后进一步探索和亟待解决的难题。目前已经证明N6-甲基腺苷(N6-methyladenosine, m6A)修饰通过对信使RNA(mRNA)和非编码RNA(ncRNA)的调节影响基因的表达,并与包括HCC在内的多种人类癌症有关[2]。m6A水平以及m6A甲基化酶复合物的异常改变将会通过抑制或促进HCC相关基因的表达影响HCC的进展。因此,本文就m6A甲基化酶复合物在HCC的发生与发展的作用机制进行综述,以期为HCC的预防和治疗提供新的靶点。
1 m6A的结构与功能
m6A是指腺嘌呤的第6位氮原子(N)发生了甲基化修饰,分布于终止密码子附近(与RNA翻译相关)和较长的内部外显子内(与RNA剪接相关),这种结构模式体现了RNA甲基化高度保守的特征[3]。甲基转移酶(编辑器)、去甲基酶(消码器)和被称为“读码器”的m6A结合蛋白组成的甲基化酶复合物决定着m6A的功能[4-5]。m6A修饰是一个甲基化与去甲基化的动态过程,METTL3、METTL14、METTL16、WTAP、RBM15、KIAA1429等组成的甲基转移酶和去甲基酶(ALKBH5、FTO)维持着这个过程的平衡,当这种平衡被打破后将会对生物体造成不同程度的损伤。m6A结合蛋白(YTHDC1、YTHDC2、YTHDF1、YTHDF2、YTHDF3、HNRNPA2B1和HNRNPC)可以与RNA中的m6A修饰位点结合并发挥特定的作用[5-7]。
m6A甲基化在转录后水平上调控mRNA和ncRNA的剪接、运输、稳定性和翻译,但不会改变转录产物[8]。Alarcon等[9]研究发现METTL3可以甲基化初级微小RNA(pri-miRNA),促进RNA结合蛋白DGCR8的识别和加工的功能,进而促进微小RNA(miRNA)的成熟。当METTL3缺失时,降低了DGCR8与pri-miRNA的结合,导致成熟miRNA的减少和未加工的pri-miRNA的积累。YTHDF1通过与翻译起始因子相互作用,增加m6A修饰的mRNA分子的核糖体数量,提高目的mRNA的翻译效率[10]。YTHDF2羧基末端可以选择性地与含有m6A的mRNA结合,而氨基末端则负责定位细胞中YTHDF2-mRNA复合物的RNA衰变位点,从而降低了mRNA的稳定性,加速mRNA的降解[11]。YTHDC1通过与mRNA剪接因子相互作用来调节含有m6A的外显子的剪接[12]。核不均一蛋白HNRNPA2B1参与调节pri-miRNA的转录,并引起与METTL3类似的选择性剪接效应,促进pri-miRNA加工成前体微小RNA(pre-miRNA),而HNRNPC可能影响mRNA和长链非编码RNA(LncRNA)局部的二级结构[4,13]。
m6A对RNA的调控与干细胞分化、免疫调节和肿瘤的发生与发展等一系列生理和病理生物学行为有关。METTL3和METTL14在胚胎干细胞中催化的m6A修饰抑制了编码发育调节因子的mRNA,从而促进了胚胎干细胞的自我更新[14]。在免疫反应中,m6A修饰抑制了Toll样受体3(TLR3)和RIG-Ⅰ样受体(RIG-Ⅰ)的激活,这导致了被病毒感染的宿主无法识别外源RNA的入侵,从而导致病毒RNA逃逸免疫监测[15-16]。Zhao等[17]研究发现去甲基酶FTO可以通过降低m6A水平抑制选择性剪接因子SRSF2在RUNX相关转录因子1转位1(RUNX1T1)mRNA上的结合,从而调控RUNX1T1亚型的表达,促进脂肪的形成。此外,已有大量证据[18-19]表明m6A水平及其调节因子的异常改变对肿瘤的增殖、侵袭和迁移等恶性生物学行为存在密切的关系。
2 m6A甲基化的异常调节促进HCC的进展
2.1 HCC中的m6A“编辑器”的异常表达 研究[20-21]显示,甲基转移酶样因子3(methyltransferase like 3,METTL3)在HCC组织中的表达高于正常肝组织,与HCC患者预后不良相关。在METTL3基因敲除的Huh-7和HepG2细胞模型中,m6A mRNA水平显著降低,并抑制了HCC细胞的增殖、迁移以及HCC的克隆形成能力。裸鼠的皮下移植瘤实验和体内原位移植瘤实验均显示METTL3基因敲除后可以抑制HCC的形成和生长,并减弱了HCC的肺转移。进一步研究[21]显示,细胞因子信号转导抑制因子2(suppressor of cytokine signaling 2,SOCS2)是METTL3的下游靶基因。SOCS2是细胞因子信号转导抑制因子家族中的一员,在HCC中具有抑制癌细胞增殖和迁移的作用。METTL3针对SOCS2进行的m6A修饰促进了SOCS2 mRNA降解从而抑制了SOCS2的表达。Xu等[22]研究发现,有丝分裂原可以通过上调泛素结合酶UBC9促进METTL3与泛素化修饰物SUMO1结合,促进METTL3泛素化的发生,抑制了METTL3作为甲基转移酶的活性,这使得转录因子Snail在HCC细胞中聚集,从而促进HCC的进展。值得注意的是,METTL3的泛素化水平增加与HCC的高转移潜能呈正相关。Zuo等[23]发现了一种新的与HCC中脂肪生成相关的LncRNA——LINC00958,METTL3介导的m6A修饰通过稳定LINC00958的RNA转录使其表达上调,随后LINC00958通过抑制miR3619-5p上调了HCC衍生生长因子(HDGF)表达,进而促进HCC的发生与发展。METTL3与RNA结合蛋白DGCR8相互作用,以m6A依赖的方式通过上调miR-873-5p抑制SMG1的表达,从而在HCC中发挥致癌作用[24]。Lin等[25]通过转录本测序分析显示,METTL3的表达降低与HCC索拉非尼耐药显著相关。既往研究[26]表明,自噬增加了肿瘤对抗癌药物的耐药性,FOXO3是调节自噬的相关基因。METTL3介导的m6A修饰以YTHDF1依赖的方式促进了FOXO3 mRNA的稳定性。在缺氧条件下诱导的METTL3下调则通过降低FOXO3的表达促进了自噬的发生,从而使HCC对索拉非尼的耐药性显著增强,而过表达FOXO3后可恢复HCC对索拉非尼的敏感性[25]。
与METTL3相似的是,甲基转移酶WTAP和KIAA1429在HCC中显著上调,可以促进HCC的发展并且与HCC的预后不良相关。原癌基因ETS1是HCC中的一种肿瘤抑制因子,WTAP介导的m6A修饰抑制了ETS1与RNA稳定剂HUR的结合,从而促进了ETS1的降解。此外,WTAP还可以通过ETS1-p21/p27信号通路促进G2/M期转变,调节HCC细胞的细胞周期[27]。KIAA1429诱导转录因子GATA3 Pre-mRNA 3′端非编码区(UTR)m6A甲基化,导致RNA结合蛋白HUR分离,GATA3 Pre-mRNA降解,进一步抑制GATA3的表达,最终促进HCC的增殖和转移[28]。Cheng等[29]在体外研究中发现,KIAA1429通过上调ID2 mRNA的m6A修饰来抑制ID2的表达,从而促进HCC的迁移和侵袭。
然而,另一个甲基转移酶复合物的核心分子METTL14与METTL3在HCC的发生与发展中起到相反的调节作用。METTL14在HCC中是一种肿瘤抑制因子,在HCC样本中的表达显著低于正常肝组织[19]。先前的一项研究[30]发现,METTL14可以通过与RNA结合蛋白DGCR8的相互作用,以m6A依赖的方式促进pri-miRNA-126成熟,从而抑制HCC的转移。Li等[31]通过对GEO等数据库的分析发现了三种可被METTL14调控的下游基因,包括半胱氨酸亚磺酸脱羧酶(CSAD), 谷草转氨酶2(GOT2)和SOCS2。CSAD在肝脏的癌前病变中处于高表达状态,GOT2基因多态性与职业性肝损伤密切相关,特别是GOT2被发现与许多癌症有关,如胰腺癌和结直肠癌等[32-35]。如前所述,SOCS2在HCC中是一种肿瘤抑制因子。总之,这三种受METTL14调控的基因与包括HCC在内的多种癌症有着密切关系,但这三种基因的调控在HCC的发生与发展中的具体作用机制有待于进一步探究。最新研究[36]发现,METTL16在HCC中也呈现低表达状态,METTL16基因缺失预示着存活率降低,并且是HCC患者无病生存率的独立危险因素。该项研究同时提出了METTL16是评价HCC预后的一项生物标志物,也是治疗HCC的潜在靶点。
2.2 HCC中的m6A“消码器”的异常表达 ALKBH5和FTO是m6A甲基化修饰中的去甲基化酶。Chen等[37]发现ALKBH5在HCC中表达下降是患者预后不良的独立危险因素。LY6/PLAUR结构域包含体1(LYPD1)在HCC的发生发展中具有促进作用,LYPD1的缺失可以抑制HCC细胞的增殖和侵袭能力,而LYPD1在癌组织中的表达增加预示着HCC的预后较差[37]。ALKBH5通过抑制IGF2BP1介导的LYPD1 mRNA的稳定性来抑制HCC细胞的增殖和侵袭。但是,ALKBH5/IGF2BP1挽救试验的结果在两个不同的HCC细胞系之间略有不同,这表明IGF2BP1可能不是ALKBH5下游唯一的m6A读码器[37]。FTO是最早发现的去甲基酶,其在HCC中的作用却存在着争议。先前有报道[35]表明,FTO的过度表达与HCC患者的预后不良相关。FTO介导的丙酮酸激酶(PKM2) mRNA去甲基化,加速其翻译产物的生成,从而促进了HCC的进展。但是,最新的研究[38]显示FTO抑制了DEN诱导的HCC发生。FTO不仅可以在HCC发展的初始阶段抑制癌细胞的增殖,而且FTO以CUL4A mRNA为靶点,降低CUL4A蛋白水平,阻断细胞周期进程和增殖,从而抑制HCC的进展。此外,Liu等[39]在研究中发现沉默信息调节因子1(SIRT1)可以通过激活泛素化修饰物E3连接酶(RANBP2)诱导FTO泛素化和降解,导致肿瘤抑制因子鸟嘌呤核苷酸结合蛋白G(O)亚基α(GNAO1)发生m6A修饰,抑制GNAO1 mRNA和蛋白的表达促进HCC的发展。这些研究结果揭示了FTO在HCC的发生发展中具有抑制作用。因此,关于FTO在HCC中的功能尚需要进一步阐明。
2.3 HCC中的m6A“读码器”的异常表达 目前发现的m6A结合蛋白包括YTH结构域蛋白(YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2)和核不均一蛋白HNRNP(HNRNPA2B1、HNRNPC)。YTHDF1和YTHDF2在HCC中表达显著增高,在HCC细胞的增殖、侵袭和迁移中起重要作用,是影响HCC患者预后的危险因素[18,24,40]。在HCC中,受c-MYC和USF1的调节导致YTHDF1的高表达,随后YTHDF1以m6A依赖的方式促进FZD5 mRNA的翻译[19]。FZD5则通过WNT/β-catenin信号通路促进HCC细胞的增殖、侵袭和迁移[19]。除此之外,YTHDF1在METTL3的调控下可以与转录因子snail的mRNA的CDS区结合,促进snail蛋白的表达,从而对HCC细胞的上皮-间充质转化产生影响[41]。YTHDF2在HCC中的表达则存在争议。一方面,Zhang等[42]通过TGCA数据分析和对100例HCC组织进行的免疫组化染色显示YTHDF2在HCC中呈高表达状态,并通过进一步研究表明YTHDF2的过表达使OCT4 mRNA 5′UTR m6A水平升高,促进了OCT4的表达,使得HCC细胞的肿瘤干细胞表型增加并促进了HCC的肺转移。Yang等[43]研究也表示YTHDF2与HCC的恶性水平呈正相关,这种相关性可能与HCC中miRNA-145的缺失有关。此外,micRNA-145可通过靶向YTHDF2的mRNA 3′-UTR使得YTHDF2的表达下降,增加HCC中m6A mRNA的水平从而抑制HCC的发展。然而另一方面,有报道[44-45]称HCC的缺氧特异性使YTHDF2表达下降。YTHDF2可以与表皮生长因子受体(EGFR) 3′-UTR的m6A修饰位点结合,促进EGFR的mRNA降解,抑制EGFR的表达。当YTHDF2过表达时可以抑制HCC细胞的增殖、肿瘤生长以及丝裂原活化蛋白激酶和细胞外调节蛋白激酶的激活[45]。Hou等[44]研究发现,当YTHDF2的表达下降时,HCC组织中m6A的水平明显高于癌旁组织,而这种高表达与HCC患者的预后呈负相关。此外,YTHDF2在人HCC细胞中沉默或在小鼠肝细胞中消融可引起炎症、血管重建和肿瘤转移。因此,YTHDF2在HCC中的表达升高或者下降存在相互矛盾的情况,造成这一情况的原因可能与不同地区临床样本的差异有关。
综上所述,m6A调节因子的异常表达会影响m6A的水平,在调控HCC的发生与发展中涉及到了对mRNA和ncRNA稳定性的调节,表现出复杂性和多样性的特点(表1)。
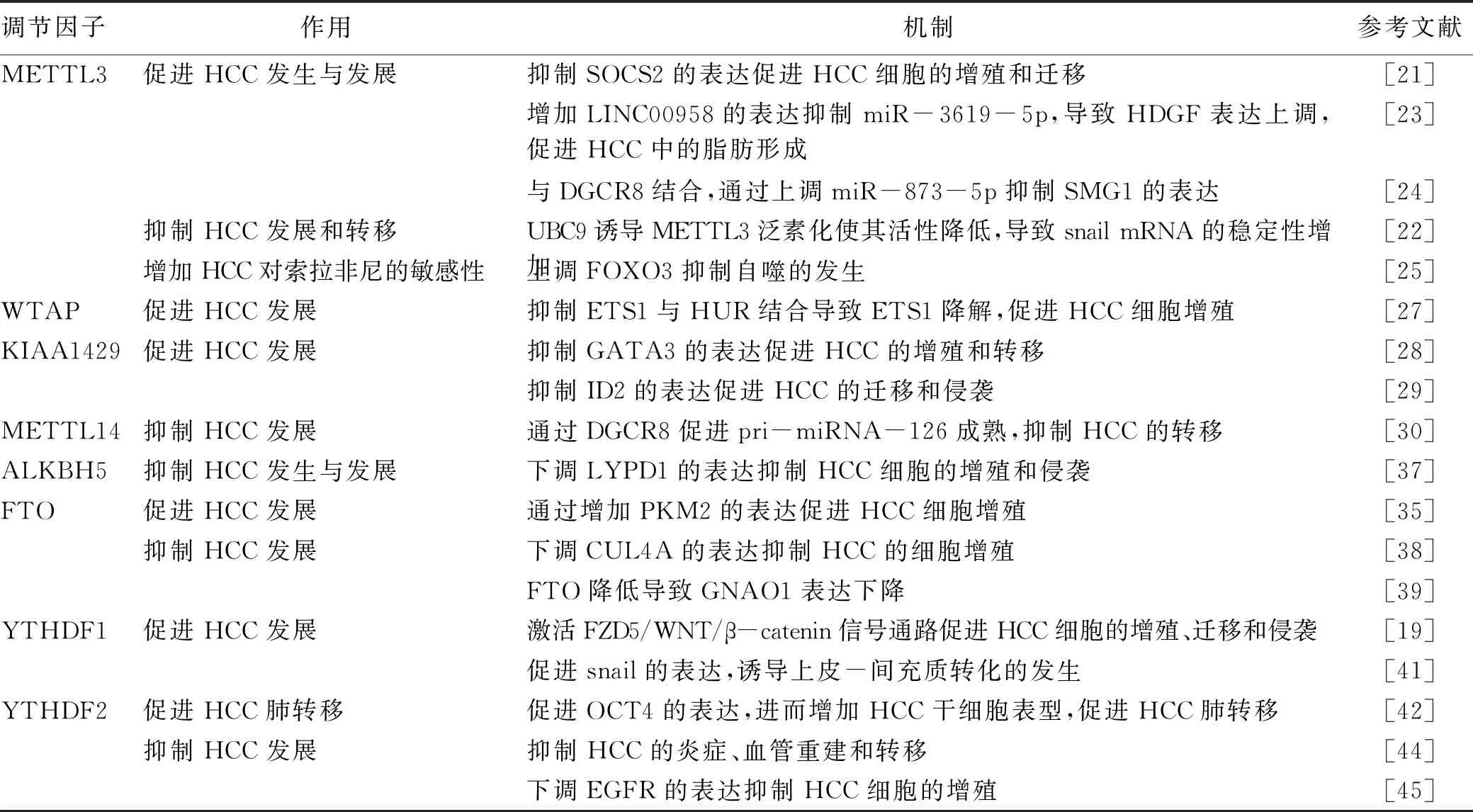
表1 m6A调节因子在HCC中的作用及机制
3 总结与展望
近年来,随着高通量测序技术的发展,m6A甲基化酶复合物的异常表达对肿瘤的调控作用逐渐被揭晓,它们通过调节靶基因mRNA的稳定性和翻译来影响肿瘤的进展。目前,已有大量文献支持m6A调节因子是HCC的生物标志物,其表达水平的异常是影响HCC发生与发展的危险因素。但是,m6A在HCC中的异常改变尚存在争议,有报道称HCC中m6A水平增加与预后不良有关,而另有研究显示HCC组织以及转移性肿瘤的整体m6A水平降低。另外,在不同的条件下,METTL3、FTO和YTHDF2等m6A调节因子在HCC中表现出了抑癌和致癌的矛盾作用,这可能也是m6A总体水平在HCC中不确定性的原因所在。因此,需要进一步的研究来阐明m6A修饰和m6A甲基化酶复合物在HCC发生发展中的特异性和复杂性,以期使靶向调控失调的m6A调节因子成为治疗HCC的一种新的选择。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:马可负责课题设计,资料分析,撰写论文;赵礼金负责拟定写作思路,指导文章的撰写并最后定稿。
