佐太对柔红霉素的增效作用
2021-09-24贾雯靖岳会兰毕齐茂周国英赵晓辉
张 婷, 贾雯靖, 岳会兰, 毕齐茂, 周国英, 赵晓辉*
(1.中国科学院西北高原生物研究所,青海 西宁 810008;2.中国科学院大学,北京 100049)
佐太又称为“甘露精王”,是藏医药的核心制剂和典型代表,是由水银添加各种辅助药物后经过特殊复杂工艺加工炮制而得的一种具有独特作用的蓝黑色粉末制剂,主要成分为硫化汞[1-3]。藏医药理论认为,佐太在复方药物中具有增强诸药疗效的作用,是配制珍宝类药物必不可少的佐辅剂[4-5],许多知名的藏药复方中都含有佐太,如七十味珍珠丸、仁青常觉、仁青芒觉等[1,4,6],相关制剂在治疗中风、麻痹病、高血压、神经系统疾病、心血管障碍、肝胆胃肠疾病、肿瘤等疾病时往往能发挥独特的功效[3,6-7]。
随着安全性研究的不断深入,初步证实佐太在正常临床剂量下对机体毒性甚微,但关于其在复方药物中的增效作用一直以来缺少数据支持[8-10],究其原因,一方面是藏药复方药物成份复杂,另一方面是藏药都是综合施治,很难确定目标成分,而且缺少相应的药理模型对其增效作用开展研究。因此,本研究选用抗癌单体药物柔红霉素作为研究对象,考察佐太促进其进入癌细胞内部及促凋亡效果,以期为阐明该藏药的增效作用提供参考。
1 材料
1.1 细胞株 人慢性髓原白血病细胞株 K562、人喉鳞癌细胞株HN4,均购自武汉普诺赛生命科技有限公司;人肝癌细胞株HepG2,购自中国科学院上海细胞库。
1.2 动物 SPF级雌性BALB/c无胸腺裸鼠,4~6周龄,体质量(20±2) g,购自北京华阜康生物科技股份有限公司,实验动物生产许可证号SCXK(京)2014-0004,于中国科学院西北高原生物研究所动物实验中心SPF级环境下饲养。动物实验程序严格按照国家卫生研究所实验动物护理和使用指南开展,并经中国科学院西北高原生物研究所实验动物伦理委员会批准。
1.3 药物与试剂 柔红霉素(上海海正辉瑞制药有限公司,批号18005711);佐太(青海久美藏药药业有限公司)。二甲基亚砜(天津百世化工有限公司,批号20161010);甲醇(山东禹王和天下新材料有限公司,批号20181103026);胎牛血清(浙江天杭生物科技股份有限公司,批号18110505);RPMI 1640细胞培养基、DMEM/F-12 1∶1细胞培养基、DMEM细胞培养基、胰酶消化液(美国Gibco公司,批号分别为2091763、8119160、30819011、1974026);PBS缓冲液(武汉博士德生物工程有限公司,批号14F12B21);MTT 试剂盒、Annexin V-FITC/PI 细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,批号分别为C0009、082319190826)。
1.4 仪器 DM11型倒置显微镜(德国Leica公司);BE-9010型微孔板恒温振荡器(浙江赛德仪器设备有限公司);Epoch2型微孔板分光光度计(美国BioTek公司);5430R型高速冷冻离心机(德国 Eppendorf 公司);FACSMelody流式细胞仪(美国BD公司);RV10型旋转蒸发仪(美国IKA公司);Agilent 1260-6470液质联用仪(上海安捷伦科技有限公司);INCO108 CO2培养箱(德国Memmert公司);XM-100T超声波破碎机(上海净信实业发展有限公司);749540-0000微量电动匀浆器(美国Kimble公司)。
2 方法
2.1 佐太促进柔红霉素在癌细胞内部的富集研究(HPLC-MS分析)
2.1.1 对照品溶液制备 精密称取柔红霉素对照品1 mg,加入甲醇制成1 mg/mL溶液,即得。
2.1.2 给药与样品采集 称取适量柔红霉素、佐太,加入3种对应细胞所需培养基,配成1 mg/mL溶液备用。取对数生长期的K562、HN4、HepG2细胞,按3×105个/mL浓度接种于6孔板中,于24、48、72 h给药,每个时间段分为柔红霉素(2.0 μmol/L)给药组、佐太(5 ng/mL)联合柔红霉素(2.0 μmol/L)给药组,适量胰酶消化细胞并转移至离心管中,加入PBS缓冲液,2 000 r/min离心5 min,吸弃上清,清洗3次除去胞外药物,沉淀中再加入500 μL PBS,充分混匀后细胞计数,以3×105个/mL浓度收取细胞,加入100 μL甲醇,超声波破碎机充分裂解后加入甲醇至终体积1.5 mL,超声提取30 min,有机膜过滤至离心管中待分析。
2.1.3 色谱条件 流动相甲醇-水(含0.1%甲酸)(7∶3);体积流量0.2 mL/min;柱温30 ℃;进样量5 μL。
2.1.4 质谱条件 Agilent1260-6470 三重四级杆液质联用仪分析,电喷雾离子源(ESI),正离子模式;多重反应选择离子检测(MRM);离子喷雾电压4 000 V,雾化温度400 ℃;柔红霉素监测离子对m/z528.4~321.2。
2.2 佐太体外增效作用研究
2.2.1 溶液制备 将柔红霉素和佐太溶于DMSO(<0.05%)中,加入对应培养基制成 2 mmol/L溶液备用。
2.2.2 细胞培养 将K562、HepG2、HN4细胞分别培养于含10%胎牛血清和1%青霉素、1%链霉素的RPMI 1640培养基、DMEM培养基和DMEM/F-12培养基中,置于37 ℃、含5% CO2的培养箱中培养,待细胞生长至培养皿的70%~80%时进行传代,生长至对数期时进行实验。
2.2.3 MTT法 取对数生长期的K562、HN4、HepG2细胞,以5×103个/孔接种于96孔培养板中,每孔200 μL,每组设6个复孔,培养24 h后弃上清,分别给予柔红霉素或柔红霉素+佐太,设置空白组(培养基)、对照组(细胞+培养基)、佐太给药组、柔红霉素给药组、佐太联合柔红霉素给药组,HN4、K562组每孔加入不同浓度柔红霉素(处理48 h给药浓度为4.0、8.0、16.0 μmol/L,处理72 h为2.0、4.0、8.0 μmol/L)或联合5 ng/mL佐太给药,HepG2组每孔加入不同浓度柔红霉素(处理48 h给药浓度为2.0、4.0、8.0 μmol/L,处理72 h为1.0、2.0、4.0 μmol/L)或联合5 ng/mL佐太给药,培养48、72 h后吸弃上清,每孔加入20 μL MTT(5 mg/mL),4 h后吸弃上清,每孔加入150 μL DMSO,振荡器混匀,用酶标仪分别检测490、570 nm处各孔OD值,计算细胞存活率,公式为存活率=[(给药组OD-空白组OD)/(对照组OD-空白组OD)]×100%,重复3次,取平均值。
2.2.4 Annexin V-FITC/PI 染实验 取对数生长期K562、HN4、HepG2细胞,按3×105个/mL浓度接种于6孔板中,分为对照组、柔红霉素(2 μmol/L)给药组、佐太(5 ng/mL)联合柔红霉素(2.0 μmol/L)给药组,培养72 h后收集细胞,用预冷的PBS缓冲液重悬细胞3次,离心,吸弃上清,重悬于195 μL结合液,加入5 μL Annexin V-FITC 溶液、10 μL PI溶液,轻轻吹打混匀,避光孵育15 min,转移至流式管中,加入1 mL PBS,流式细胞仪测定细胞凋亡率。
2.2.5 给药 4 ~ 6周龄雌性BALB/c无胸腺裸鼠于SPF级动物房饲养,12 h光照,小腹右侧皮下注射1×106~ 2×106个K562细胞进行肿瘤移植,2周后待肿瘤组织较明显、直径大约在2 mm时随机分为4组,每组10只小鼠,荷瘤小鼠腹腔注射给药,分别设置空白对照组、柔红霉素给药组、佐太联合柔红霉素给药组,柔红霉素、佐太给药剂量分别为2.5 mg/kg、0.2 μg/kg,每隔1 d给药1次,同时测定肿瘤体积[体积=(宽度)2×长度/2]。给药3周后取小鼠肿瘤组织,称定质量。

3 结果
3.1 佐太促进柔红霉素进入不同癌细胞内部实现药物富集 与单独给药组比较,联合给药组在给药48、72 h后K562和HepG2细胞内部柔红霉素水平分别提高(94.0±46.1)%、(50.7±11.8)%和(93.6±9.8)%、(40.0±17.9)%,但在HN4细胞中给药24、48 h后呈现一定的抑制作用,而给药72 h后胞内药物浓度提高(120.3±12.0)%,高于单独给药组,见图1。
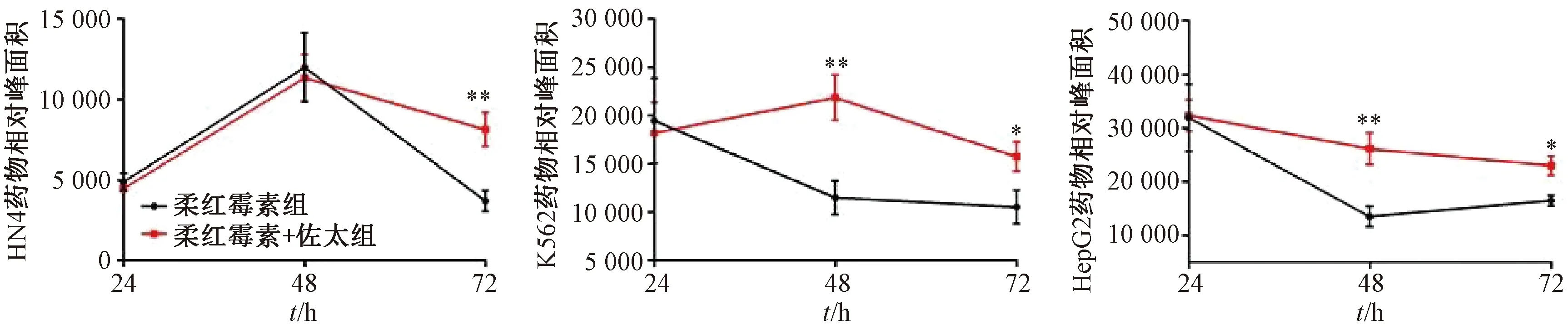
注:与空白组 (2.0 μmol/L柔红霉素) 比较,*P<0.05,**P<0.01。图1 佐太对柔红霉素进入不同癌细胞后的促进作用
3.2 佐太对柔红霉素促癌细胞凋亡的影响 给药48 h后,柔红霉素对HN4、K562、HepG2的IC50分别为(7.20±0.52)、(8.65±0.45)、(4.62±0.68)μmol/L,给药72 h后分别为(6.10±0.25)、(5.63±0.36)、(2.83±0.61)μmol/L,而佐太对其IC50均大于40 μg/mL,而本实验中选择5 ng/mL佐太,对三者均无抑制作用。图2显示,佐太联合柔红霉素给药48、72 h后能增加后者促凋亡效果,其中48 h后能使低剂量给药组对HN4、K562、HepG2细胞的作用效果分别提高1.42%、8.56%、7.56%,72 h后分别提高10.35%、8.70%、8.33%;佐太在中、低剂量组具有增效作用,而在高剂量组作用不明显,可能是高剂量下单独给药组、联合给药组凋亡率都较高,掩盖了佐太增效作用。Annexin-V FITC/PI双染实验结果见图3,可知佐太能增加柔红霉素对3种癌细胞的促凋亡效果。
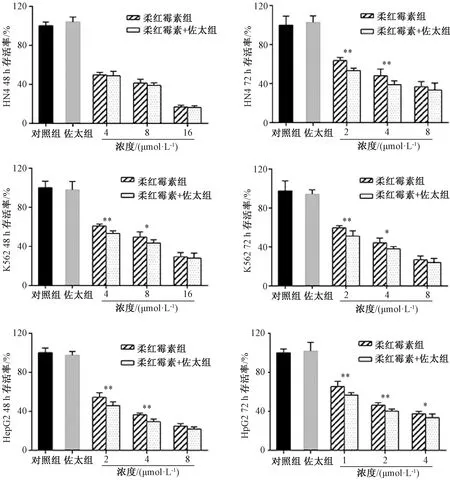
注: 与柔红霉素组比较,*P<0.05,**P<0.01。图2 佐太对柔红霉素促癌细胞凋亡的增效作用(MTT法)

注:与柔红霉素组比较,*P<0.05,**P<0.01。图3 佐太对柔红霉素药物促癌细胞凋亡的增效作用(流式细胞术)
3.3 佐太对柔红霉素抑制K562移植瘤生长的增效作用 给药3周后,单独给药组、联合给药组均能抑制小鼠肿瘤生长,其中联合给药组小鼠整体状态、活跃度、体质量更优,肿瘤体积有所减小但无明显差异,联合给药组瘤体质量也有所降低。图4~5显示,联合给药组抑制肿瘤增长的作用优于单独给药组,表明佐太在体内也具有一定的增效作用。

注: A~C分别为空白对照组、单独给药组、联合给药组。图4 BALB/c裸鼠移植瘤模型及各组裸鼠肿瘤体积
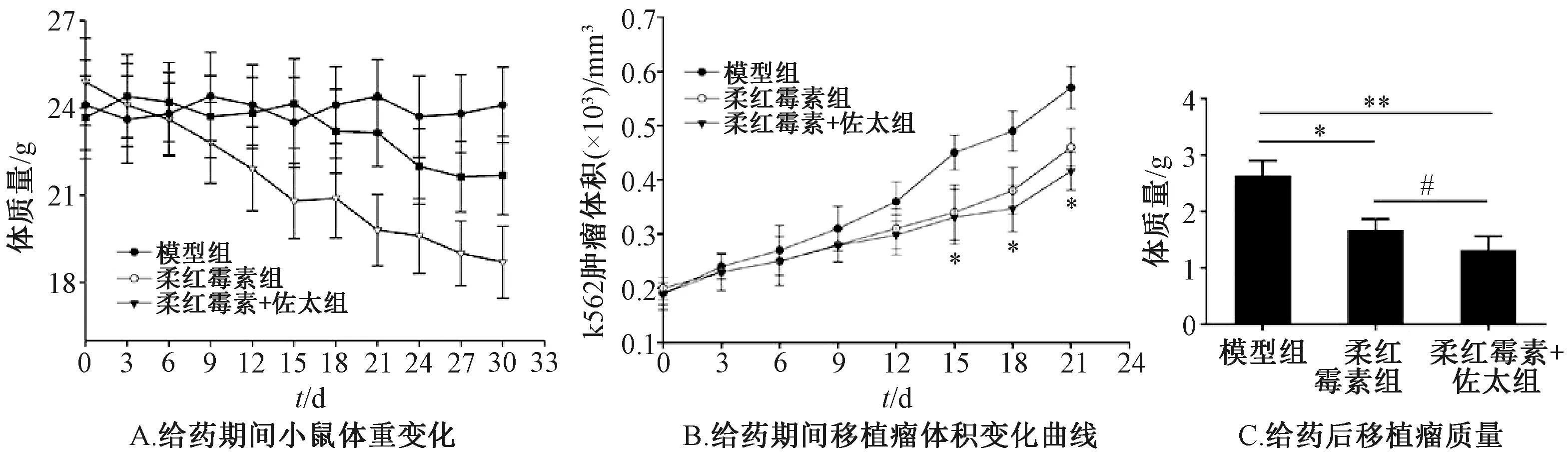
注: 与空白对照组比较,*P<0.05,**P<0.01;与柔红霉素组比较,#P<0.05。图5 佐太对柔红霉素抑制K562移植瘤生长的增效作用
4 讨论
中医药中利用重金属类制剂治疗疾病历史悠久,其中朱砂、雄黄及砒霜最为知名[11-12]。而藏医药中则以佐太为最典型代表,且目前仍广泛使用,在临床用药中发挥着不可替代的作用[6]。这些重金属类制剂在中华民族医疗史中占据着重要的地位,同时在保障人民生命健康方面也发挥了重要作用。但在中医药的发展过程中,这些含汞、砷类重金属制剂也不断的因为毒性问题而受到质疑甚至禁用。但随着毒理学研究的不断深入,重金属制剂药用剂量的安全性问题已经逐步得到科学解释。而且随着As2O3联合反式维甲酸在治疗急性早幼粒白血病方面获得成功,使得民族医药中重金属制剂的现代应用值得研究和期待[13]。
佐太是藏医药中配制珍宝类复方药物不可缺少的关键成分,在藏医药体系及临床治疗中占据着重要地位[6,14]。 “十一五”和“十二五”期间多个研究单位已经对佐太的安全性进行了全面评价,证实在临床剂量下和临床服药周期内对机体无不良作用[9-10]。但佐太在复方药物中增强诸药疗效的作用及其机制仍缺少实验研究和数据支撑。
本研究以抗癌单体药物柔红霉素为研究对象,证实佐太在体外能够促进药物进入癌细胞内部实现药物富集,对药物的增量可以达到40% 以上。同时,能够增加柔红霉素对HN4、K562和HepG2三种癌细胞的促凋亡作用,说明佐太能够通过促进药物吸收达到促进癌细胞凋亡实现增效的作用。体内实验同样证实,佐太能够提高柔红霉素对K562移植瘤生长的抑制作用。
通过研究证实,佐太能够促进单体药物的吸收进而实现增效作用。但它的增效作用机制仍需进一步深入研究。佐太中的主要成份为HgS,这种重金属成份是否以刺激剂或者以载体的形式促进药物吸收,这些问题都需要进一步的实验研究去验证。
