半夏泻心汤及不同配伍组对慢性胃炎大鼠ICC细胞相关受体表达和钙内流的影响
2021-09-24周泽华纪万里王新宏
周泽华, 纪万里, 安 叡, 梁 琨, 王新宏
(上海中医药大学中药学院,上海 201203)
慢性胃炎是一种常见的、多发性的消化系统疾病,病变分布不均匀。主要由炎性细胞(淋巴细胞和浆细胞为主)浸润所导致的胃黏膜慢性炎症或萎缩性病变,也可同时存在中性粒细胞和嗜酸性粒细胞浸润。该病的发病率逐年上升,且有随着年龄的增长而升高的趋势[1]。目前西医治疗以对症处理为主,暂无特效药物,而中药治疗显示出明显优势,中医强调辨证论治,从整体观念出发调整机体状态[2]。中医学并无“慢性胃炎”病名,根据本病的主要临床表现将其划分为“胃脘痛”“痞满”“嘈杂”等范畴。本病以脾虚为本,痰浊、瘀血、湿热为标,为本虚标实之证。疾病日久即可因虚致实,又可因实致虚,导致虚实夹杂,同时多种致病因素又可郁久化热,表现出寒热错杂的临床症状[3]。半夏泻心汤出自张仲景的《伤寒论》,是治疗寒热错杂之心下痞的代表方剂之一,具有和中降逆,开痞散结之功,临床上主要治疗急慢性胃炎。
Cajal间质细胞(interstitial cells of Caja,ICC)作为胃肠道慢波的起搏细胞,是基本电节律的主要传播者,参与了慢波的传导,同时也是胃肠神经与平滑肌细胞联系的重要通道,参与了胃肠神经信息传递过程,在胃肠动力的调控中起着十分重要的作用,与胃肠动力性疾病的发病密切相关。ICC的功能结构异常改变、发育分化障碍、凋亡或自噬引起胃肠道起搏电位、慢波节律和兴奋传导的异常,是多种胃肠道疾病发生的关键机制[4]。既往研究表明[5]慢性胃炎与胃肠功能的障碍有一定关联,文献[6]报道,半夏泻心汤具有调节胃肠道作用,但从半夏泻心汤的配伍角度来研究作用机制的文献较少。中药配伍理论是中医药理论的精华之一,开展方剂配伍规律的现代研究有利于阐释中药复方对疾病的多靶点治疗作用,同时也有助于临床疗效的提高及应用的推广。因此,本实验研究半夏泻心汤及各配伍组对胃肠道运动相关受体的影响,同时,通过观察半夏泻心汤及各配伍组含药血清对ICC细胞内Ca2+浓度的影响,探究半夏泻心汤调节慢性胃炎胃肠道功能的作用机制。
1 材料与方法
1.1 动物 清洁级SD大鼠,雄性,体质量160~180 g,由上海中医药大学实验动物中心提供,动物生产许可证号SCXK(沪)2014-0008,饲养环境温度(22±0.5)℃,相对湿度(50±5)%,12 h/12 h光照/黑暗交替。实验前,所有大鼠适应性饲养7 d,自由进食饮水。
1.2 试剂与药物 半夏泻心汤组方药材黄连、黄芩、人参、甘草、半夏、干姜、大枣均购自上海康桥中药饮片有限公司,经上海虹桥中药饮片有限公司陈燕军药师鉴定为正品,符合2020年版《中国药典》规定。伊托必利(迪沙药业集团有限公司);兔抗5-羟色胺4受体(5-HT4)、兔抗多巴胺D2受体(DA2)、兔抗乙酰胆碱酯酶(AchE)多克隆抗体(北京博奥森生物技术有限公司);小鼠抗c-kit多克隆抗体(上海圣克鲁斯生物技术有限公司);羊抗兔HRP标记二抗、羊抗鼠HRP标记二抗、Fluo-4-AM、Western blot Kit高灵敏度化学发光检测试剂盒(上海碧云天生物技术有限公司);兔抗GAPDH多克隆抗体(美国CST公司);M199培养基、胎牛血清(FBS)(美国Gibco公司);干细胞因子(SCF)、Ⅱ型胶原酶(美国Sigma公司);青链霉素混合液(100X)、D-hanks(美国Solarbio公司);逆转录试剂盒(加拿大Fermentas公司);SYBR Green PCR试剂盒、BCA蛋白浓度测定试剂盒(美国Thermo公司)。
1.3 仪器 TDZ4-WS离心机(上海卢湘仪离心机仪器有限公司);BHC-1300IIB2生物安全柜(苏州金净净化设备公司);Thermo Forma 3111CO2恒温培养箱[赛默飞世尔科技(中国)有限公司];T100 PCR仪(美国Bio-Rad公司);7500实时荧光定量PCR仪(美国ABI公司);DYCZ-24DN电泳仪(北京六一仪器厂);Eclipse Ni荧光显微镜(日本Nikon公司);SP8 激光扫描共聚焦显微镜(德国Leica公司)。
1.4 方法
1.4.1 药液制备 按全方半夏、干姜、黄芩、黄连、人参、大枣、炙甘草12∶9∶9∶3∶9∶6∶9比例,加入10倍量水煎煮45 min,共2次,滤过,合并滤液,浓缩至生药量1.0 g/mL。按比例称取各配伍组饮片,包括辛开组(半夏、干姜),苦降组(黄芩、黄连),甘补组(人参、炙甘草、大枣),同法煎煮。
1.4.2 动物分组 70只大鼠遵循随机分配原则分为正常组、模型组、全方组、苦降组、辛开组、甘补组、阳性药(伊托必利)组,每组10只。
1.4.3 造模及给药 空白组大鼠灌胃给予生理盐水,其余各组大鼠建立寒热错杂型慢性胃炎大鼠模型。采用苦寒泻下法[7],大承气汤按10 g/kg剂量灌胃,隔天1次,连续10 d,第11天开始灌胃给予含4%辣椒的56%乙醇混悬液,剂量8 mL/kg,每3 d 1次,连续9 d,复制热证模型[8]。造模成功后大鼠灌胃给药(依照人单位体质量生药量来求得大鼠单位体质量生药量, 并扩大3倍),分别为全方组15 g/kg、苦降组3 g/kg、辛开组5.5 g/kg、甘补组6.5 g/kg、阳性药组40 mg/kg,而正常组、模型组大鼠每天灌胃给予等剂量生理盐水,均连续7 d。
1.4.4 标本采集及处理 大鼠按0.4 mL/100 g剂量腹腔注射20%乌拉坦溶液麻醉,分离胃部并沿胃长缘剪开,生理盐水洗去胃内容物,滤纸吸干,4%多聚甲醛固定,使组织细胞中的蛋白变性并固化,进行病理学检查。另取胃组织,RT-qPCR法检测5-HT4、AchE、DA2、c-kitmRNA表达,Western blot法检测蛋白表达。
1.4.5 HE染色 将在4%多聚甲醛中固定过夜的大鼠胃组织放到包埋盒中,自来水冲洗6 h,梯度乙醇脱水,二甲苯透明,浸蜡,包埋,切片(约4 μm厚),脱蜡至水,进行HE染色,在光镜下观察其形态学。
1.4.6 RT-qPCR法检测5-HT4、AchE、DA2、c-kitmRNA表达 取冻存的各组大鼠部分胃组织,按照说明书提取总RNA,逆转录合成cDNA,采用实时荧光定量PCR仪对5-HT4、AchE、DA2、c-kit进行相对定量分析,目标基因通过2-△△CT公式计算,引物序列由上海基尔顿生物科技有限公司设计,见表1。
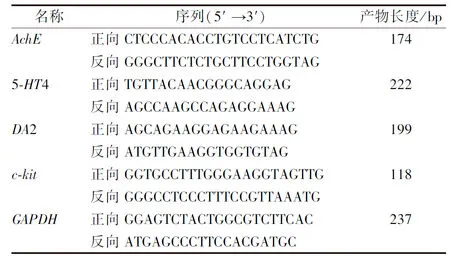
表1 RT-qPCR引物序列
1.4.7 Western blot检测5-HT4、AchE、DA2、c-kit蛋白表达 取冻存的各组大鼠胃组织,称定质量,置于2 mL离心管中,按1∶10比例加入RIPA裂解液,机械匀浆1 min,10 000×g离心5 min,取上清,BCA法定量,SDS-PAGE电泳分离,转膜,5%BSA室温下封闭1 h,加入5-HT4(1∶500)、AchE(1∶500)、DA2(1∶300)、c-kit(1∶500),4 ℃过夜,TBST洗膜,加入HRP标记的二抗(1∶1 000),室温下孵育1 h,TBST洗膜,ECL化学发光试剂盒检测,凝胶成像系统拍照,以GAPDH为内标,检测5-HT4、AchE、DA2、c-kit蛋白的相对表达量。
1.4.8 免疫荧光法检测5-HT4、AchE、DA2、c-kit蛋白共表达 将各组大鼠胃组织切片在二甲苯中浸泡,脱蜡后切片,浸入梯度乙醇中脱二甲苯,0.01 mol/L PBS缓冲液冲洗,正常山羊血清封闭,37 ℃下放置30 min,滴加兔抗大鼠5-HT4(1∶500)、AchE(1∶500)、DA2(1∶300)抗体、小鼠抗大鼠c-kit抗体(1∶500),置于湿盒中,4 ℃下过夜,取出切片,37 ℃下复温60 min,0.01 mol/L PBS缓冲液冲洗,免疫荧光双标记滴加羊抗兔HRP标记二抗、羊抗鼠HRP标记二抗(1∶1 000),37 ℃下放置40 min,0.01 mol/L PBS缓冲液冲洗,100 g/L缓冲甘油封固,在荧光显微镜下观察拍照,并记录荧光强度值。
1.4.9 ICC细胞分离与培养 大鼠禁食18 h后腹腔注射10%水合氯醛(3 mL/kg)麻醉,无菌条件下取胃窦组织,4 ℃预冷的D-hanks液反复冲洗胃内容物,胃窦组织剪成1 cm3左右小块,将呈糜状者移入离心管中,加3 mL 4%Ⅱ型胶原酶充分吹匀,37 ℃下消化30 min,1 000 r/min离心3 min,弃去上清,加入D-hanks液反复吹打10 min,再离心弃上清,加入M199基础培养基应用液重悬沉淀,过200目网筛去除大块组织,将所得悬液加到等体积Ficoll溶液中,离心,取中间沉淀,加到M199培养基中,细胞计数后将其接种至6孔板上,37 ℃、5% CO2下培养24 h后换液,每隔2~3 d 1次,细胞稳定培养7 d后进行后续研究。
1.4.10 ICC细胞鉴定 细胞稳定培养后,0.02 mol/L PBS洗去培养基,4%甲醛固定30 min,0.02 mol/L PBS缓冲液冲洗,0.5% TritonX-100通透10 min,0.02 mol/L PBS缓冲液冲洗,1%BSA封闭1 h,0.02 mol/L PBS缓冲液冲洗,加入小鼠抗c-kit多克隆抗体(1∶500),置于湿盒中,4 ℃下孵育过夜,0.02 mol/L PBS缓冲液冲洗,滴加羊抗鼠HRP标记二抗(1∶1 000),置于湿盒中孵育,室温下放置1 h,0.02 mol/L PBS缓冲液冲洗,防淬灭封片剂与DAPI(1∶500)稀释封片,置于-20 ℃冰箱中保存,荧光显微镜拍片。
1.4.11 含药血清制备 将60只大鼠随机分为空白血清对照组、全方组、苦降组、辛开组、甘补组、阳性药组,灌胃给药量与“1.4.3”项下相同,连续7 d,处死,腹主动脉取血,12 000×g高速离心,取上清液,56 ℃下灭活,-80 ℃下保存备用。
1.4.12 细胞分组及给药 取对数生长期的ICC细胞,稀释成1×105个/mL单细胞悬液,接种于96孔培养板上,每孔0.1 mL,每组设3个复孔,RPMI 1640培养基常规培养24 h,随机分为正常组(25%空白血清)、模型组(NO 30 μmol/L)、全方组(NO 30 μmol/L+25%含药血清)、苦降组(NO 30 μmol/L+25%含药血清)、辛开组(NO 30 μmol/L+25%含药血清)、甘补组(NO 30 μmol/L+25%含药血清)、阳性药组(NO 30 μmol/L+25%含药血清)。
1.4.13 Ca2+含量测定 将各组ICC细胞加到0.2 mL 5 μmol/L Fluo-4-AM中,37 ℃下避光孵育 30 min,吸出染液,D-Hanks液冲洗3次,加入0.2 mL D-Hanks液,Fluo-4-AM溶液处理5 min,激光共聚焦显微镜观察拍照,设定激发波长为488 nm,发射波长为522 nm,采样频率为488 Hz,每皿选3~5个视野及4个形态良好的细胞,采ZEN blue edition 2.5软件进行荧光强度分析,以荧光强度增高的比值来衡量钙含量变化。

2 结果
2.1 大鼠胃组织HE染色 造模后,大鼠胃组织固有层-黏膜下-浆膜层有淋巴细胞浸润,肌层散在少量淋巴细胞,黏膜下水肿,固有层少许充血,为慢性浅表性胃炎(非萎缩性)的典型症状,表明模型建立成功。给药后,全方组、辛开组、苦降组、甘补组、阳性药组大鼠症状明显好转,胃黏膜表面上皮细胞受损、炎细胞浸润状况较模型组明显减轻,胃腺排列稍整齐平整, 黏液增厚且腺管构造逐渐规则。见图1。
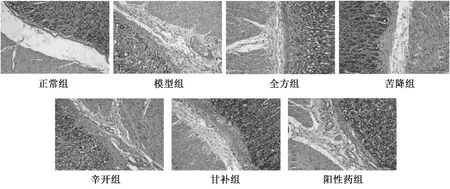
图1 各组大鼠胃组织HE染色(×200)Fig.1 HE staining of rat gastric tissues in various groups(×200)
2.2 半夏泻心汤对5-HT4、AchE、DA2、c-kitmRNA表达的影响 与正常组比较,模型组AchE、5-HT4、c-kitmRNA表达降低(P<0.05,P<0.01),DA2 mRNA表达升高(P<0.01),表明模型建立成功;与模型组比较,全方组及各配伍组能不同程度提高AchEmRNA表达(P<0.05,P<0.01),降低DA2 mRNA表达(P<0.01),以全方组及甘补组更明显;全方组可提高5-HT4、c-kitmRNA表达(P<0.05,P<0.01);除辛开组可提高5-HT4 mRNA表达(P<0.01)外,其他各配伍组均无明显变化(P>0.05),表明半夏泻心汤及配伍组可调节大鼠胃肠动力,有利于恢复其正常功能。见图2。
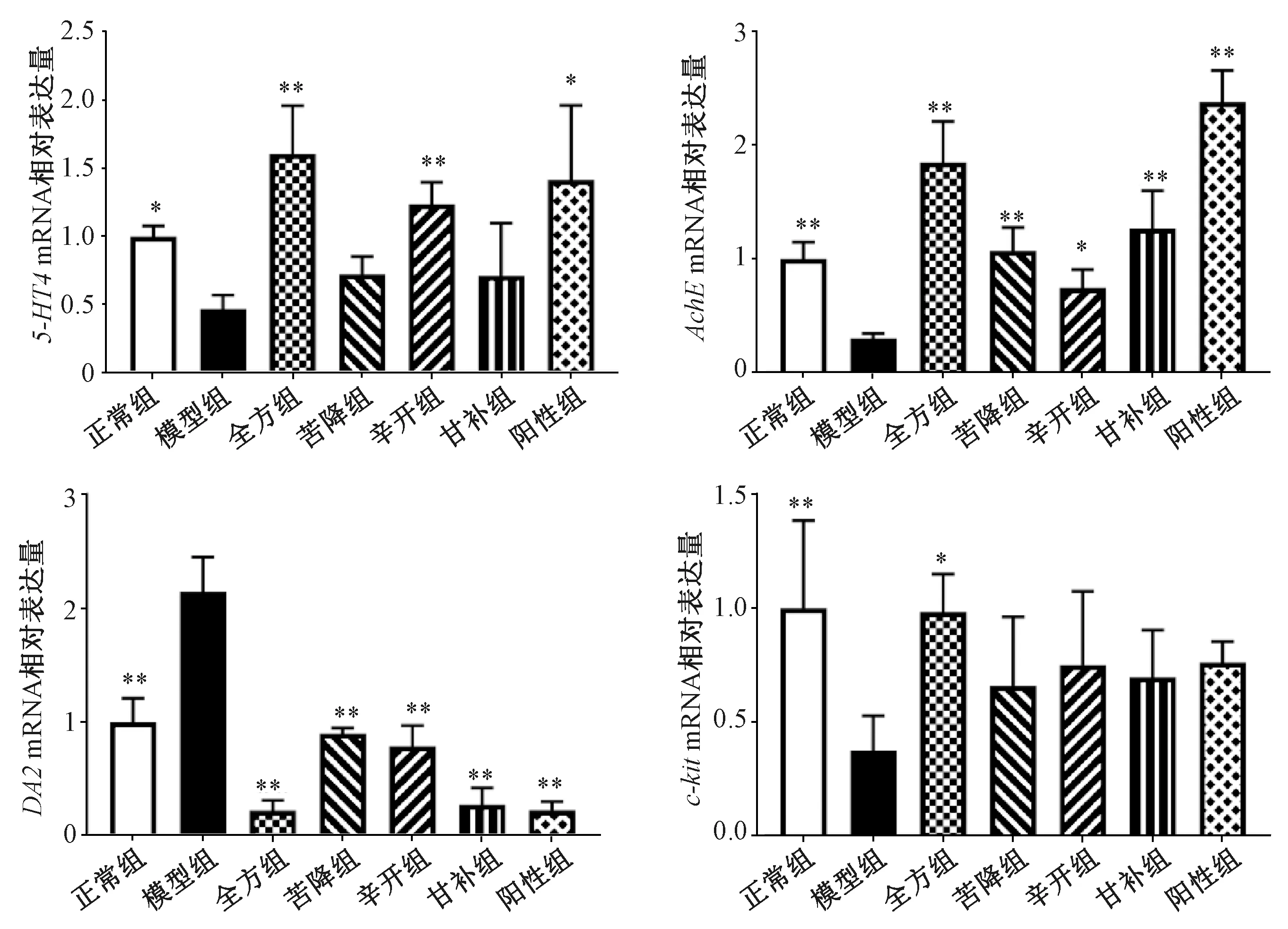
注:与模型组比较,*P<0.05,**P<0.01。图2 半夏泻心汤对5-HT4、AchE、DA2、c-kit mRNA表达的影响Fig.2 Effects of Banxia Xiexin Decoction on mRNA expressions of 5-HT4, AchE, DA2 and
2.3 半夏泻心汤对5-HT4、AchE、DA2、c-kit蛋白表达的影响 模型组大鼠胃组织中AchE蛋白表达与正常组比较降低(P<0.05),而全方组及配伍组可提高其蛋白表达(P<0.05)。与正常组比较,模型组大鼠胃组织中5-HT4蛋白表达降低(P<0.01),而全方组及配伍组可提高其蛋白表达(P<0.05,P<0.01),以全方组和辛开组更明显(P<0.01);DA2蛋白表达升高(P<0.05),而全方组及配伍组可降低其蛋白表达(P<0.05,P<0.01),以全方组更明显(P<0.01);c-kit蛋白表达降低(P<0.01),而全方组及配伍组可升高其蛋白表达(P<0.01)。见图3。
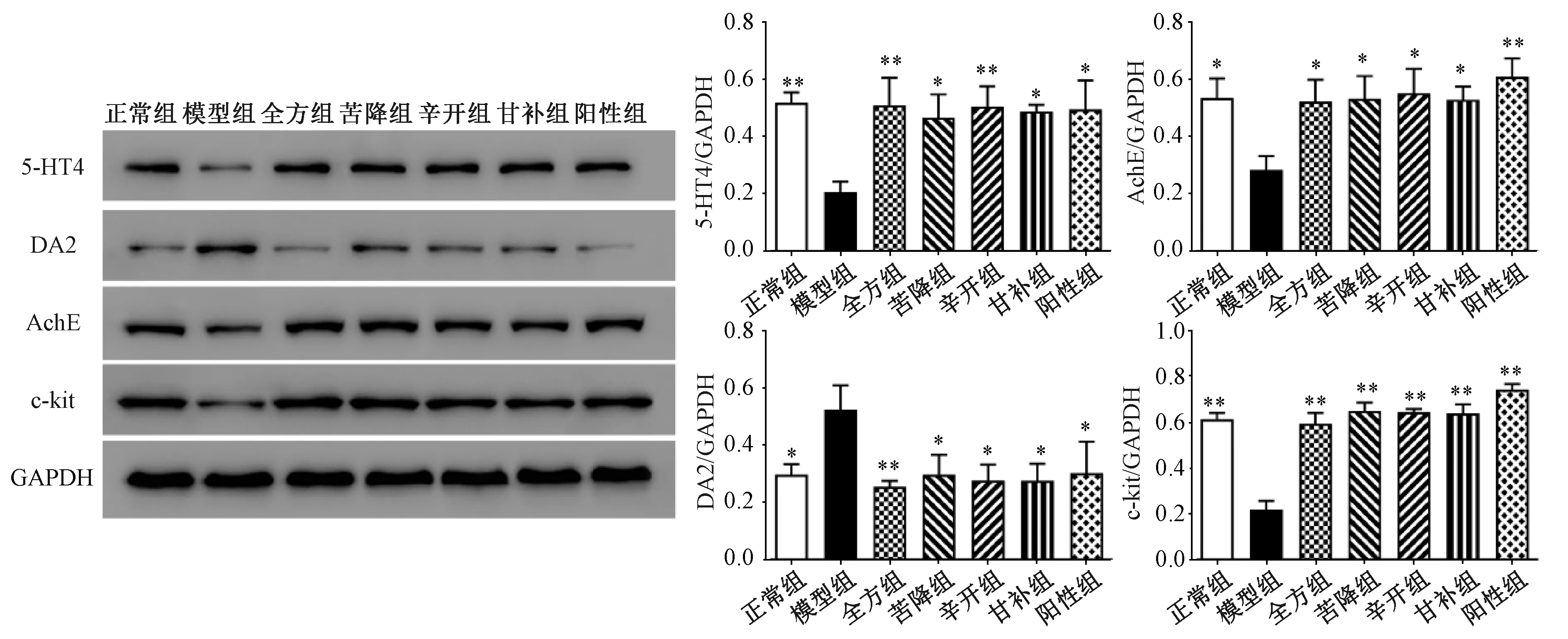
注:与模型组比较,*P<0.05,**P<0.01。图3 半夏泻心汤对5-HT4、AchE、DA2、c-kit蛋白表达的影响Fig.3 Effects of Banxia Xiexin Decoction on protein expressions of 5-HT4, AchE, DA2 and
2.4 半夏泄心汤对5-HT4/AchE/DA2、c-kit蛋白共表达的影响 与正常组大鼠比较,模型组大鼠胃组织5-HT4、c-kit荧光强度水平降低,经全方组及配伍组干预后明显升高(图4A);AchE荧光强度水平低于正常组,而全方组及配伍组能提高其水平,同时还可提高c-kit荧光强度值(图4B);DA2荧光强度高于正常组大鼠,出现了DA2/c-kit蛋白共表达,而全方组及配伍组可降低其荧光强度(图4C)。
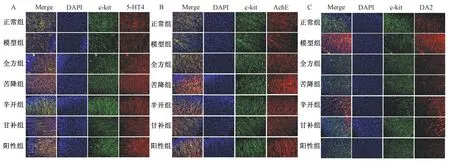
图4 各组5-HT4(A)、AchE(B)、DA2(C)与c-kit蛋白共表达Fig.4 Co-expressions of 5-HT4 (A), AchE (B), DA2 (C) and c-kit protein in various groups
2.5 ICC细胞形态及鉴定 稳定培养7 d后,在倒置显微镜下可见ICC细胞呈三角形、梭形或多边形、核大,周围充满胞浆,胞体发出多条大小不等的树枝状突起,突起与周围细胞的胞体和突起相互连接,见图5。免疫荧光染色后,细胞表面c-kit呈绿色阳性显性,胞体和突起均明显荧光染色,见图6。

图5 光镜下ICC细胞形态Fig.5 Morphologies of ICC cells under light microscope
图6 荧光显微镜下ICC细胞形态Fig.6 Morphologies of ICC cells under fluorescencemicroscope
2.6 半夏泻心汤全方对ICC钙流的影响 与正常组比较,模型组ICC细胞钙离子荧光强度增强(P<0.05);与模型组比较,全方组及配伍组能降低ICC内钙离子荧光强度(P<0.05,P<0.01),以全方组更明显(P<0.01),表明全方组及各配伍组能不同程度抑制ICC钙离子内流的作用。见图7。
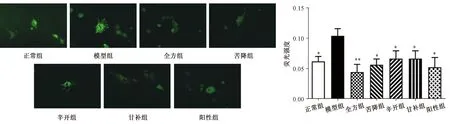
注:与模型组比较,*P<0.05,**P<0.01。图7 各组ICC细胞中Ca2+的Fluo-4-AM荧光染色及荧光强度值Fig.7 Fluo-4-AM fluorescence staining and fluorescence intensity of Ca2+ in ICC cells in various
3 讨论
ICC被称为胃肠动力的“起搏者”和“调节者”[9],c-kit表达是在胃肠肌ICC中存在的主要标志物[10]。ICC中上述受体与胃肠神经系统释放的神经递质和肽类物质结合,将神经信息传送给平滑肌细胞,从而调控胃肠道平滑肌的舒缩是ICC细胞发挥功能的主要机制之一。本研究发现,半夏泻心汤及不同配伍可通过调节AchE、5-HT4、DA2及c-kit的mRNA表达、蛋白表达,达到改善慢性胃炎的目的。其中,全方组在调节各受体及c-kit的mRNA和蛋白表达方面的效果皆极显著,这与之前的研究结果相符[11-14]。其他各配伍组间效果则较为接近。其中,辛开组可极显著提高5-HT4的mRNA和蛋白表达,推测是由于组中半夏和干姜均属味辛性温的中药,而此前王鹏等[15]发现,温热性中药能够上调大鼠血清5-HT的作用。苦降组和甘补组则能极显著提高AchE的mRNA表达,可能源于苦降组中黄芩与黄连,据报道[16],黄芩可使大鼠血清中乙酰胆碱(Ach)升高,进而增加Ach水解酶AchE的活性。黄连则可提高大鼠外周组织中乙酰胆碱转移酶(ChAT)活性而间接增强AchE的活性。此外,甘补组能极显著提高AchE的mRNA表达的原因,可能与人参具有提高AchE活性的作用有关[17]。
ICC细胞还可通过起搏胃肠道慢波产生自发电节律变化并参与慢波的传导发挥功能。本研究显示,半夏泻心汤及各配伍组能不同程度降低ICC细胞内Ca2+的荧光强度,其中全方组效果较各配伍组更好。提示半夏泻心汤及各个配伍组可通过降低ICC细胞内的Ca2+浓度,抑制ICC钙超载,防止ICC兴奋节律失常,从而调节胃肠道运动,与文献[14]报道相符。
ICC的两个功能间可能也具有一定的关联性。如胃肠道的5-HT4可激活腺苷环化酶[18],黄棪等[19]就曾发现,旋覆代赭汤可使5-HT4表达增加,促进cAMP释放,打开电压门控钙通道,最终使胞内Ca2+浓度升高。至于半夏泻心汤降低ICC细胞内的Ca2+浓度并调节胃肠道神经递质的进一步机制,以及ICC细胞内Ca2+与这些神经递质之间是否也存在类似的关联性,还有待深入研究。
