心肌能量底物代谢重构与心力衰竭关系的研究进展
2021-09-24高文静马宏项美香
高文静,马宏,项美香
浙江大学医学院附属第二医院心血管内科,杭州 310009
心脏是一个高能量消耗的器官,健康心脏主要依靠脂肪酸氧化代谢产生的三磷酸腺苷(adenosine triphosphate,ATP)提供能量。但在病理情况下,心肌能量代谢发生紊乱,ATP生成不足并迅速耗竭,心脏随之出现功能障碍[1]。心力衰竭是一种涉及心脏结构和功能损伤、心室充盈或射血能力下降的综合征,是各种心脏疾病的终末状态[2]。大量研究已证实,心力衰竭时心肌底物代谢严重受损,对脂肪酸和葡萄糖等底物的选择和利用发生重构,心肌能量代谢失调可进一步导致心力衰竭的进展和恶化[3]。充分认识心力衰竭时底物代谢变化的规律,并进一步研究其调控机制,有助于改善心肌的舒缩功能,延缓衰竭进程,有望成为治疗心力衰竭的一种新策略[4-5]。本文系统回顾了相关文献,对心力衰竭时心肌能量代谢底物转变,尤其是近年来以酮体作为底物的最新研究进展进行综述,旨在为心力衰竭的治疗提供新靶点和新策略。
1 正常心脏能量代谢的特点
心脏可利用多种底物产生能量以满足全身供血的需求[6],如游离脂肪酸(FFA)、葡萄糖、乳酸、酮体和氨基酸等物质。正常情况下,心脏的收缩及基础代谢主要由脂肪酸(60%~90%)和葡萄糖(10%~40%)氧化磷酸化产生的ATP提供能量,极少量的能量由糖酵解来提供(图1)。心脏ATP储备量相对较低,而分解速率高,正常情况下大约每10 s心脏ATP池即可完成一次周转[7]。线粒体氧化代谢为心肌耗能提供了绝大部分能量,糖酵解产生的ATP仅占总能量的2%。健康的心脏能量代谢具有灵活性,可根据心肌的能量负荷、底物供应及营养状态等情况利用复杂的调控网络来调整不同底物代谢的比例,达到动态平衡,从而确保最高效的能量输出,维持正常的舒缩功能[8-9]。
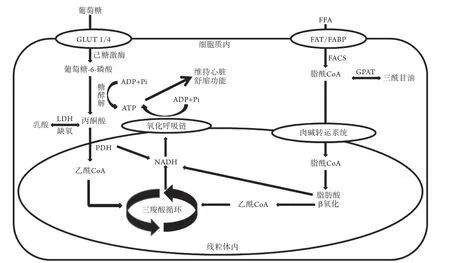
图1 正常心肌能量代谢过程示意图Fig.1 Schematic diagram of energy metabolism in normal myocardium
1.1 心肌脂肪酸代谢 心脏吸收脂肪酸的速率主要取决于血浆中FFA的浓度,正常情况下,其浓度范围为0.2~0.8 mmol/L;在缺血、糖尿病或饥饿等代谢应激条件下,血浆FFA浓度可增加至更高水平(>1.0 mmol/L)[7]。脂肪酸通过被动扩散或蛋白介导的肌膜转运进入心肌细胞,细胞膜上的脂肪酸转运酶(FAT)及脂肪酸结合蛋白(FABP)参与了该过程。脂肪酸穿过肌膜后,经脂肪酸酰基辅酶A合成酶(FACS)转化为脂酰辅酶A,脂酰辅酶A通过甘油磷酸酰基转移酶转化为三酰甘油,也可通过肉碱系统转运至线粒体进行β-氧化。参与脂肪酸β-氧化的酶受到高度的转录调控,在很大程度上是由过氧化物酶体增殖物激活受体(PPAR)及过氧化物酶体增殖物激活受体γ辅助活化因子1(PGC-1)所介导的[10-11],而机体则主要通过上调或下调这些酶的表达来调控脂肪酸β-氧化过程。在健康心脏中,70%~90%的脂肪酸最终进入线粒体进行β-氧化,其余10%~30%则进入心肌三酰甘油池[12]。
1.2 心肌葡萄糖代谢 心肌细胞的葡萄糖转运受跨膜葡萄糖梯度和肌膜中葡萄糖转运蛋白(GLUT,主要是GLUT-4,其次是GLUT-1)含量的调节,GLUT-4进入肌膜受到AMP激活蛋白激酶(AMPK)的调控。研究表明,AMPK表达缺失的转基因小鼠其葡萄糖摄取率降低,表明AMPK在调节心脏基础葡萄糖摄取方面起关键作用[13]。葡萄糖进入细胞后经己糖激酶磷酸化形成葡萄糖-6-磷酸,糖酵解途径将葡萄糖-6-磷酸和NAD+转化为丙酮酸和NADH,每个葡萄糖分子产生2个ATP。糖酵解形成的丙酮酸主要有两种去向:当氧供充足时,进入线粒体基质,在丙酮酸脱氢酶的作用下脱羧生成乙酰辅酶A,进入三羧酸循环完成有氧氧化过程;当缺氧时,丙酮酸则更倾向于在胞质中转化为乳酸或羧化为草酰乙酸和苹果酸,以维持三羧酸循环的功能及中间体池的大小。
1.3 心肌酮体代谢 酮体是人体脂肪酸在肝脏氧化分解的中间产物,包括β-羟丁酸、乙酰乙酸和丙酮,分别占78%、20%和2%。酮体生成后进入血液并从肝脏输出到全身,正常情况下动脉血酮体浓度较低,通常为心肌的次要底物。在饥饿或糖尿病控制不佳继发低胰岛素和高脂肪酸血症时,血浆酮体浓度升高,并成为心肌的主要底物。Bedi等[14]发现,酮体的利用是心力衰竭的晚期事件,且酮体的氧化代谢和遗传谱特征仅在衰竭的心脏中存在,提示酮类的利用是心力衰竭的一种代谢适应过程。另有研究表明,心脏优先利用酮体氧化提供能量,不仅可以改善心功能,还可以提高心脏效率[15]。
2 心力衰竭时心肌能量底物的代谢重构
目前,关于心力衰竭时心肌基质代谢和底物转化的临床和动物模型研究结果不尽一致。较早的研究发现,充血性心力衰竭患者FFA摄取增加,而葡萄糖摄取减少;同时,心肌脂质氧化率增高了50%,而葡萄糖氧化则降低了60%[16]。然而,心力衰竭患者血液中去甲肾上腺素的增加会导致血中FFA浓度升高,胰岛素水平的升高也会刺激心脏对葡萄糖的吸收和氧化,血浆底物和激素浓度的变化使心肌代谢途径的变化与代谢环境的变化难以区分。
正电子发射计算机断层扫描(positron emission tomography,PET)在评估心肌能量代谢方面的应用越来越广泛[17-18]。Taylor等[19]使用18F-脱氧葡萄糖(18F-FDG)和14(R,S)-18F-氟-6-硫杂十七烷酸[14(R,S)-18F-fluoro-6-thia-heptadecanoic acid,18F-FTHA]作为示踪剂,采用PET检测充血性心力衰竭患者的脂肪酸和葡萄糖摄取情况,结果发现Ⅲ级心力衰竭患者心肌对放射性标记脂肪酸类似物的摄取更多,而对脱氧葡萄糖的吸收减少。相反,Dávila-Román等[20]使用PET评估非缺血性特发性扩张型心肌病患者的心肌血流、能量消耗、脂肪酸和葡萄糖代谢情况时发现,与健康受试者相比,二者在动脉血压、血浆FFA或胰岛素水平、心肌血流量和耗氧量方面差异无统计学意义,但心力衰竭患者脂肪酸吸收和β-氧化下降了40%,葡萄糖摄取则增加了1倍。
心力衰竭是一种病因多样的综合征,常与肥胖、胰岛素抵抗或2型糖尿病相关,当心力衰竭患者伴有其他代谢性疾病时,其代谢底物的转化比单纯心力衰竭患者更为复杂[21],因此,在研究心力衰竭患者心肌代谢底物的转化时必须要排除其他代谢性疾病的影响。Tuunanen等[22]较早认识到了这一点,发现单纯的特发性扩张型心肌病(IDCM)患者心肌FFA(11C-棕榈酸酯)的摄取明显低于伴有胰岛素抵抗的IDCM患者,但目前仍不清楚此差异是否仅与血浆脂肪酸和葡萄糖水平改变有关,还是与心脏代谢的内在变化有关。另一项针对非糖尿病性扩张型心肌病患者的研究发现,在心力衰竭失代偿期,患者心肌的长链酰基肉碱等大多数心肌脂质中间产物的浓度明显降低[14]。此外,心力衰竭的病因、严重程度及检测方法的不同,也导致了心力衰竭时心肌底物代谢研究中的异质性。但总体来说,这些数据支持了这样一种观点,即在心力衰竭的早期阶段,脂肪酸的氧化速率是正常的(或略微升高),而在终末期,脂肪酸的氧化速率明显下降。
大量心力衰竭动物模型研究也进一步证实了上述临床研究的结论。Doenst等[23]利用大鼠心力衰竭模型证实了在心力衰竭早期脂肪酸氧化就已经受损,到了晚期或终末期时脂肪酸氧化则明显下调。大鼠冠状动脉结扎模型显示,大鼠心肌梗死后8周,左心室功能出现障碍,但心肌耗氧量和棕榈酸氧化正常[24];大鼠心肌梗死后6个月,心肌棕榈酸氧化水平出现明显下降[25]。在主动脉腔静脉内瘘或慢性高血压引起的左室肥厚和收缩功能障碍大鼠中也观察到类似的FFA氧化降低[26-27]。在快速起搏诱导的犬心力衰竭模型中,心力衰竭早期时心肌底物代谢正常,而到晚期时心肌脂肪酸的吸收和氧化均明显下降,脂质代谢酶表达降低,但葡萄糖的吸收和氧化可维持在正常水平[28]或显著增加[29-31]。
3 心力衰竭时的酮体代谢
心力衰竭后底物如何转化尚未得出一致的结论,过去的研究主要集中在脂肪酸和葡萄糖代谢方面,但是,近年来酮体作为次要的能量底物也越来越受到研究者的关注。动物模型和临床研究发现,晚期心力衰竭时酮体的利用增加,提示酮体可能代替FFA成为晚期心力衰竭的替代能量底物[32-33]。Aubert等[32]在压力超负荷引起的心肌肥厚和心力衰竭小鼠模型中,利用定量线粒体蛋白质组学方法来研究能量代谢紊乱,结果发现在衰竭心脏的心肌样本中,参与脂肪酸利用的蛋白质下调,酮体氧化途径中的关键酶β-羟丁酸脱氢酶1(BDH1)表达水平增高。进一步在体外利用MRI结合质谱心肌代谢组学的靶向定量分析发现,在氧化脂肪酸能力降低的情况下,肥大和衰竭的心脏转向氧化酮体作为能量来源。另外,该研究还证实,衰竭心脏向酮体氧化的转变可能是由于血浆中酮体浓度增高及基因调控引起的酮体氧化、吸收能力增强所致。在另一项研究中,Bedi等[14]采用液相色谱-质谱法对非糖尿病性晚期心力衰竭患者进行无偏倚和靶向性的心肌脂质调查,结果发现包括长链酰基肉碱在内的大多数心肌脂质中间物浓度明显降低,而心肌β-羟丁酸(β-OHB)利用率增高,琥珀酰辅酶A转移酶(SCOT)基因表达增加,而SCOT是β-OHB和乙酰乙酸在心肌氧化中的速率限制酶。这些结果均证实了酮体作为心力衰竭时替代能量底物的作用。
为了更好地了解与功能和结构重建相关的能量代谢适应,2018年Voros等[33]抽取患者动脉(arterial,A)及冠状窦(coronary sinus,CS)的血液并进行A-CS浓度梯度对比,测量了射血分数降低的心力衰竭(HFrEF)及严重主动脉瓣狭窄(AS)导致的左室肥厚患者的心脏对FFA、乳酸、葡萄糖、酮体和主要氨基酸的摄取情况。结果发现,与对照组相比,HFrEF组与AS组心脏对酮体的摄取均明显增加(4~5倍),AS组患者心肌FFA摄取明显增加,而HFrEF组则未见增加,且两组葡萄糖摄取均未发生明显变化;两组患者血浆中游离肉碱的浓度相当,虽然与对照组相比,HFrEF组与AS组动脉和冠状窦内多种酰基肉碱的浓度明显升高,但A-CS浓度梯度并无明显差异。这表明心力衰竭患者血浆中酰基肉碱的升高并非由心肌直接释放增多造成的,而是反映了更广泛的代谢失调。此外,心肌释放的酰基肉碱种类和摄入的游离肉碱量并未发生明显变化,表明FFA氧化并未受到明显损伤。
目前,仍不清楚心力衰竭时酮体的利用增加是代偿性的还是非适应性的,但部分研究表明酮体氧化对HFrEF患者是有益的。依帕列净是一种钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂,可降低心力衰竭患者的心血管病死率和住院率[34]。其中可能的机制之一是依帕列净可增加血浆酮体浓度,从而提高心肌能量代谢效率[35]。另一项研究表明,注入β-羟丁酸的心脏血管舒张,心肌血流量增加[36]。因此,心力衰竭时酮体氧化的增加,更被认为是一种机体的适应性反应。虽然酮体氧化增加可以为衰竭的心脏提供额外的能量,但并不能提高心脏效率[37]。通过生酮饮食增加循环中的酮体水平,对心力衰竭患者心脏功能的益处也不显著。但新近研究表明,增加酮酯的摄入可以明显改善心脏功能[38]。因此,进一步研究酮体在心力衰竭患者能量代谢重构中的作用和机制,有可能为心力衰竭的治疗提供新策略。
4 总结与展望
综上所述,心力衰竭时心肌底物代谢发生重构,虽然目前的研究结果尚不一致,但越来越多的证据表明,心力衰竭的早期阶段心肌的底物代谢重构可能是一种适应性反应,晚期则会引起内环境的紊乱,加快心力衰竭的进程。通过改善心肌的底物代谢,可以更好地保护和改善心肌功能,延缓心力衰竭进展,为心力衰竭的治疗提供新靶点和新策略。目前,能量代谢疗法已成为研究的热点[39],但与底物代谢研究一样,关于代谢疗法的认识也未完全统一,心力衰竭时底物的转化究竟是代偿性的还是非适应性的,哪种底物的能量代谢对机体更有益,目前仍无定论。虽然曲美他嗪在2016年欧洲心脏病学会心力衰竭指南中被纳入心力衰竭合并心绞痛的治疗策略,但其通过降低脂肪酸、促进葡萄糖利用从而改善心肌代谢的疗效仍存在争议[40-41],而酮体作为心肌底物的研究有可能为心力衰竭代谢疗法提供新的方向。如何全面认识心力衰竭时心肌底物的代谢重构并利用代谢药物改善这一过程,仍需进一步的研究与探索。
